
-
Система. Изолированная , закрытая и открытая системы.
Термодинамическая система состоит из очень большого числа частиц порядка числа Авогадро.
Система- тело или группа тел находящихся во взаимодействии и выделяемых от окруж. среды
Изолированная система- система, не обменивающаяся энергией и веществом с окружающей средой
Закрытая система- система не обменивающаяся веществом с окруж. Средой .
Открытая система- обменивается энергией и веществом с окружающей средой.
2) Гетерогенная и гомогенная системы. Фаза.
Гетерогенная система- система в которой есть поверхности раздела между частицами и различными свойствами.
Гомогенная система- система в которых указанных выше ,поверхностей раздела нет.
Фаза- совокупность гомогенных частей с одинаковыми свойствами.
3) Свойство. Экстенсивные и интенсивные свойства.
Свойство системы- такая величина х , изменения которой в процессе не зависит от пути перехода системы из начального состояния в конечное .
Св-ва бывают 2-х типов:
Экстенсивные –выражается через единицы этого же св-ва. И следует принципу аддетивности.
Принцип аддетичности-значение св-ва свей системы = сумме значения св-ва ее частей.
Интенсивное св-во- выражается через связь с каким либо экстенсивным свойством.
4)Нулевой закон термодинамики.
Понятия равновесия в механике и термодинамике различаются, в механике рассматриваются взаимодействия малого числа тел, когда можно оценить силы действующие на все тела, в термодинамике число огромно и неизвестно , но из опыта мы знаем , если привести в контакт 2 системы так, чтобы они обменивались энергией в форме теплоты, то по пришествию некоторого времени эти системы придут в тепловое равновесие.
Если А находится в теловом взаимодействии с системой С и если система Б наход. В тепловом взаимодействии с системой С, то системы А и Б наход. В тепловом равновесии.
(А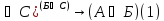
Из (1) следует, что большая совокупность частиц , из которых состоит система обнаруживает свойства которых у каждой частицы в отдельности нет
Значение этого свойства увеличить у системы полученную энергию в форме теплоты.
При тепловом равновесии значение этого свойства у контактирующих систем одинаковы назовем это свойство температурой.
(Та=Тс)^(Тб=Тс)->(Та=Тб) (2)
Св-во выраженное нулевым законом называется трандитивностью.
Св-во трандитивности позволяет использовать 3-е число для суждения о температуре других тел.
5)Термодинамическая шкала температуры.
Для построения температурной шкалы нужно выбрать термодинамическое вещество и его какое-либо св-во связанное с…..
В качестве малого вещества возьмем идеальный глаз, для которого справедливо уравнение состояния.
pV=f(T) (3) Ни о значении температуры, ни о виде функции f (t) ничего нельзя сказать в отрыве от допущенной делая вывод о температуре шкалы. В качестве одного совершенного произвольного допущения примем, что функция f(t) линейная.
f(t) =at , a=const (4)
(3,4) при p=const ->V2/V1 =T2/T1 (5)
Пусть Т2 –температура изменения воды, а Т1- температура таяния льда . Из опыта известно, что в этих условиях :
V2/V1=1.3661 (6)
(5,6) следует-> T2/T1=1/3661 (7)
Для того чтобы охарактеризовать число не только отношение Т2/Т1, но и сами эти температуры принимающих 2 также совершенно произвольных допущения.
Т2-Т1=100 (8)
(7,8) -> T1-273.15 K , T2=373.15 K
6)Принцип эквивалентности теплоты и работы. Что такое Q и W?
Работа –количественная мера передачи энергии от одной системы к другой путем направленного в пространстве перемещения микроскопических масс.
Теплота – количественная мера передачи энергии от одной системы к другой системе путем хаотического движения частиц из которых состоят системы.
Опыт: Груз падает ,мешалка вращается. Вода из-за грения нагревается. Вернем систему в исходное состояние для этого поднимем груз на исходную высоту и дадим время термостату остыть до исходного Т (при этом в окр. Среду будет переданная энергия в форме теплоты)
Процесс в котором система изменялась но в конце процесса вернулась в исходное состояние называется круговым процессом .
Многочисленные опыты показали, что в круговых процессах наблюдается постоянное соотношение между теплотой и работой
/ Равенства 1 и 2 выражают как эквивалентности теплоты и работы
Если W и Q c помощью коэффициентов выражены в одинаковых единицах, то эквивалент примет вид :
W ’=Q (3)
Вне
круговых процессах W
не равняется W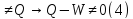
7) Внутренняя энергия. Первый закон термодинамики.
⧋U=Q-W
U-назыв. Внутр. Энергией системы. Это все виды энергии включая неизвестные минус кинетическую энергию и потенциальную энергию системы как целое.
mV2\2 Из выражения следует что ни для какой системы внутренняя энергия не может быть определенной , однако ее определение может быть вычисленным. Q и W –не свойства системы (зависит от пути перехода ) но их разность равняется сумме свойства системы (оно не зависит от пути перехода)
В любом процессе изменение внутренней энергии системы равно количеству теплоты полученной системой минус количество работы совершенной системой против всех внешних систем (мы считаем положительную теплоту полученную системой и работу совершенную системой)
В случае изолированной системы не обменивающаяся энергия с чем-либо)
Q=0 ,W=0
⧋U изол. Сист. =0 U=const
8)Квазистатические (равновесные) и обратимые процессы
Рассмотрим процесс расширения по схеме. Скачкообразное падение давления + увеличение объема до нового равновесного состояния
(график)
Чем меньше ⧋p чем меньше величины ⧋Vтем ближе ломанная линия подходит к равновесной прямой в пределе при ⧋V и ⧋p ->0 процессе будет протекать через состояние бесконечно близким к равновесным состояниям
Процесс, который и в прямом и обратном направлении протекает через состояния бесконечно близкими равновесным состояниям называются равновесными(квазистатическими) состояниями. Максимальная работа совершается в равновесном процессе.
Обратные процессы- это такой равновесный процесс который при проведении его в прямом и обратном направлении возвращает в исходное состояние не только систему но и окружающую среду.
9) Работа различных процессов . Примеры. Что такое полезная работа?
Общее выражение работы имеет вид:
SW=[Xj d Xi]
Xj-обобщенная сила
Xi –обобщенная интеграция
sW- бесконечно малое количество работы или элементарная работа
-
Работы расширения против внешнего давления
sW=pdV (2) работа расширения всей массы поля тяжести.
2)sW=mgd (3) изменение высоты подъема sW=pdV+SW’ (4)
W’- полезная работа все виды работ кроме работы расширения
(2)- V=const (работа расширения=0) Изохорный процесс объем не меняется.
Изобарный
процесс p=const -> W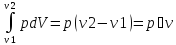
T=const изотермический процесс (знать состояние)
Идеальный газ pv=nRT ->p=nRT/V
W=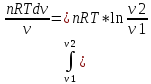
10) Тепловые эффекты при V=const и p=const/ Что такое энтропия? Экзотермические и эндотермические процессы.
Тепловой эффект ряда последовательных реакций равен тепловому эффекту любого другого ряда реакций с теми же самыми исходными веществами и продуктами.
C+O2=CO2
C+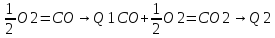
Сумма всех стадии C+O2=CO2 -> Q1+Q2
Q1+Q2=Q
⧋U=Q-p⧋V (5)
dU=SQ=SW (6)
-
V=const (5)->Q=⧋U (7)
Тепловой эффект изохорного процесса изменение внутренней энергии системы.
U (внутр. Энергия) св-во систем=> ⧋U изменение свойства не зависит от пути перехода но в силу (7) это относится и к Q.
-
P=const (5) -> Q=⧋U+p⧋V=U2-U1+p(V2-V1) =(U2+pV2)-(U1+pV1)=H2-H1=H
-
Q=⧋H , где Н=U+PV (8)
-
H-энтальпия
-
Энтальпия –свойство системы. Тепловой эффект изобарного процесса = изменению энтельпии.
Qp=⧋H , где ⧋H<0
Если теплота выделяется ,то процесс называется -экзотермический .
⧋H>0
Теплота поглощается –эндотермический
11)Закон Гесса
Закон Гесса — основной закон термохимии, который формулируется следующим образом:
-
Тепловой эффект химической реакции, проводимой в изобарно-изотермических или изохорно-изотермических условиях, зависит только от вида и состояния исходных веществ и продуктов реакции и не зависит от пути её протекания.
Иными словами, количество теплоты, выделяющееся или поглощающееся при каком-либо процессе, всегда одно и то же, независимо от того, протекает ли данное химическое превращение в одну или в несколько стадий (при условии, что температура, давление и агрегатные состояния веществ одинаковы). Например, окисление глюкозы в организме осуществляется по очень сложному многостадийному механизму, однако суммарный тепловой эффект всех стадий данного процесса равен теплоте сгорания глюкозы.
