
Уравне́ние Михаэ́лиса — Ме́нтен — основное уравнение ферментативной кинетики, описывает зависимость скорости реакции, катализируемой ферментом, от концентрации субстрата и фермента. Простейшая кинетическая схема, для которой справедливо уравнение Михаэлиса:
![]()
Уравнение имеет вид:
,
![]()
V- максимальная скорость
S-концентрация субстрата
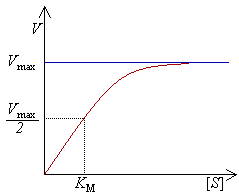
K-константа Михаэлиса (равна концентрации субстрата, при котором достигается половина максимальной скорости)
скорость любой химической реакции уменьшается со временем, однако кривая зависимости скорости ферментативных реакций от времени не имеет обычно той общей формы, которая характерна для гомогенных химических реакций

Такое снижение скорости ферментативных реакций со временем может быть обусловлено тормозящим действием продуктов реакции, уменьшением степени насыщения фермента субстратом (поскольку по мере протекания реакции концентрация субстрата снижается) или частичной инактивацией фермента при заданных значениях температуры и рН среды. Следует учитывать, кроме того, влияние скорости обратной реакции, которая может оказаться существенной по мере увеличения концентрации продуктов ферментативной реакции. Учитывая эти обстоятельства, при исследовании скорости ферментативных реакций в тканях и биологических жидкостях обычно определяют начальную скорость реакции в условиях, когда скорость ферментативной реакции приближается к линейной (в том числе при достаточно высокой для насыщения фермента концентрации субстрата).
Влияние концентраций субстрата и фермента на скорость ферментативной реакции
Из приведенного ранее материала вытекает важное заключение: одним из наиболее существенных факторов, определяющих скорость ферментативной реакции, является концентрация субстрата (или субстратов) и продукта (продуктов). При постоянной концентрации фермента скорость реакции постепенно увеличивается, достигая определенного максимума когда дальнейшее увеличение количества субстрата практически не оказывает влияния на скорость ферментативной реакции. В таких случаях принято считать, что субстрат находится в избытке, а фермент полностью насыщен, т. е. все молекулы фермента связаны с субстратом. Ограничивающим скорость реакции фактором в последнем случае становится концентрация фермента. Именно при этих условиях определяют величину максимальной скорости (V ) и значения константы Михаэлиса (Km) .
Скорость любой ферментативной реакции непосредственно зависит от концентрации фермента
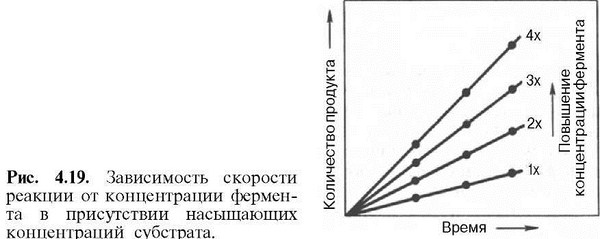
Существующая линейная зависимость между этими величинами, когда скорость реакции прямо пропорциональна количеству присутствующего фермента, справедлива только в определенных условиях, например в начальный период ферментативной реакции, так как в этот период практически не происходит обратной реакции, а концентрация продукта оказывается недостаточной для обратимости реакции. Именно в этом случае скорость реакции (точнее, начальная скорость реакции v) будет пропорциональна концентрации фермента.
Ингибиторы
Многие соединения могут влиять на обмен веществ, модулируя активность соответствующих ферментов. Особенно важные функции при этом выполняют ингибиторы ферментов. Ингибиторами ферментов являются многие лекарственные вещества природного или синтетического происхождения . Метаболиты также могут быть ингибиторами ферментов в процессах регуляции.
А. Типы ингибирования
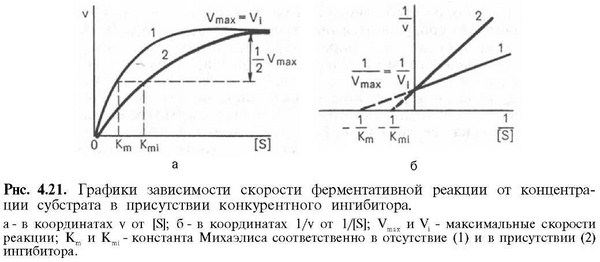
Большинство ингибиторов ферментов действуют обратимо, т. е. не вносят в молекулу фермента каких-либо изменений после своей диссоциации. Однако существуют также необратимые ингибиторы ферментов, которые необратимо модифицируют целевой фермент. Принцип действия ингибитора, тип его ингибирования определяют путем сравнения кинетики реакции в присутствии ингибиторам без него. Различают конкурентное (А, слева) и неконкурентное (А, справа) ингибирование. В регуляции обмена веществ важную роль игр аллостерическое ингибирование (А, 6).
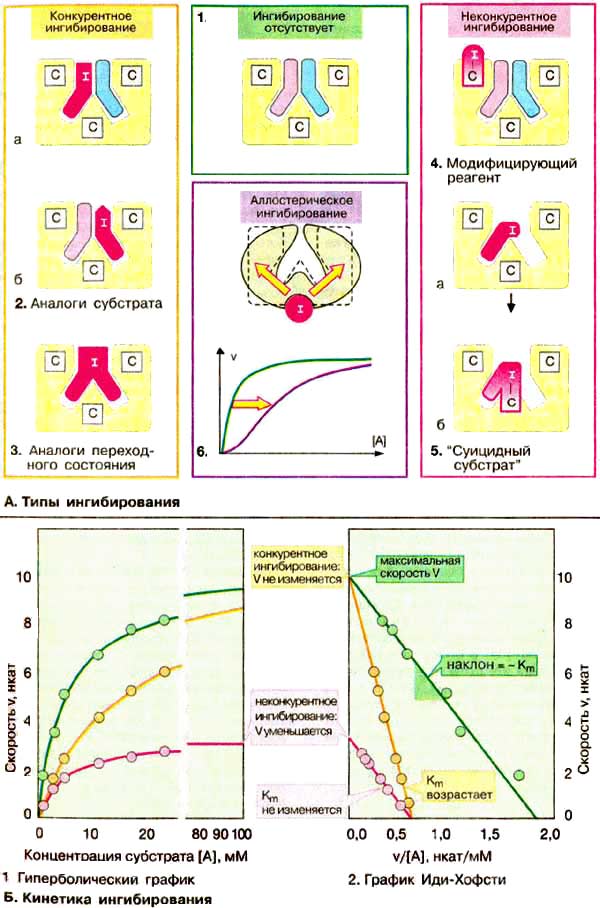
Так называемые аналоги субстрата имеют свойства, подобные свойствам субстрата целевого фермента. Они обратимо блокируют часть молекул имеющегося в наличии фермента, но не могут далее превращаться в продукт. Поэтому для достижения половины максимальной скорости реакции необходимы более высокие концентрации субстрата: в присутствии такого ингибитора константа Михаэлиса Km растет (Б). Субстрат в высоких концентрациях вытесняет ингибитор с фермента. Поэтому максимальная скорость V при этом типе торможения не претерпевает изменений. Так как субстрат и ингибитор конкурируют за место связывания на ферменте, данный тип торможения называют конкурентным. Аналоги переходного состояния также действуют как конкурентные ингибиторы.
Если ингибитор реагирует с функционально важной группой фермента, не препятствуя связыванию субстрата, такое ингибирование называется неконкурентным (на схеме справа). В этом случае Km остается неизменной, напротив уменьшается концентрация функционально активного фермента [Е] tи, следовательно, максимальная скорость реакции V. Неконкурентные ингибиторы действуют как правило необратимо, поскольку они модифицируют функциональные группы целевого фермента .
В случае так называемых "суицидных субстратов" речь идет о субстратных аналогах, содержащих дополнительно реакционную группу. Вначале они связываются обратимо, а затем образуют ковалентное соединение с активным центром фермента. Поэтому ингибирование такими соединениями проявляется как неконкурентное. Известным примером такого ингибитора является антибиотик пенициллин .
Аллостерические ингибиторы связываются с отдельными участками фермента вне активного центра. Такое связывание влечет за собой конформационные изменения в молекуле фермента, которые приводят к уменьшению его активности . Аллостерические эффекты встречаются практически только в случае олигомерных ферментов. Кинетику таких систем нельзя описать с помощью простой модели Михаэлиса-Ментен.
Кофакторы. Более 25% всех ферментов для проявления полной каталитической активности нуждается в ионах металлов.
1. Роль металлов в присоединении субстрата в активном центре фермента. Ионы металла выполняют функцию стабилизаторов молекулы субстрата, активного центра фермента и конформации белковой молекулы фермента, а именно третичной и четвертичной структур.
Ионы металлов - стабилизаторы молекулы субстрата
Для некоторых ферментов субстратом служит комплекс превращаемого вещества с ионом металла. Например, для большинства киназ в качестве одного из субстратов выступает не молекула АТФ, а комплекс Mg2+-ATФ. В этом случае ион Mg2+ не взаимодействует непосредственно с ферментом, а участвует в стабилизации молекулы АТФ и нейтрализации отрицательного заряда субстрата, что облегчает его присоединение к активному центру фермента.
83
Схематично роль кофактора при взаимодействии фермента и субстрата можно представить как комплекс E-S-Me, где Е - фермент, S - субстрат, Me - ион металла.
Ионы металла - стабилизаторы активного центра фермента
В некоторых случаях ионы металла служат "мостиком" между ферментом и субстратом. Они выполняют функцию стабилизаторов активного центра, облегчая присоединение к нему субстрата и протекание химической реакции. В ряде случаев ион металла может способствовать присоединению кофермента. Перечисленные выше функции выполняют такие металлы, как Mg2+, Mn2+, Zn2+, Co2+, Мо2+. В отсутствие металла эти ферменты активностью не обладают. Такие ферменты получили название "металлоэнзимы". Схематично данный процесс взаимодействия фермента, субстрата и металла можно представить следующим образом:
E-Me-S
К металлоэнзимам относят, например, фермент пируват киназую.
2. Роль металлов в стабилизации третичной и четвертичной структуры фермента
Ионы металлов обеспечивают сохранение вторичной, третичной, четвертичной структуры молекулы фермента. Такие ферменты в отсутствие ионов металлов способны к химическому катализу, однако они нестабильны. Их активность снижается и даже полностью исчезает при небольших изменениях рН, температуры и других незначительных изменениях внешнего окружения. Таким образом, ионы металлов выполняют функцию стабилизаторов оптимальной конформации белковой молекулы.
Иногда в стабилизации вторичной и третичной структуры принимают участие ионы щёлочноземельных металлов. Так, для поддержания третичной конформации пируваткиназы необходимы ионы К+.
Для стабилизации четвертичной структуры алкогольдегидрогеназы, катализирующей реакцию окисления этанола, необходимы ионы цинка. Алкогольдегидрогеназа состоит из 4 субъединиц с молекулярной массой 151 кД. В состав фермента входят 4 атома Zn2+. Удаление Zn2+ приводит к потере активности фермента за счёт диссоциации на 4 неактивные субъединицы с молекулярной массой 36 кД .
3. Роль металлов в ферментативном катализе
Не менее важную роль отводят ионам металлов в осуществлении ферментативного катализа.
Участие в электрофильном катализе
Наиболее часто эту функцию выполняют ионы металлов с переменной валентностью, имеющие свободную d-орбиталь и выступающие в качестве электрофилов. Это, в первую очередь, такие металлы, как Zn2+, Fe2+, Mn2+, Cu2+. Ионы щёлочно-земельных металлов, такие как Na+ и К+, не обладают этим свойством. В ходе электрофильного катализа ионы металлов часто участвуют в стабилизации промежуточных соединений.
Участие в окислительно-восстановительных реакциях
Ионы металлов с переменной валентностью могут также участвовать в переносе электронов. Например, в цитохромах (гемсодержащих белках) ион железа способен присоединять и отдавать один электрон. Благодаря этому свойству цитохромы участвуют в окислительно-восстановительных реакциях.
4. Роль металлов в регуляции активности ферментов
Иногда ионы металлов выступают в роли регуляторных молекул. Например, ионы Са2+ служат активаторами фермента протеинкиназы С, катализирующего реакции фосфорилирования белков . Ионы Са2+ также изменяют активность ряда кальций-кальмодулинзависимых ферментов .
Коферменты
Для проявления каталитической активности большинству ферментов необходимо наличие кофермента. Исключение составляют гидролитические ферменты (например, протеазы, липазы, рибонуклеаза), выполняющие свою функцию в отсутствие кофермента.
Кофермент, локализуясь в каталитическом участке активного центра, принимает непосредственное участие в химической реакции, выступая в качестве акцептора и донора химических группировок, атомов, электронов. Кофермент может быть связан с белковой частью молекулы ковалентными и нековалентными связями. В первом случае он называется простетической группой (например, FAD, FMN, биотин, липоевая кислота). Вместе с тем известны примеры, когда кофермент присоединяется к ферменту нековалентными связями настолько прочно, что не диссоциирует от белковой молекулы, например тиаминдифосфат.
Во втором случае кофермент взаимодействует с ферментом только на время химической реакции и может рассматриваться в качестве второго субстрата. Примеры - NAD+, NADP+.
Апофермент обеспечивает специфичность действия и отвечает за выбор типа химического превращения субстрата. Один и тот же кофермент, взаимодействуя с различными апоферментами, может участвовать в разных химических превращениях субстрата. Например, пиридоксальфосфат в зависимости от того, с каким апоферментом взаимодействует, участвует в реакциях трансаминирования или декарбоксилирования аминокислот.
Химическая природа коферментов, их функции в ферментативных реакциях чрезвычайно разнообразны. Традиционно к коферментам относят производные витаминов, хотя помимо них есть значительный класс небелковых соединений, принимающих участие в проявлении каталитической функции ферментов.
К коферментам относят следующие соединения:
производные витаминов;
гемы, входящие в состав цитохромов, каталазы, пероксидазы, гуанилатциклазы, NO-синтазы и являющиеся простетической группой ферментов;
нуклеотиды - доноры и акцепторы остатка фосфорной кислоты;
убихинон, или кофермент Q, участвующий в переносе электронов и протонов в ЦПЭ;
фосфоаденозилфосфосульфат, участвующий в переносе сульфата;
S-аденозилметионин (SAM) - донор метильной группы;
глутатион, участвующий в окислительно-восстановительных реакциях.
Строение и функции этих коферментов подробно рассмотрены в соответствующих разделах учебника.
