
- •Тема 5 второй закон термодинамики
- •Вопрос 1.
- •Энтропия. Сущность и формулировки второго закона термодинамики. Объединенное уравнение первого и второго законов термодинамики.
- •Вопрос 2. Тепловой двигатель. Термический кпд цикла.
- •Вопрос 3. Прямой цикл Карно
- •Вопрос 4. Обратный цикл Карно
- •Вопрос 5. Максимальная работа (работоспособность, эксергия) системы. Анергия.
- •Вопрос 6. Теорема Нернста.
- •Литература
- •Эксергия и анергия д.Т.Н., проф., Эткин в. А.
- •Эксергия
- •[Править] Формулировка
- •[Править] Следствия [править] Недостижимость абсолютного нуля температур
- •[Править] Поведение термодинамических коэффициентов
- •[Править] Нарушения третьего начала термодинамики в моделях
Тема 5 второй закон термодинамики
Вопрос 1.
Энтропия. Сущность и формулировки второго закона термодинамики. Объединенное уравнение первого и второго законов термодинамики.
Первый закон термодинамики характеризует процессы преобразования энергии с количественной стороны. Однако он не дает никаких указаний относительно возможности протекания того или другого процесса. Между тем далеко не все процессы реально осуществимы.
Второй закон термодинамики устанавливает существующую в природе направленность всех естественных процессов: любой реальный самопроизвольный процесс протекает всегда в определенном направлении необратимо и не может без затраты энергии осуществляться в обратном направлении.
Для количественной оценки направления и необратимости процессов используется функция состояния под названием энтропия.
Энтропия – это функция состояния термодинамической системы, дифференциал которой равен отношению бесконечно малого количества теплоты, подведенного к системе в обратимом равновесном процессе, к температуре системы:
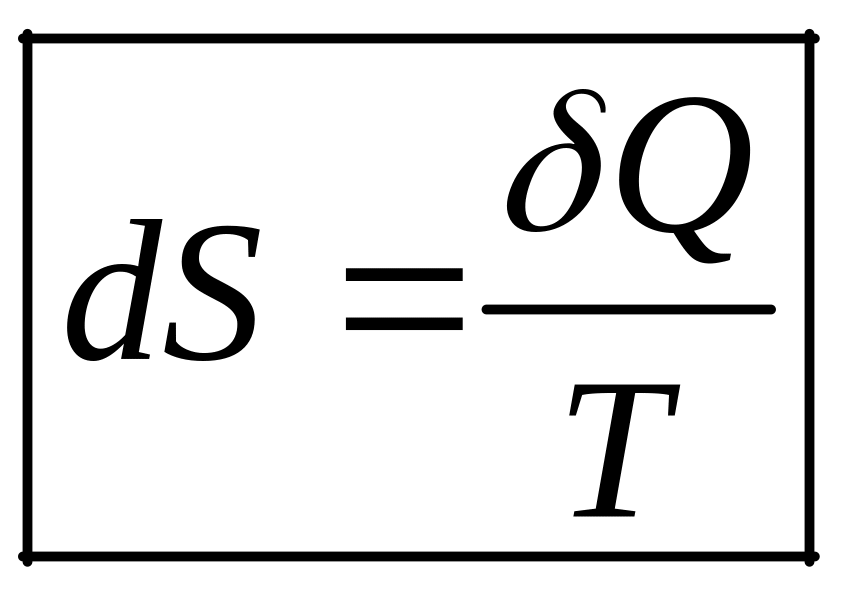 ,
Дж/К.
,
Дж/К.
Удельная энтропия
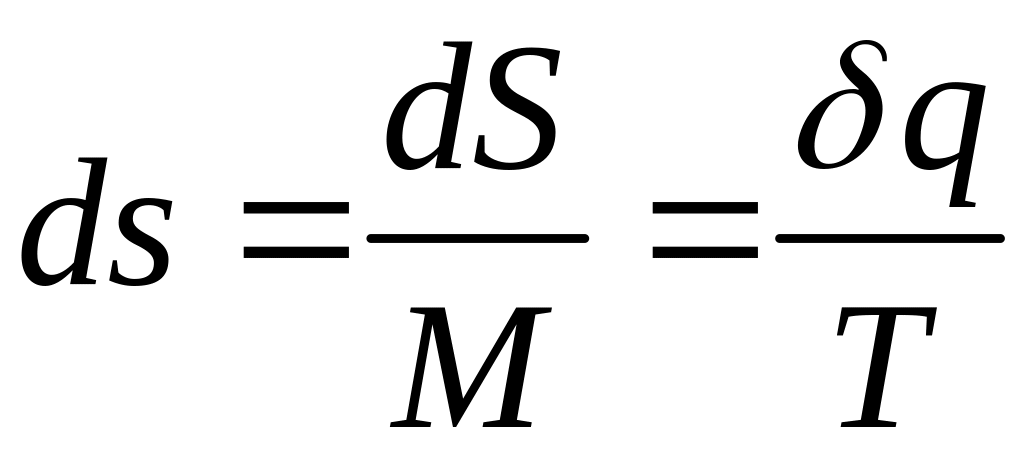 ,
Дж/(кгК).
,
Дж/(кгК).
Так как энтропия является функцией состояния, то ее изменение в каком - либо процессе будет равно
![]()
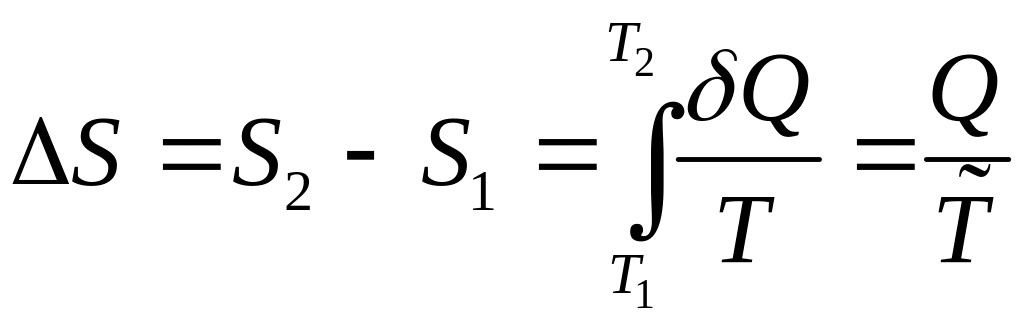 ,
,
где
![]() - теплота процесса;
- теплота процесса;
![]() - средняя температура рабочего тела в
рассматриваемом процессе 1-2.
- средняя температура рабочего тела в
рассматриваемом процессе 1-2.
Теплота, подведенная к системе будет равна
![]() ,
,
в интегральном виде
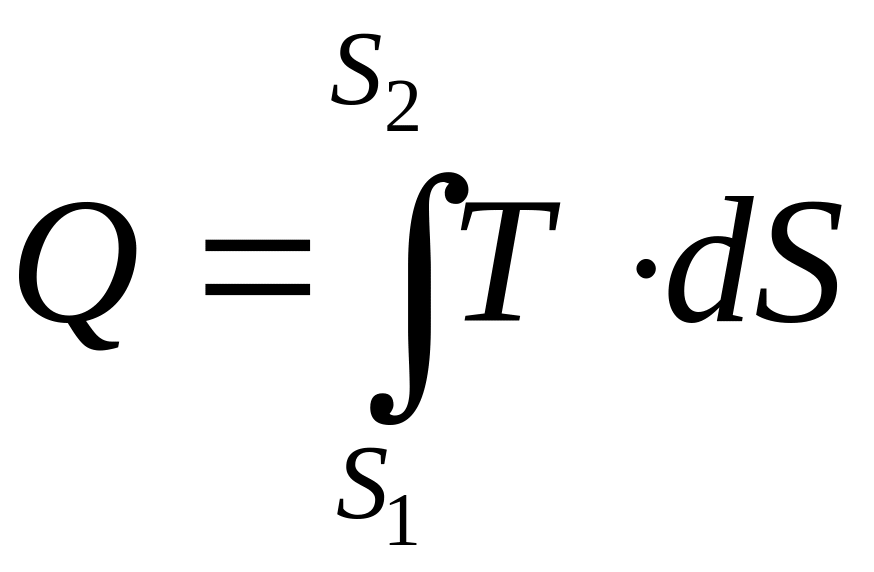 .
.
Связь удельной энтропии с термодинамическими параметрами состояния системы
 =
=![]()
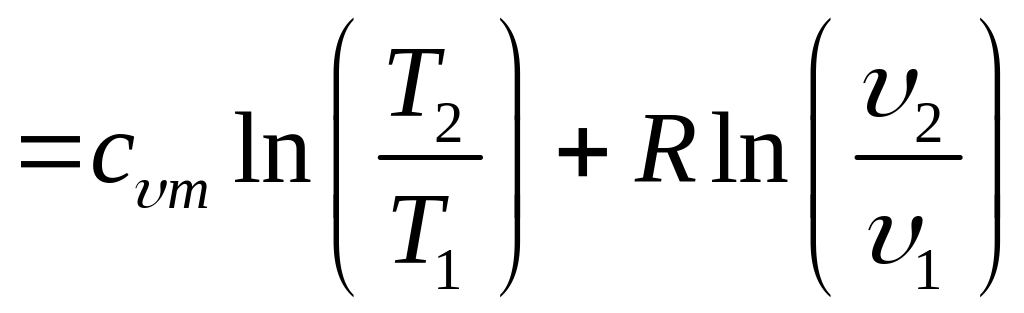 .
.
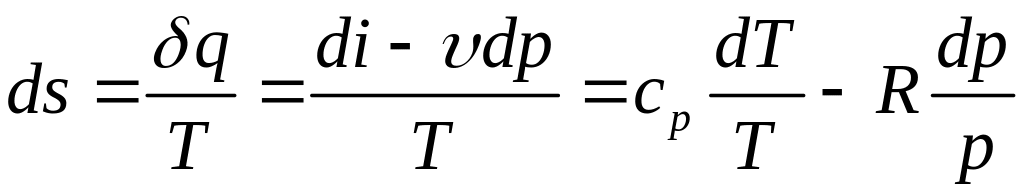 =
=

Среднетермодинамическая температура
рабочего тела в процессе
![]() .
.
Изменение энтропии в процессе
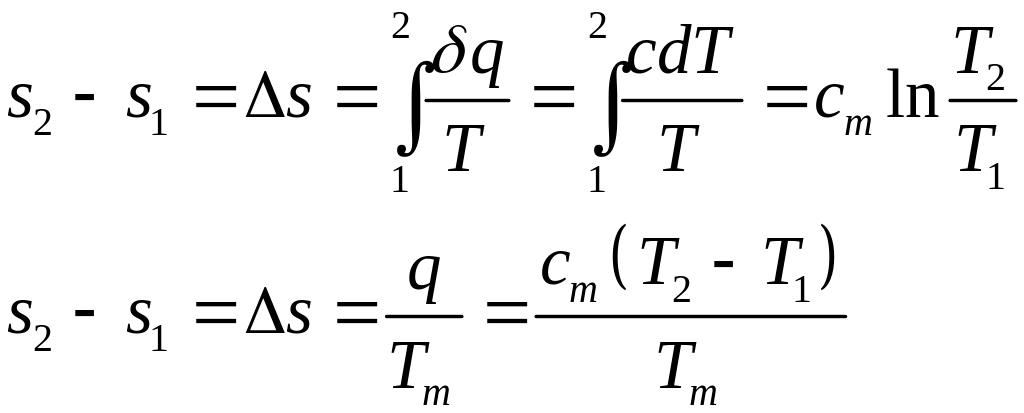 =>
=>
Тогда

Понятие энтропии было введено Клаузиусом в 1865 г. для определения меры необратимого рассеивания энергии, то есть меры отклонения реального процесса от идеального. Изменение энтропии может происходить только под действием энергии, передаваемой в виде теплоты. Поэтому с помощью энтропии легко характеризовать процессы с подводом и отводом теплоты. Для наглядности эти процессы изображают в Т-s координатах. В этих координатах площадь под линией процесса эквивалентна теплоте: если теплота подводится, то процесс идет с возрастанием энтропии, если теплота отводится, то процесс идет с убыванием энтропии
Неохлаждаемый Охлаждаемый Турбина
(центробежный) (поршневой)
компрессор компрессор
Существует несколько эквивалентных формулировок второго закона термодинамики:
1) Формулировка Клаузиуса: «Невозможен процесс, при котором теплота переходила бы самопроизвольно от тел более холодных к телам более теплым».
2) Формулировка Томсона и Планка: «Невозможен процесс, имеющий единственным своим результатом превращение тепла в работу».
3) Невозможно существование вечного двигателя второго рода, т.е. двигателя, полностью превращающего в работу всю полученную от горячего источника теплоту.
4) Формулировка Больцмана: «Энтропия всякой изолированной системы стремится к максимуму».
5) Энтропия изолированной системе не может уменьшаться (закон неубывания энтропии).
6) Необратимые процессы в изолированной системе протекают с возрастанием энтропии (закон возрастания энтропии).
Аналитически второй закон термодинамики обычно выражается формулой
 ,
Дж/К
,
Дж/К
или
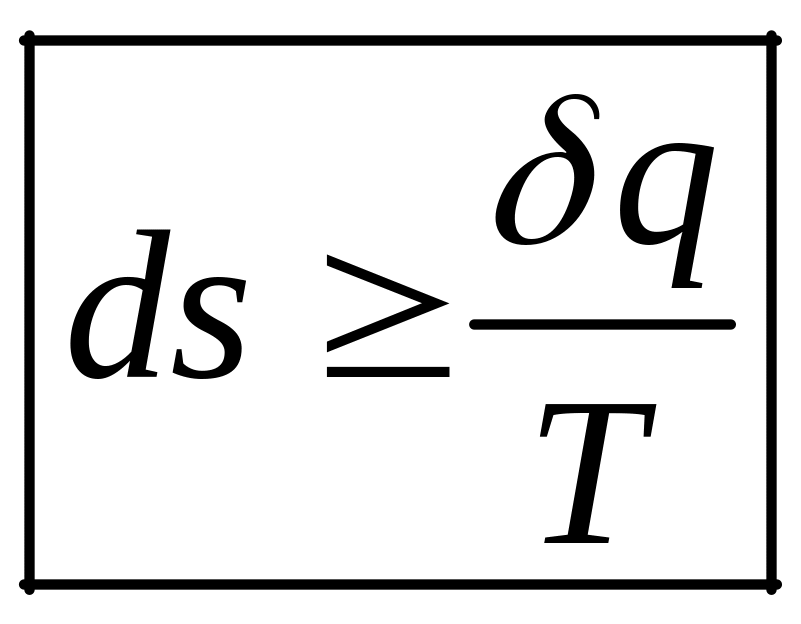 ,
Дж/(кгК).
,
Дж/(кгК).
Знак равенства относится к обратимым, равновесным процессам, знак > (больше) относится к необратимым, реальным процессам. Теплота в этих уравнениях равна подведенной к системе из окружающей среды теплоте δq = δqвнеш. Для необратимых процессов теплота подводится как за счет внешнего теплообмена так и за счет необратимости внутри системы δqнеоб = δqвнеш+ δqтр = δq+ δψ.
Поэтому для обратимых процессов изменение энтропии характеризует только наличие внешнего теплообмена, а для необратимых процессов – не только наличие внешнего теплообмена, но и диссипативные процессы трения.
Для изолированной системы δqвнеш=0, поэтому
- для обратимых процессов ds=0 и энтропия остается постоянной (s=const),
- для необратимых, реальных процессов δqнеоб = δψ, ds>0 и энтропия всегда увеличивается.
Для необратимых процессов можно записать
ds = δqнеоб / Т = δqвнеш / Т + δqтр / Т = dsвнеш + dsтр.
Видно, что энтропия в реальных процессах повышается как за счет теплообмена с окружающей средой (dsвнеш), так и за счет трения (dsтр), причем dsвнеш переносится через границы системы, а dsтр производится внутри системы.
Так как из первого закона термодинамики
![]() ,
,
а из второго закона
![]() ,
,
то получаем объединенное уравнение первого и второго законов термодинамики
