- •Простые эфиры,
- •Физические свойства.
- •Способы получения.
- •Присоединение спиртов и фенолов к непредельным соединениям.
- •Химические свойства.
- •Основные свойства.
- •2. Расщепление галогеноводородами.
- •3. Окисление.
- •Реакции электрофильного замещения (se) в ароматических эфирах.
- •Органические соединения серы.
2. Расщепление галогеноводородами.
Реакция расщепления простых эфиров под действием кислот является реакцией ацидолиза. В эту реакцию вступают простые эфиры, обладающие заметными основными свойствами – циклические, диалкиловые, алкилариловые. Для расщепления связи С – О используют сильные протонные минеральные кислоты (HBr, HI). В диалкиловых эфирах нуклеофильной атаке преимущественно подвергается наименее стерически затрудненный радикал с образованием галогеноалкана и спирта.
HI, кипячение
С Н3
– О – СН2СН2СН3 СН3I
+ СН3СН2СН2ОН
Н3
– О – СН2СН2СН3 СН3I
+ СН3СН2СН2ОН
Расщепление происходит по правилу Цейзеля: галоген уходит с наименьшим радикалом. Исключение составляют эфиры с аллильными и третичными радикалами. В этом случае правило Цейзеля не соблюдается, реакция идет с образованием первичного спирта:
t0
С Н3
– О – СН2-СН=СН2 + HI
СН3ОН + СН2=СН-СН2I
Н3
– О – СН2-СН=СН2 + HI
СН3ОН + СН2=СН-СН2I
В алкилариловых эфирах под действием галогеноводородных кислот всегда разрывается связь O – Alk с образованием галогеноалкана и фенола:
HI, 1000C
A r – O – CH3 Ar-OH + CH3I
Диариловые эфиры, как не обладающие заметными основными свойствами, галогеноводородными кислотами не расщепляются.
3. Окисление.
Диалкиловые эфиры под действием кислорода воздуха или других окислителей легко вступают в реакцию автоокисления с образованием гидропероксидов, пероксидов, представляющих собой сильнейшие взрывчатые вещества. Поэтому при работе с простыми эфирами их необходимо проверять на присутствие пероксидов (выделение йода из раствора йодида калия при взбалтывании его с пробой эфира). Из эфиров пероксиды удаляют, обрабатывая их раствором солей железа (II) или олова (II).
Реакции электрофильного замещения (se) в ароматических эфирах.
В алкилариловых эфирах алкоксидная группа проявляет ЭД свойства. При этом повышается электронная плотность в орто- и пара-положениях ароматического кольца (ориентант I рода) и облегчается протекание реакций SE с преимущественным образованием пара-изомеров.
1,2-Эпоксиды (оксираны).
Эпоксиды являются бесцветными газами или жидкостями со слабым запахом.Эпоксидный цикл представляет собой почти правильный треугольник со значительно деформированными валентными углами (~ 60°С), что приводит к уменьшению энергии, а, следовательно, и прочности связей. Поэтому связь С – О в эпоксидах легко разрывается под действием различных нуклеофильных реагентов.
По направлениям химических превращений эпоксидные сходны с простыми эфирами, только все их реакции протекают с большими скоростями. Связь С – О разрывается легко, особенно в условиях кислотного катализа. Циклические эфиры обладают заметно большей основностью, чем простые ациклические эфиры. В отсутствии кислотного катализа реакции со слабыми нуклеофилами проходят при повышенной температуре и под давлением.
Органические соединения серы.
Сераорганическими называются соединения, которые содержат атом серы, связанный с атомом углерода органической части молекулы.
Серосодержащие аналоги спиртов и фенолов называют тиолами, серосодержащие аналоги простых эфиров и органических пероксидов называют сульфидами и дисульфидами соответственно. Серосодержащие аналоги фенолов называют тиофенолами.
-
Метантиол
CH3SH
Этантиол
CH3CH2SH
Тиофенол
C6H5SH
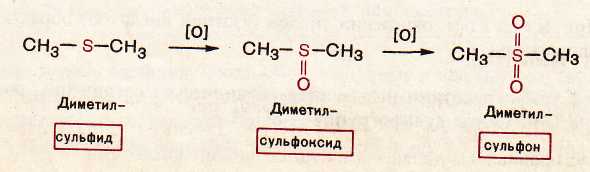
Диметилсульфид
CH3-S-CH3
Диметилдисульфид
CH3-S-S-CH3
Диметилсульфоксид
CH3-S(O)-CH3
Диметилсульфон
CH3-S(O)2-CH3
Кислотные свойства. Тиолы более сильные кислоты, чем соответствующие спирты. Легкая поляризуемость атома серы способствует делокализации отрицательного заряда, образующегося алкилсульфид-иона RS- и, следовательно, повышает его стабильность. Тиолы образуют растворимые в воде соли – тиоляты – со щелочными металлами и нерастворимые – с тяжелыми металлами (ртутью, свинцом, цинком). Это свойство тиолов нашло отражение в устаревшем названии меркаптаны (от лат. mercurius captans – связывающий ртуть).
С2Н5SH + NaOH ⇄ C2H5SNa + H2O
Этантиолят натрия
2СН3СН2SH + HgCl2 → (C2H5S)2Hg ↓ + H2O
Этантиолят ртути (II)
Способность тиолов связывать ионы тяжелых металлов позволяет использовать их как противоядия при отравлениях соединениями мышьяка, ртути, хрома, висмута.
Основные свойства тиолов по отношению к протону практически отсутствуют.
Сульфиды являются слабыми основаниями.
Нуклеофильные свойства. Тиолы и сульфиды проявляют высокое сродство к атому углерода с пониженной электронной плотностью. К тому же они не образуют прочных водородных связей с протонными растворителями, и их неподеленные пары электронов доступны для взаимодействия с органическими реагентами. Все это обуславливает высокую нуклеофильность тиолов и сульфидов, реакции с которыми протекают в мягких условиях.
NaOH
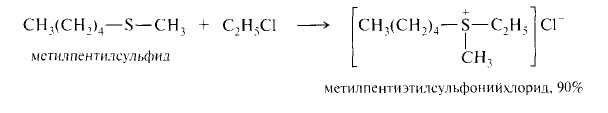
Сульфиды как сильные нуклеофилы взаимодействуют с алкилгалогенидами, диалкилсульфатами или аренсульфонатами с образованием сульфониевых солей, представляющих собой устойчивые кристаллические вещества, хорошо растворимые в воде.
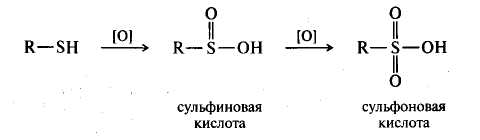
Окисление и восстановление. Тиолы склонны к окислению и в зависимости от условий превращаются в различные серосодержащие соединения. При мягком окислении (кислород воздуха, пероксид водорода, иод, бром) тиолы превращаются в дисульфиды:
I2
2 СН3-SH -2HI CH3-S-S-CH3
Связь S – S в дисульфидах непрочная, поэтому дисульфиды и легко восстанавлиываются в тиолы. [H]
C H3-S-S-CH3 2 CH3SH
При жестком окислении тиолов (азотной кислотой, перманганатом калия) образуются сульфокислоты; промежуточными продуктами окисления являются малоустойчивые сульфиновые кислоты: