
- •Простые эфиры,
- •Физические свойства.
- •Способы получения.
- •Присоединение спиртов и фенолов к непредельным соединениям.
- •Химические свойства.
- •Основные свойства.
- •2. Расщепление галогеноводородами.
- •3. Окисление.
- •Реакции электрофильного замещения (se) в ароматических эфирах.
- •Органические соединения серы.
Присоединение спиртов и фенолов к непредельным соединениям.
BF3, t, p
 (СН3)2С=СН2 + СН3ОН
(СН3)3С
– О – СН3 + Н2О
(СН3)2С=СН2 + СН3ОН
(СН3)3С
– О – СН3 + Н2О
2-метилпропен трет-бутилметиловый
эфир
Фенолы присоединяются труднее спиртов вследствие их более низкой нуклеофильности. К ацетилену спирты и фенолы присоединяются в достаточно жестких условиях, образуя виниловые и винилфениловые эфиры.
Химические свойства.
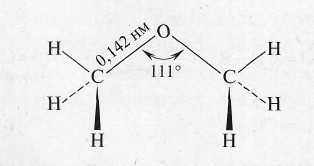
Среднее значение энергии связей С – О в эфирах и С – С в алканах близко между собой, к тому же связь С – О несколько короче связи С – С (0,142 и 0,154 нм соответственно). Приведенные данные свидетельствуют о том, что все связи в простых эфирах являются довольно прочными и для их расщепления требуются жесткие условия. В алкилариловых и диариловых эфирах наблюдается взаимодействие свободной пары электронов кислорода с π-электронами бензольного кольца, что также приводит к упрочению связей С – О.
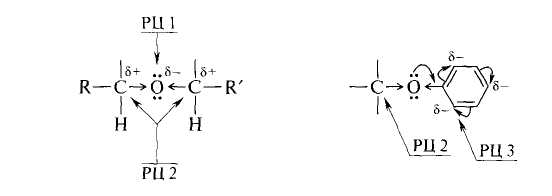
РЦ 1 – нуклеофильный реакционный центр. Поскольку атом кислорода обладает высокой ЭО и низкой поляризуемостью, следует ожидать, что простые эфиры будут проявлять слабые п-основные свойства, как основания Бренстеда, и жесткие, как основания Льюиса.
РЦ 2 – электрофильные центры. Под влиянием ЭО атома кислорода повышается электрофильность α-углеродного атома, и, следовательно, следует ожидать, что простые эфиры будут проявлять склонность к реакциям с нуклеофильными реагентами. При этом в диалкиловых эфирах, содержащих различные радикалы, нуклеофильной атаке будет подвергаться преимущественно более электронодефицитный и пространственно незатрудненный атом углерода.
РЦ 3 – электрофильные центры ароматического кольца – его орто- и пара-положения. В алкилариловых эфирах нуклеофильная атака должна быть преимущественно направлена на α-атом углерода алкильного радикала; электрофильная – на орто- и пара-положения арильного радикала.
Простые эфиры – нейтральные и малоактивные соединения. Эфирная связь очень устойчива к действию оснований, окислителей и восстановителей, поэтому эфиры часто используют в качестве инертных растворителей.
Основные свойства.
В ряду кислородсодержащих соединений простые эфиры являются более сильными основаниями, чем спирты за счет суммарного +I-эффекта алкильных заместителей, связанных с атомом кислорода. Ввиду слабых нуклеофильных свойств атома кислорода простые эфиры являются слабыми n-основаниями Брёнстеда и, отсюда, способны образовывать оксониевые соли в безводной среде только с сильными кислотами Брёнстеда и взаимодействовать с жесткими кислотами (по Пирсону). Простые эфиры растворяются в холодной концентрированной серной кислоте с образованием солей оксония, что используется для отделения их от алканов и галогеноалканов:
С2Н5 – Ö – С2Н5 + H2SO4 ⇄ [C2H5 – OH – C2H5]+ HSO4-
диэтиловый эфир диэтилоксонийгидросульфат
Менее основными, чем диалкиловые эфиры, являются алкилариловые эфиры, у которых за счет сопряжения р-орбиталей sp2-гибридизованного атома кислорода с р-орбиталями ароматического кольца понижена электронная плотность в основном центре. Поэтому алкилариловые эфиры протонируются только в концентрированных растворах сильных кислот. Диариловые эфиры вследствие р,π-сопряжения атома кислорода с двумя ароматическими кольцами основных свойств не проявляют.
