
- •1. Открытие генетической роли днк Молекулярная биология и молекулярная генетика
- •2. Химический состав и структурная организация молекулы днк.
- •3. Свойства и функции днк.
- •4. Генетический код, его свойства.
- •11. Химический состав и структура рнк.
- •12. Виды рнк и их биологическая роль.
- •13. Структурная организация оперона.
- •23. Структура и функциональное значение р-рнк и т-рнк.
- •26. Жизненный цикл клетки.
- •33. Анафаза, телофаза.
- •34. Амитоз, его механизмы и биологическое значение.
- •37. Фазы сперматогенеза.
- •38. Фазы овогенеза.
- •44. Биологическое значение мейоза.
- •51.Типы яиц. Дробление. Типы бластул. Их организация и наличие у разных групп животных.
- •55. Сперматогенез. Основные этапы. Изменения ядерного аппарата.
- •56. Основые этапы эмбрионального развития человека. Его отличия от других групп животных. Критические этапы. Эмбриогенеза человека.
12. Виды рнк и их биологическая роль.
Матричная (информационная) РНК — РНК, которая служит посредником при передаче информации, закодированной в ДНК к рибосомам, молекулярным машинам, синтезирующим белки живого организма. Кодирующая последовательность мРНК определяет последовательность аминокислот полипептидной цепи белка. Однако подавляющее большинство РНК не кодируют белок. Эти некодирующие РНК могут транскрибироваться с отдельных генов (например, рибосомальные РНК) или быть производными интронов. Классические, хорошо изученные типы некодирующих РНК — это транспортные РНК (тРНК) и рРНК, которые участвуют в процессе трансляции. тРНК, функцией которой является транспортировка аминокислот к месту синтеза белка. также принимают непосредственное участие в наращивании полипептидной цепи, присоединяясь — будучи в комплексе с аминокислотой — к кодону мРНК и обеспечивая необходимую для образования новой пептидной связи конформацию комплекса. Рибосомальная РНК учавствует в формировании активного центра рибосомы и биосинтезе белка. Основной функцией рРНК является осуществление процесса трансляции — считывания информации с мРНК при помощи адапторных молекул тРНК и катализ образования пептидных связей между присоединёнными к тРНК аминокислотами.
Существуют также классы РНК, ответственные за регуляцию генов, процессинг мРНК и другие роли. Кроме того, есть и молекулы некодирующих РНК, способные катализировать химические реакции, такие, как разрезание и лигирование молекул РНК. По аналогии с белками, способными катализировать химические реакции — энзимами (ферментами), каталитические молекулы РНК называются рибозимами.
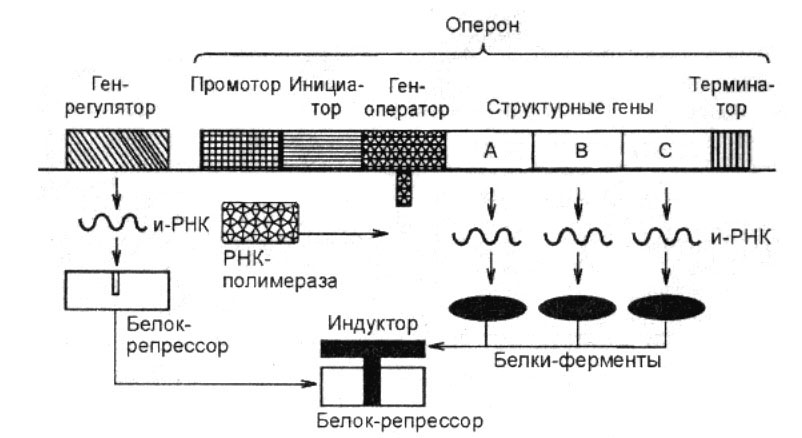
13. Структурная организация оперона.
- группа тесно связанных между собой генов, которые регулируют образование ферментов в организме. В состав оперона входит один или несколько структурных генов, которые определяют природу образующихся ферментов, и ген-оператор, который контролирует деятельность структурных генов и сам, в свою очередь, контролируется регуляторным геном, не входящим в состав оперона.
Опероны по количеству цистронов делят на моно-, олиго- и полицистронные, содержащие, соответственно, только один, несколько или много цистронов (генов)
Характерным примером оперонной организации генома прокариот является лактозный оперон.
Начинается
и заканчивается оперон регуляторными
областями — промотором
в начале и терминатором
в конце, кроме этого, каждый отдельный
цистрон может иметь в своей структуре
собственный промотор и/или терминатор.
14. Молекулярные механизмы транскрипции у прокариот. Фазы транскрипции.
Транскрипцией называется перенос информации с двух-цепочечной молекулы ДНК на одноцепочечные молекулы РНК. Матрицей для синтеза РНК служит только одна цепь ДНК, называемая смысловой цепью.
В транскрипции, различают три стадии: инициацию, элонгацию и терминацию. Фермент, осуществляющий этот процесс, называют ДНК-зависимой РНК-полимеразой или просто РНК-полимеразой.
Молекулы РНК «считываются» с определённых участков хромосомной ДНК - «транскрипционных единиц». В качестве субстрата используются рибонуклеозидтрифосфаты. Синтез РНК-транскрипта идёт в направлении от 5’ – к 3’ – концу. На 5’ – конце растущей цепи находится 5 – трифосфат, а 3 – гидроксильная группа на другом конце цепи служит центром образования очередной фосфодиэфирной связи при участии фермента РНК-полимеразы.
В зоне синтеза РНК происходит «расплетение» примерно двух витков (16-18 пар оснований) спирали ДНК, и таким образом экспонируется участок цепи ДНК-матрицы, «считываемый» в направлении 3' ® 5'. В некоторых транскрипционных единицах ДНК-матрицей для синтеза РНК служит одна из двух цепей, а в других - комплементарная ей вторая цепь молекулы ДНК.
Транскрипционные единицы в ДНК ограничены, с одной стороны, промотором - участком инициации транскипции, а с другой - участком остановки транскрипции - терминатором.
Подробно изучена РНК-полимераза Е. coli (рис. 1). Ее основу образует так называемый кор-фермент, состоящий из четырех полипептидных цепей - двух идентичных (a) и двух различных субъединиц (b и b'). Кор-фермент катализирует рост цепи за счет присоединения рибонуклеозидтрифосфатов к 3'-концу синтезируемой молекулы РНК. Присоединение к кор-ферменту еще одной полипептидной цепи, называемой σ-субъединицей, приводит к образованию холофермента РНК-полимеразы.
σ-субъединица обеспечивает точное узнавание промоторного участка и выбор одной из комплементарных цепей ДНК в качестве матрицы для начала транскрипции. После того как синтез РНК уже начался, происходит диссоциация σ-субъ-единицы. Вместо нее с кор-ферментом соединяется другой белок - продукт гена nus А. Этот ферментативный комплекс продолжает транскрипцию вплоть до терминаторного участка, узнавание которого обеспечивается белком nus А.
Подробности молекулярного механизма терминации транскрипции окончательно неизвестны, но есть основания полагать, что для высвобождения новосинтезированной цепи РНК из комплекса с РНК-полимеразой и ДНК кроме nus А необходим по крайней мере еще один белок, называемый r-фактором.
1. Инициация транскрипции происходит на специфическом участке ДНК, называемом промотором. Для узнавания промотора необходим s-фактор, причем различные s-факторы отвечают за узнавание различных классов промоторов. Как правило узнаются блоки, отстоящие на 10 и 35 нуклеотидов от точки начала транскрипции
Элонгация транскрипции - постепенное удлинение растущей цепи пре-РНК до окончательного размера.
Терминация транскрипции - Сигналом для этого служат специальные ГЦ-богатые участки в конце генов. Поскольку сила взаимодействия пар Г Ц довольно велика, локальная денатурация таких участков в ДНК происходит трудней. Это замедляет продвижение РНК-полимеразы и может служить для нее сигналом к прекращению транскрипции.
Регуляция транскрипции - Транскрипция может регулироваться на любой стадии, т.е. инициации, элонгации и терминации. Вполне логично, впрочем, что наиболее часто регулируется инициация транскрипции.
15. Регуляция работы оперона по типу репрессии и индукции.
Индуцибельные гены функционируют в разных тканях на определенных этапах онтогенеза, они могут включаться и выключаться, их активность может регулироваться по принципу «больше или меньше». Это тканеспецифичные гены, или «гены роскоши», которые часто являются несущественными. Включение индуцибельных генов называется индукцией, а выключение – репрессией. Регуляцию активности генов производят молекулярно-генетические системы управления.
Промотор служит для присоединения РНК-полимеразы к молекуле ДНК с помощью комплекса CAP-цАМФ (CAP – специфический белок; в свободной форме является неактивным активатором; цАМФ – циклоаденозинмонофосфат – циклическая форма аденозинмонофосфорной кислоты).
Оператор способен присоединять белок–репрессор (который кодируется соответствующим геном). Если репрессор присоединен к оператору, то РНК-полимераза не может двигаться вдоль молекулы ДНК и синтезировать иРНК.
Структурные гены кодируют три фермента, необходимые для расщепления лактозы (молочного сахара) на глюкозу и галактозу. Молочный сахар лактоза – менее ценный продукт питания, чем глюкоза, поэтому в присутствии глюкозы сбраживание лактозы является невыгодным для бактерии процессом. Однако при отсутствии глюкозы бактерия вынуждена переходить на питание лактозой, для чего синтезирует соответствующие ферменты Z, Y, А.
Терминатор служит для отсоединения РНК-полимеразы после окончания синтеза иРНК, соответствующей ферментам Z, Y, А, необходимым для усвоения лактозы.
Для регуляции работы оперона необходимы еще два гена: ген, кодирующий белок–репрессор, и ген, кодирующий белок СYА. Белок СYА катализирует образование цАМФ из АТФ. Если в клетке имеется глюкоза, то белок СYА вступает с ней в реакцию и переходит в неактивную форму. Таким образом, глюкоза блокирует синтез цАМФ и делает невозможным присоединение РНК-полимеразы к промотору. Итак, глюкоза является репрессором.
Если же в клетке имеется лактоза, то она взаимодействует с белком–репрессором и превращает его в неактивную форму. Белок–репрессор, связанный с лактозой, не может присоединиться к оператору и не преграждает путь РНК-полимеразе. Итак, лактоза является индуктором.
Предположим, что первоначально в клетке имеется только глюкоза. Тогда белок–репрессор присоединен к оператору, а РНК-полимераза не может присоединиться к промотору. Оперон не работает, структурные гены выключены.
При появлении в клетке лактозы и при наличии глюкозы белок–репрессор отщепляется от оператора и открывает путь РНК-полимеразе. Однако РНК-полимераза не может присоединиться к промотору, поскольку глюкоза блокирует синтез цАМФ. Оперон по-прежнему не работает, структурные гены выключены.
Если же в клетке имеется только лактоза, то белок–репрессор связывается с лактозой, отщепляется и открывает путь РНК-полимеразе. В отсутствии глюкозы белок СYА катализирует синтез цАМФ, и РНК-полимераза присоединяется к промотору. Структурные гены включаются, РНК-полимераза синтезирует иРНК, с которой транслируются ферменты, обеспечивающие сбраживание лактозы.
Таким образом, лактозный оперон находится под двойным контролем индуктора (лактозы) и репрессора (глюкозы).
16. Структурная организация транскриптона. - еденица транскрипции, состоящая из информативной(акцепторной) и неинформативной(структурной) зоны. Неинформативная: промотор, инициатор, гены-операторы. Информативаня: структурный ген, в которм имеются интроны (вставки из неинформативных участков ДНК) и экзоны (информативные участки). Транскрипция кончается терменатором. 17. Функционирование транскриптона.
Синтез молекул РНК начинается в определенных местах ДНК, называемых промоторами , и завершается в терминаторах. Участок ДНК, ограниченный промотором и терминатором, представляет собой единицу транскрипции ( Lewin B., 1980 ) - транскриптон. В пределах каждого транскриптона копируется только одна из двух нитей ДНК, которая называется значащей или матричной. Во всех транскриптонах, считываемых в одном направлении, значащей является одна нить ДНК; в транскриптонах, считываемых в противоположном направлении, значащей является другая нить ДНК. Соседние транскриптоны могут быть отделены друг от друга нетранскрибируемыми участками ДНК, а могут и перекрываться, в частности так, что в пределах участка перекрывания матричными оказываются обе нити. Разбиение ДНК на множество транскриптонов обеспечивает возможность независимого считывания разных генов, их индивидуального включения и выключения. У эукариот в состав транскриптона, как правило, входит только один ген.Термины "транскрипционная единица" или "транскриптон" по смыслу близки термину "ген", но они не всегда совпадают. Так, транскрипционные единицы прокариот, как правило, заключают в себе генетическую информацию нескольких генов и называются оперонами . Продуктами транскрипции оперонов являются полицистронные мРНК , в результате трансляции которых рибосомами образуется несколько белков. Белки, кодируемые полицистронными мРНК, обычно функционально связаны друг с другом и обеспечивают протекание какого-либо метаболического процесса, например, биосинтеза определенной аминокислоты или утилизацию углеводов в качестве источника углерода. Организация генов в виде оперонов облегчает координированную регуляцию их экспрессии на уровне транскрипции. Согласованная регуляция транскрипции (и других этапов экспрессии) многих генов, не образующих одного оперона, чаще всего осуществляется специфическими белками-регуляторами, которые взаимодействуют с гомологичными регуляторными нуклеотидными последовательностями, маркирующими гены данной группы.
18. Процессинг.- совокупность реакций, ведущих к превращению первичных продуктов транскрипции и трансляции в функционирующие молекулы. П. подвергаются функционально неактивные молекулы-предшественники разл. рибонуклеиновых к-т (тРНК, рРНК, мРНК) и мн. белков. При П. РНК-предшественников в наиб, простых случаях удаляются избыточные нуклеиновые последовательности с обоих концов этих молекул. В клетках эукариот обнаружен особый тип П.— сплайсинг (от англ. splice — сращивать, соединять), к-рому подвергаются предшественники всех мРНК, а также нек-рые тРНК и рРНК. В молекулах этого типа кодирующие (экзоны) и некодирующие (интроны) последовательности нуклеотидов чередуются между собой. При сплайсинге интроны удаляются, а экзоны сшиваются друг с другом, образуя активные (зрелые) мРНК. В нек-рых случаях возможны альтернативные варианты компановки кодирующих участков (альтернативный сплайсинг) и в таком случае из одного предшественника могут возникать разные мРНК, кодирующие разные белки. За редким исключением П. эукариотических РНК происходит в ядре. Для каждого типа молекул он осуществляется спец. ферментом или группой ферментов, к-рые узнают специфичную первичную, а часто и вторичную структуру РНК в точках П. Исключение составляет сплайсинг рРНК ресничной инфузории (Tetrahymena) — каталитич. функцию в этой реакции осуществляет сама РНК, подвергающаяся сплайсингу. При П. молекул-предшественников белков (пищеварит. ферментов, коллагена, лёгких цепей иммуноглобулинов, гормонов и др.) наиб, часто удаляется т. н. сигнальный пептид на ЫШ-конце полипептидной цепи. Новосинтезиров. полипептид, напр. проинсулин, может содержать последовательности разных полипептидных цепей, к-рые при П. вырезаются с удалением избыточных последовательностей, а затем образуется зрелый белок. Первичный продукт трансляции может расщепляться при П. на большое число белков с разл. функцией. П. белков осуществляется спец. протеазами, узнающими специфичные аминокислотные последовательности.
19. Информоферный цикл. На 1-м этапе информоферы связываются с новообразованной РНК по всей её длине, на 2-м этапе на поверхности информоферов с гяРНК происходят различные преобразования, составляющие процессинг и созревания мРНК, на 3-м этапе зрелая мРНК «переодевается» на ядерной мембране и транспортируется в цитоплазму, а информоферы, освободившиеся на 2 и 3 этап, входят в новый цикл. Остаётся неяясно, сохраняется ли целостность информофера между 3 и 1 этапами, или они распадаются на молекулы информатина.( информоферы - частицы, обеспечивающие перенос иРНК из ядра в цитоплазму)
20. Структурная организация зрелой и-рнк. Зрелая иРНК считывается рибосомами в процессе трансляции. В прокариотических клетках процесс транскрипции и трансляции не разделён пространственно, и эти процессы сопряжены. В эукариотических клетках место транскрипции клеточное ядро отделено от места трансляции (цитоплазмы) ядерной мембраной, поэтому иРНК транспортируется из ядра в цитоплазму. иРНК считывается рибосомой в виде трёхнуклеотидных «слов». Комплексы факторов инициации и факторов элонгации доставляют аминоацилированные транспортные РНК к комплексу иРНК-рибосома. иРНК - молекулы РНК, представляющие собой копии участков значащих цепей генов (ДНК), в к-рых закодирована информация об аминокислотных последовательностях полипептидных цепей белков. Образуются в результате транскрипции (синтез РНК на ДНК-матрице с помощью фермента ДНК-зависимой РНК-полимеразы) и послед. процессинга первичного транскрипта - удаления избыточных РНК-последовательностей с обоих концов молекулы и некодирующих последовательностей РНК, а также сшивания кодирующих участков РНК друг с другом. мРНК переносят генетич. информацию от генов к рибосомам, где происходит трансляция (синтез полипептидных цепей на мРНК-матрице). При этом одну цепь мРНК могут одновременно транслировать неск. рибосом (т. наз. полирибосомы, или полисомы). мРНК всегда состоят из одной полинуклеотидной цепи, т. е. относятся к однотяжевым РНК. Как и любые др. РНК, мРНК включают остатки адениловой (А), гуаниловой (G), уридиловой (U) и цитидиловой (С) к-т, связанных между собой 3'-5'-фосфодиэфирными связями (ф-ла I). Вторичная структура мРНК представлена многочисл. двухспиральными участками ("шпильками"), образующимися в результате комплементарного спаривания оснований (А с U и G с С) одной и той же цепи; шпильки соединены между собой короткими однотяжевыми участками. При связывании с рибосомой макромолекулярная структура мРНК существенно изменяется, а двухспиральные ее участки в районе непосредств. контакта с рибосомой переходят в однотяжевое состояние. 21. Трансляция, ее сущность и фазы.
Трансляцией называют осуществляемый рибосомой синтез белка из аминокислот на матрице информационной (или матричной) РНК (иРНК или мРНК).
Синтез белка является основой жизнедеятельности клетки. Для осуществления этого процесса в клетках всех без исключения организмов имеются специальные органеллы — рибосомы. Рибосомы представляют собой рибонуклеопротеидные комплексы, построенные из 2 субъединиц: большой и малой. Функция рибосом заключается в узнавании трёхбуквенных (трехнуклеотидных) кодонов мРНК, сопоставлении им соответствующих антикодонов тРНК, несущих аминокислоты, и присоединении этих аминокислот к растущей белковой цепи. Двигаясь вдоль молекулы мРНК, рибосома синтезирует белок в соответствии с информацией, заложенной в молекуле мРНК.
Для узнавания аминокислот в клетке имеются специальные «адаптеры», молекулы транспортной РНК (тРНК). Эти молекулы, имеющие форму клеверного листа, имеют участок (антикодон), комплементарный кодону мРНК, а также другой участок, к которому присоединяется аминокислота, соответствующая этому кодону. Присоединение аминокислот к тРНК осуществляется в энерго-зависимой реакции ферментами аминоацил-тРНК-синтетазами, а получившаяся молекула называется аминоацил-тРНК. Таким образом, специфичность трансляции определяется взаимодействием между кодоном мРНК и антикодоном тРНК, а также специфичностью аминоацил-тРНК-синтетаз, присоединяющих аминокислоты строго к соответствующим им тРНК (например, кодону GGU будет соответствовать тРНК, содержащая антикодон ACC, а к этой тРНК будет присоединяться только аминокислота глицин).
Механизмы трансляции прокариот и эукариот существенно отличаются, поэтому многие вещества, подавляющие прокариотическую трансляцию, в значительно меньшей степени действуют на трансляцию высших организмов, что позволяет использовать их в медицинской практике как антибактериальные средства безопасные для организма млекопитающих.
Процесс трансляции разделяют на
инициацию — узнавание рибосомой стартового кодона и начало синтеза.
элонгацию — собственно синтез белка.
терминацию — узнавание терминирующего кодона (стоп-кодона) и отделение продукта.
22. Состав белково-синтезирующей системы клетки.
Синтез белка осуществляется с помощью сложной белоксинтезирующей системы. В ее состав входят следующие компоненты:
1. Рибосомные субъединицы 30S и 50S, которые у прокариот и в митохондриях и хлоропластах эукариот образуют рибосому 70S; или субъединицы 40S и 60S, образующие у эукариот рибосому 80S.
2. Матричная РНК (мРНК).
3. Полный комплект двадцати аминоацил-тРНК, для образования которых необходимы соответствующие аминокислоты, аминоацил-тРНК-синтетазы, тРНК и АТФ. Аминоацил-тРНК (аа-тРНК) - это заряженная энергией и связанная с тРНК аминокислота, готовая для подвоза к рибосоме и включения в синтезирующийся на ней полипептид.
4. Белковые факторы инициации (у прокариот - IF-1, IF-2, IF-3).
5. Белковые факторы элонгации (у прокариот - EF-Tu, EF-Ts, EF-G).
6. Белковые факторы терминации (у прокариот - RF-1, RF-2, RF-3).
7. Некоторые другие белковые факторы (ассоциации, диссоциации субъединиц, высвобождения и пр.).
8. Гуанозинтрифосфат (ГТФ).
9. Неорганические катионы в определенной концентрации(ионы магния) (1 . Аминокислоты - Субстраты для синтеза белков
2. тРНК - тРНК выполняют функцию адаптеров. Они акцепторным концом взаимодействуют с аминокислотами, а антикодоном - с кодоном мРНК.
3. Аминоацил-тРНК синтетазы - Каждая аа-тРНК-синтетаза катализирует реакцию специфического связывания одной из 20 аминокислот с соответствующей тРНК
4.мРНК - Матрица содержит линейную последовательность кодонов, определяющих первичную структуру белков
5. Рибосомы - Рибонуклеопротеиновые субклеточные структуры, являющиеся местом синтеза белков
6. АТФ, ГТФ - Источники энергии
7. Белковые факторы инициации, элонгации, терминации - Специфические внерибосомные белки, необходимые для процесса трансляции (12 факторов инициации: elF; 2 фактора элонгации: eEFl, eEF2, и факторы терминации: eRF)
8. Ионы магния - Кофактор, стабилизирующий структуру рибосом)
Основным компонентом белоксинтезирующей системы является рибосома. Она объединяет все компоненты в единый комплекс. Рибосомы — «святая святых» клетки, так как именно на них совершается самое удивительное таинство живой материи — биологический синтез белка. Информация, содержащаяся в геноме, расшифровывается и материализуется в виде белков на рибосомах. Без них проявление жизнедеятельности невозможно.
Вирусы и плазмиды потому и являются облигатными внутриклеточными паразитами, что у них отсутствуют собственные рибосомы, и для реализации генетической информации (т. е. для проявления своей жизнедеятельности) они используют рибосомный аппарат клетки-хозяина. Универсальности генетического кода соответствует универсальность механизма его расшифровки и реализации.
В природе существует только два класса рибосом — 70S и 80S. Они имеют сходную молекулярную структуру и механизм функционирования, хотя и различаются по размерам, составу и специфичности белков и белковых факторов. Далее весь процесс биосинтеза белка будет рассматриваться на примере работы рибосом 70S.
Белковые факторы инициации (англ. initiation factors — IF) получили свое название потому, что они участвуют в организации активного комплекса (708-комплекса) из субъединиц 30S и 50S, мРНК и инициаторной аминоацил-тРНК (у прокариот — формилметионил-тРНК), который «запускает» (инициирует) работу рибосом — трансляцию мРНК.
Белковые факторы элонгации (англ. elongation factors — EF) участвуют в удлинении (элонгации) синтезируемой полипептидной цепи (пептидила). Белковые факторы терминации или освобождения (англ. — release factors — RF) обеспечивают кодон-специфическое отделение полипептида от рибосомы и окончание синтеза белка.
Для осуществления трансляции необходимо участие ГТФ (Гуанозинтрифосфат). Потребность белоксинтезирующей системы в ГТФ очень специфична: он не может быть заменен ни одним из других трифосфатов. На биосинтез белка клетка затрачивает энергии больше, чем на синтез любого другого биополимера. Образование каждой новой пептидной связи требует расщепления четырех высокоэнергетических связей (АТФ и ГТФ): двух для того, чтобы нагрузить аминокислотой молекулу тРНК, и еще двух в ходе элонгации — одну при связывании аа-тРНК и другую при транслокации.
Рибосома выполняет следующие функции, необходимые для биосинтеза белка.
1. Функция динамического связывания и удержания всех компонентов белоксинтезирующей системы, благодаря чему создаются условия для встречи и взаимопрочитывания двух основных потоков информации, один из которых запрограммирован в мРНК, а другой - в антикодонах аа-тРНК; одновременно формируется биологическая машина, синтезирующая белок в строгом соответствии с последовательностью поступления в рибосому этой информации.
2. Каталитические функции, в частности образование пептидных связей между аминокислотами в синтезируемом полипептиде и гидролиз ГТФ.
3. Функция механического перемещения (транслокации): транслокация растущего пептида, связанного с тРНК, с одного участка рибосомы на другой и продвижение рибосомы вдоль мРНК. Выполнение этих функций обеспечивается наличием на рибосоме особых активных участков. Таких участков три. С одним из них связывается мРНК. Два других разных участка предназначены для связывания молекулы тРНК. В одном из них, получившем название пептидил-тРНК-связывающего участка, или Р-участка, прикрепляется тРНК, присоединенная к растущему концу полипептидной цепи — донорная тРНК. В другом — аминоацил-тРНК-связывающем участке, или А-участке, — связывается только что поступившая молекула тРНК, нагруженная аминокислотой - акцепторная тРНК. В обоих участках молекулы тРНК прочно прикрепляются лишь в том случае, если их антикодоны комплементарны кодонам мРНК и с ними спариваются.
А- и Р-участки располагаются очень близко друг от друга, и поэтому связанные с ними молекулы тРНК связываются с двумя соседними кодонами в молекуле мРНК. Благодаря такому близкому расположению донорной тРНК, несущей пептидил, и акцепторной тРНК, несущей активированную аминокислоту, облегчается образование пептидных связей в синтезируемой полипептидной цепи. В процессе элонгации карбоксильный конец растущего пептидила отделяется в Р-участке от молекулы донорной тРНК и образует пептидную связь с аминокислотой, присоединенной к молекуле акцепторной аа-тРНК. Эта реакция катализируется пептидилтрансферазой — ферментом, прочно связанным с рибосомой.
