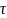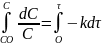- •Общаяя химия
- •Четыре варианта влияния на температуры самопроизвольный процесс:
- •Теория активных соударений
- •Катализ
- •Для не электролитов
- •Теория аррениуса
- •Буферные растворы
- •Сн3cooh / ch3cooNa; и добавили hCl
- •Сн3cooh / ch3cooNa; и добавили koh
- •CrCl3 6h2o
- •К омплексные соединения
- •Глицерат меди
- •Классификация электродов по природе реакции
- •30,5 КДж/моль
- •Мицелла
Министерство здравоохранения РФ
Иркутский государственный медицинский университет
Кафедра бионеорганической и биоорганической химии
Общаяя химия
«ЛЕКЦИОНЫЙ МАТЕРИАЛ»
ИРКУТСК 2008
ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА
ТЕРМОДИНАМИКА – это наука, изучающая энергетические превращение в живой или не живой системе, с физическими, химическими, биологическими свойствами.
Система – любой объект природы состоящий из большого количества частиц, реальной или воображаемой границе от окружающей среды.
Изолированные системы – это такие системы которые не обмениваются веществом и энергией с внешней средой.
Закрытые системы – это системы которые не обмениваются веществом но обмениваются энергией.
Открытые системы – это системы которые обмениваются и веществом и энергией.
Фаза – это совокупность всех однородных по составу поверхностных разделов.
Состояние – совокупность полу систем обладаемых данный момент времени.
Экстенсивные – зависящие от объёма, массы, энергии и количества вещества.
Интенсивные – независящие от давления, температуры и плотности.
Параметры состояния: давление, температура, количество вещества.
Калорийность – это энергия, выделяемая при сгорании 1г. пищи.
Функции состояния не зависят от способа достижения состояния от самого состояния.
T0 = 250, 298 K.
P0 = 1атм., 101325 Па = 1,013 105
n = 1 моль
Внутренняя энергия (U) – общий запас энергии системы, обусловленный всеми видами движений и взаимодействий, составляющих её молекул, атомов, ионов и элементарных частиц.
Но в системе существуют ещё процессы:
Изотермический – протекает при постоянной температуре Q = A'
Изобарный – протекает при постоянном давлении Q = ∆H, Q = ∆U + p∆V
Изохорный – протекает при постоянном объёме ∆U = Q, A = 0
Адиабатный – это процесс при котором система не получает теплоты из окружающей среды Q = 0, ∆U = A
Равновесный процесс – проходит через одинаковое состояние: внутренней энергией, энтальпии, энтропии, энергии Гиббса.
Принцип Берло – все экзотермические реакции протекают самопроизвольно.
Самопроизвольный процесс – это процесс способный протекать в направлении, описываемом соответствующих уравнением, без необходимости затраты энергии.
Четыре варианта влияния на температуры самопроизвольный процесс:
∆Н<0, ∆S>0, ∆G<0, при любых идет температурах,
∆Н>0, ∆S<0, ∆G>0, не идет ни при каких температурах,
∆Н<0, ∆S<0, ∆G<0 , при низких температурах,
∆Н>0, ∆S>0, ∆G<0, при высоких температурах.
I-й закон термодинамики – это теплота, подведенная к системе, расходуется только на увеличении внутренней энергии системы и на совершение: работы против внешних сил.
Q =∆U + A;
Суть I-го закона – это один вид энергии может превращаться в другой.
Теплота – [Дж] – Q =∆U+p∆V; работа – [Дж] – А =p∆V
Энтальпия – это функция состояния, приращение которой равно теплоте, полученной системой в изобарном процессе ∆Н = Н2 – Н1
Н =U +pV; Q =∆H – [кДж/моль] – Энтальпия;
Закон Лавуавье-Лапласа – при образовании вещества выделяется столько же теплоты, сколько поглощается при его распаде.
Закон Гесса – тепловой эффект реакции зависит, только от природы и состояний исходных веществ и конечных продуктов реакции и не зависит от пути, по которому реакция протекает.
Q = Q1 + Q2
Расчёт энтальпии , два следствия:


II-й закон термодинамики – в условиях постоянной температуры и давления самопроизвольно могут протекать только такие процессы, для которых изменение энергии Гиббса ∆G отрицательно, т.е. такие процессы, при которых система способна совершать работу против внешних сил ∆G =∆H - T∆S
Суть II-го закона – это та энергия, которая может самопроизвольно переходить от одного состояния к другому.

Энтропия
– это функция состояния системы,
приращение которой ∆S
равно теплоте Qобр
подведенной
к системе в обратимом изотермическом
процессе, делённой на абсолютную
температуру Т, при которой осуществляется
процесс


Формула Больцмана – соотношение между энтропией S и термодинамической вероятностью w. На соотношении Больцмана основано статистическое истолкование второго начала термодинамики: природные процессы стремятся перевести термодинамическую систему из состояний менее вероятных в состояния более вероятные (т. е. привести систему в равновесное состояние, для которого значения W и S максимальны).

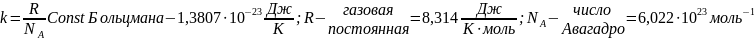
Расчёт энтропии:

Свободная энергия (энергия Гиббса) – термодинамическая функция состояния, определяемая через энтальпию и энтропию в форме соотношения G =H – TS. Изменение состояния системы при постоянных температуре и давлении сопровождается изменением свободной энергии, которое определяется соотношением ∆G0 =∆H0- T∆S0 .
∆G0 =∆H0- T∆S0 ; T =298 K где H =U+pV;
Энергия Гельмгольца – это разность между внутренней энергией U и произведением температуры Т на энтропию S:
F =U – TS
Уравнение Гиббса-Гельмгольца – [Дж] – G =U+pV-TS;
Amax = -∆G.
Расчет свободной энергии:

 ∆G0
=∆H0-
T∆S0
;
∆G0
=∆H0-
T∆S0
;
Термодинамическое равновесие


Изотерма
Вант-Гоффа
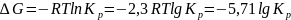




Экзэргонический процесс – протекает с выделением теплоты (на пример гидролиз АТФ)
Эндэргонический процесс – протекает с поглощением теплоты (на пример окисление)
AH2
K0[НАДГ]
BH2


Экз.
Энз.
A
K0Н2
B


 А
АДФ
D
А
АДФ
D
Экз. Энз.
 АТФ
АТФ
В С
Законы Скулачёва (энергия в живой клетке)
Живая клетка не может использовать энергию внешних ресурсов,
В организме человека находится два конвертера энергии: АТФ – растворимая, АТФ – мембранная,
Энергия
АТФ
Работа
∆ℳН+
∆ℳNa+
Работа
Работа
Обучающие задачи и эталоны их решения
Задача 1.
Какое количество тепла получит организм при метаболизме 18 г глюкозы, если он протекает в направлении:
C6Н12О6(к) + 6О2(г) = 6СО2(г) + 6Н2О(ж)
Расчет выполните на основе следствий из закона Гесса с использованием табличных значений
а) стандартных энтальпий образованней веществ,
б) стандартных энтальпий сгорания
Решение:
1 – Написать термохимическое уравнение реакция
C6Н12О6(к) + 6О2(г) = 6СО2(г) + 6Н2О(ж) ∆H0
2 – Запивать в общем виде математическое выражение следствия на закона Гесса, по которому можно найти тепловой эффект реакции используя
а) стандартные энтальпий образования,
б) стандартные энтальпий сгорания веществ
3 – Выразить ∆H0 реакции через стандартные энтальпий исходных веществ и продуктов реакции с учетом их количества.
а) ∆H0 = (6∆H0обр. (СО2(г)) + 6∆H0обр. (Н2О(ж)) – (∆H0обр. (С6Н12О6(к)) + 6∆H0обр. (О2(г))
б) ∆H0 =(∆H0сгор. (С6Н12О6(к)) + 6∆H0сгор. (О2(г)) – (6∆H0сгор. (СО2(г)) + 6∆H0сгор. (Н2О(ж))
4 – Из таблицы 1 «Термодинамические характеристики элементов» и их соединений выписать значения энтальпий образования указанных веществ е учетом их агрегатного состояния; из таблицы 2. «Теплоты сгорания органических соединений в стандартных условиях» выписать значения энтальпий сгорания:
-
Вещество
∆H0обр. кДж/моль
∆H0сгор. кДж/моль
C6Н12О6(к)
1260
-2815,8
СО2(г)
-393,5
-
Н2О(ж)
-285,8
-
О2(г)
0
-
5 – Подставить табличные значения в выражения следствий из закона Гесса и определить а ∆H0 реакции.
а) ∆H0 реакции = [6 моль (393,5 кДж/моль) + 6 моль (-285,8 кДж/моль)] – [1 моль (1260 кДж/моль)] = 2815,8 кДж/моль
б) ∆H0 реакции = 1 моль (2815,8 кДж/моль) = 2815,8 кДж/моль
6 – Определить количество выделившегося тепла при метаболизме 18 г . глюкозы, исходя из того, что тепловой эффект реакции стехиометрически связан с количеством исходных веществ продуктов реакции.
C6Н12О6(к) + 6О2(г) = 6СО2(г) + 6Н2О(ж) ∆H0 = -2815,8 кДж
Из уравнения реакции следует, что окисление 1моль (180 г) C6Н12О6(к) дает эффект, равный ∆H0 реакции
Тогда


Ответ: при метаболизме 18г глюкозы выделится -281,53 кДж тепла.
Задача 2.
Энтальпия
образования кристаллогидрата (гидратации)
СuSO4
 5Н2O
из безводной соли и воды составляет
-77,7 кДж/моль, а энтальпия растворения
безводной соли в воде составляет -66,1
кДж/моль. Рассчитать энтальпии растворения
кристаллогидрата, указать к кому типу
(экзо- или эндотермическому) относится
этот процесс.
5Н2O
из безводной соли и воды составляет
-77,7 кДж/моль, а энтальпия растворения
безводной соли в воде составляет -66,1
кДж/моль. Рассчитать энтальпии растворения
кристаллогидрата, указать к кому типу
(экзо- или эндотермическому) относится
этот процесс.
Решение:
1 – Кратко записать условия задачи.
Дано:
∆H0обр. (гидратации) СuSO4 5Н2O = -77,7 кДж/моль (∆H01)
∆H0растворения СuSO4 (к) = -66,1 кДж/моль (∆H02)
∆H0растворенния СuSO4 5Н2O – ? (∆H03)
2 – Составить термохимический цикл (треугольник Гесса) для данного процесса.

3 – По треугольнику Гесса выразить взаимосвязь между ∆H0растворенния СuSO4 5Н2O, ∆H0обр. (гидратации) CuSО4 и ∆H0 растворения СuSO4 (к)
∆H0 растворения СuSO4 (к) = ∆H0обр. (гидратации) CuSО4 + ∆H0растворенния СuSO4 5Н2O
4 – Решить уравнение относительно определяемой величины:
∆H0 растворения СuSO4 (к) = ∆H0обр. (гидратации) CuSО4 + ∆H0растворенния СuSO4 5Н2O
5 – Подставка в полученное уравнение числовые значения:
∆H0растворенния СuSO4 5Н2O = (-66,1 кДж/моль) – (-77,7 кДж/моль) = 11,7 кДж/моль
6 – Проанализировать полученные данные ∆H0растворенния СuSO4 5Н2O величина положительная, следовательно, процесс растворения кристаллогидрата эндотермический. Он, действительно, должен быть эндотермическим, поскольку в процессе растворения затрачивается энергия на разрушение связи между солью и водой и на разрушение кристаллической решетки.
Задача 3.
В 440 г ядер земляных орехов содержится 214 г углеводов, 146 г жиров к 79 г белков. Вычислите калорийность орехов. Какое количество ядер земляных орехов потребовалось бы ежедневно человеку в суточной потребностью в анергии 2600 ккал, если бы он питался только ими?
Решение:
1 – Кратко записать условие задачи.
Дано:
m1 (земляных орехов) = 440 г
m (углеводов) = 214 г
m (жиров) = 146 г
m (белков) = 79 г
калорийность (суточная) = 2600 ккал
Калорийность 440 г орехов – ?, m2 (земляных орехов) – ?
2 – Рассчитать калорийность белков, жиров, углеводов, содержащих – в 440 г земляных орехов, используя табличные данные средних значений калорийности указанных компонентов в соответствующих единицах.
калорийность углеводов: 214 г 4 ккал/г = 856 ккал
калорийность белков: 79г 4 ккал/г = 314 ккал
калорийность жиров: 146 9 ккал/г = 1314 ккал
3 – Рассчитать калорийность 440 г земляных орехов
Калорийность 440 г земляных орехов = 856 ккал + 314 ккал + 1314 ккал = 2484 ккал
4 – Вычислить количество земляных орехов, восполняющих суточную потребность в энергии в 2600 ккал.
калорийность 140 г – 2484 ккал
m2
(земляных орехов)
 – 2600 ккал
– 2600 ккал

Задача 4.
Сколько свободной энергии получит организм при метаболизме глюкозы, протекающем направлении:
C6Н12О6(к) = 2C2Н5ОН(ж) + 2СО2(г)
Рассчитать двумя способами. Какой из указанных факторов.
энтальпийный
энтропийный
энтальпийный и энтропийный
определяет самопроизвольность протекания реакции в стандартных условиях ?
Решение:
1 – Записать термодинамическое уравнение протекающей реакции:
C6Н12О6(к) = 2C2Н5ОН(ж) + 2СО2(г); ∆H0 реакции
2 – Записать термодинамическое выражение, по которому можно найти значения ∆G0 реакции.
а) по свободным энергиям образования конечных и исходных продуктов реакции (по следствию из закона Гесса)

б) по уравнению Гиббса
∆G0 =∆H0- T∆S0
3 – Выразить ∆G0 реакции
а)
через значения
 обр. исходных веществ и продуктов
реакции:
обр. исходных веществ и продуктов
реакции:

б) по уравнению Гиббса:
1.
∆H0
реакции выразить как ∆H0обр.
веществ

2. ∆S0 реакции выразить как ∆S0обр. веществ

3. T = 298 К, так как условия стандартные
4 – воспользоваться таблицей
Вещество |
∆H0 кДж/моль |
∆S0 Дж/моль к |
∆G0 кДж/моль |
C6Н12О6(к) |
-1260 |
288,9 |
-919,2 |
C2Н5ОН(ж) |
-277,63 |
161 |
-174,8 |
СО2(г) |
-394,51 |
213,6 |
-394,38 |
5 – Подставить табличные значении в выражения.
Способ
1-й:
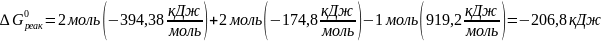
Способ
2-й:



ХИМИЧЕСКАЯ КИНЕТИКА
КИНЕТИКА – это раздел химии, рассматривающий скорости и механизмы химических процессов.
Гомогеменные реакции – это реакции находящиеся в одной фазе.
Гетерогенные реакции – это реакции находящиеся в разных фазах или на границе фаз.
Скорость химической реакции – во многом зависит от того, находится ли реагирующие вещества в одной или разных фарах, т.е. осуществляется гомогенные или гетерогенные реакции.
Закон действующих масс – скорость химической реакции пропорциональна произведению концентраций реагирующих веществ в степенях некоторых чисел, определяемых опытным путем.
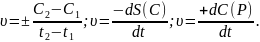
Истинная
скорость
– изменение количества вещества за
бесконечно малый промежуток времени
∆t 0
так
и к своему пределу.
0
так
и к своему пределу.



Если система находится в равновесии
Константа равновесия

При равновесии

Равновесно динамический предел,
Если нам известны АВС то мы легко можем рассчитать константу равновесия,
Молекулярно химические реакции – это число молекул, участвующих в элементарном акте химической реакции.
Реакции бывают:
Мономолекулярные:
I2(г) = 2I(г)
Бимолекулярные:
NO(г) + О3(г) = NO2(г) + О2(г)
Тримолекулярные:
2NO(г) + О2(г) = 2NO2(г)
Может идти через несколько стадий:
2HI + H2O2 = I2 + 2H2O
HI + H2O2 = IOH + H2O (быстрая стадия)
IOH + HI = I2 + H2O (медленная стадия)
2HI + H2O2 = I2 + 2H2O
Частный порядок – это сумма степеней концентрационных членов в соответствующем уравнении для скорости химической реакции.
Общий порядок – это сумма показателей кинетического уравнения.
Методы определения порядка реакции
Метод подстановок |
Заключается
в расчёте констант скоростей (k) или
на основе подстановки экспериментальных
данных для реакций разных порядков
|
|||
Метод графический |
Р
С
С0
α
|
Р =1 Ln С
L n С0
α |
Р =2
|
|
Нагнсения эксперементальных данных по одному из 3-х координатных плоскостей должно дать прямую линию. |
||||
По периоду полупревращений
|
Порядок = 0
|
Прядок = 1
|
Порядок = 2
|
|
|
|
|||
|
|
|
||


Правило Вант-Гоффа – при повышении температуры на каждые 100 скорость реакции (константа скорости) увеличивается в 2- 4 раза.


Принцип Ле Шатель – внешнее воздействие, выводящее систему из термодинамического равновесия, вызывает в ней процессы, стремящиеся ослабить результаты этого воздействия. Предложен А. Ле Шателье (1884), термодинамически обоснован К. Брауном (1887).
Уравнение Аррениуса – это уравнение, связывающее константу скорости реакции с температурой


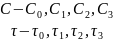
 =0
=0