
- •Закон мозлі
- •9 Квантово-механічна модель атома корпускулярно-хвильовий дуалізм
- •Принцип невизначеності
- •Хвильове рівняння шредінгера
- •Хвильові функції та електронні орбіталі
- •Характеристика стану електрона за квантовими числами
- •Атомні ядра склад і будова атомних ядер
- •Властивості взаємодіючих атомів
- •Валентність
- •Метод валентних зв'язків умови утворення ковалентного зв'язку
- •Водневий зв'язок природа й енергія водневого зв'язку
- •Міжчастинкові взаємодії доказ існування міжчастинкових сил
- •Вандерваальсова взаємодія молекул
- •Іонно-молекулярна взаємодія
- •Будова твердого тіла загальна характеристика твердого стану речовини
- •Будова ідеальних кристалів 7.2.1. Основні положення
- •Кристалічна гратка
- •Типи кристалічних ґраток
- •Будова іонних кристалів основні типи кристалічних ґраток іонних сполук
- •Металічний стан і його особливості кристалічна структура металів
- •Хімічний зв'язок у металах
Типи кристалічних ґраток
Залежно від природи частинок, розміщених у вузлах кристалічної ґратки, і від характеру зв'язку між ними розрізняють іонні, атомні, молекулярні та металічні гратки (рис. 7.3; 7.4). Атомні та молекулярні гратки характерні для сполук з ковалентним зв'яз ком, іонні — для іонних сполук, металічні — для металів та їхніх сплавів.
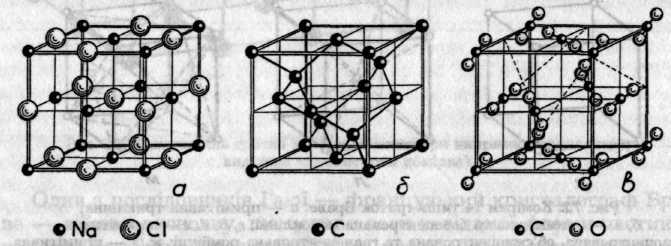
Рис. 7.3. Кристалічні гратки деяких речовин: а — іонна гратка NaCl; б — атомна грат-ка алмазу; в — молекулярна гратка СО2
Іонні гратки складаються з іонів протилежних зарядів, з'єднаних між собою силами електростатичної взаємодії. До сполук з іонними ґратками належить більшість солей і деякі оксиди. Іонні сполуки мають порівняно високу температуру плавлення (600 ... 1400°С), велику твердість і малу леткість. їхні гратки поступаються міцністю перед атомними, але міцніші, ніж молекулярні. На рис. 7.3, а зображена кристалічна гратка Натрій хлориду, кожний іон якого оточений шістьма найближчими іонами протилежного знака. Отже, координаційне число для іонів як Натрію, так і Хлору в кристалі NaCl дорівнює шести.
У вузлах атомних граток розміщені окремі атоми, зв'язані між собою ковалентними зв'язками. Прикладами речовин з атомною граткою є алмаз, силіцій, бор, Силіцій діоксид, деякі карбіди та силіциди. Ці речовини мають велику твердість, тугоплавкість і практично нерозчинні. Такі властивості зумовлені міцністю зв'язків. Наприклад, у кристалі алмазу кожний з атомів зв'язаний з чотирма сусідніми атомами (рис. 7.3,6).
У вузлах молекулярних граток розміщені молекули, між якими діють ненапрямлені слабкі сили міжмолекулярної взаємодії. Тому сполуки з молекулярними ґратками характеризуються низьким КЧ (рис. 7.3,в), мають невелику твердість, легкоплавкі та леткі. Молекулярні гратки властиві більшості неметалів, багатьом неорганічним та органічним речовинам.
У вузлах металічних граток, які мають більшість металів і багато сплавів, розміщені окремі позитивно заряджені іони та нейтральні атоми металів, між якими переміщуються узагальнені електрони. Металічні кристали внаслідок нелокалізованого зв'язку характеризуються високим КЧ, електро- і теплопровідністю, блиском, пластичністю й ковкістю. Для них найхарактерніші три типи ґраток (рис. 7.4): кубічна гранецентрована (КЧ 12), гексагональна (КЧ 12) та кубічна об'ємноцентрована (КЧ 8).
Існують речовини, кристалічні ґратки яких можна розглядати як проміжні. Наприклад, у графіті (рис. 7.5), який має шарувату гексагональну структуру, атоми Карбону у межах одного шару утворюють три ковалентні зв'язки з трьома іншими атомами. Четвертий зв'язок атомів делокалізований у межах усього кристала. Вуглецеві шари об'єднуються в кристалічну гратку за рахунок міжмолекулярних сил. Міцність зв'язків у площині значно більша, ніж між шарами. Тому гратку графіту можна розглядати і як атомну, і як металічну, що пояснює електропровідність графіту, його м'якість і металічний блиск.
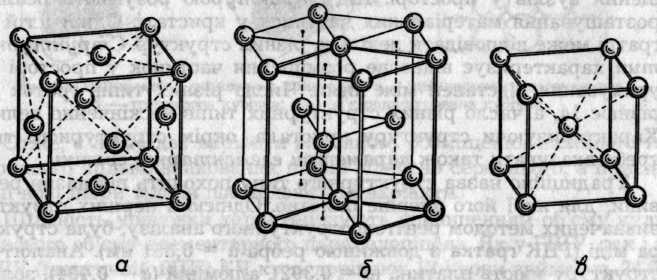
Рис. 7.4. Кристалічні гратки металів: о — кубічна гранецентрована (мідь); б — гексагональна (магній); в — кубічна об'ємноцентрована (a-залізо)
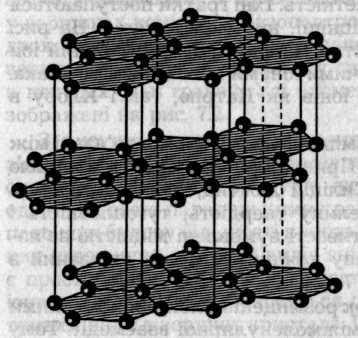
Рис. 7.5. Будова шаруватої ґратки графіту
