
- •Закон мозлі
- •9 Квантово-механічна модель атома корпускулярно-хвильовий дуалізм
- •Принцип невизначеності
- •Хвильове рівняння шредінгера
- •Хвильові функції та електронні орбіталі
- •Характеристика стану електрона за квантовими числами
- •Атомні ядра склад і будова атомних ядер
- •Властивості взаємодіючих атомів
- •Валентність
- •Метод валентних зв'язків умови утворення ковалентного зв'язку
- •Водневий зв'язок природа й енергія водневого зв'язку
- •Міжчастинкові взаємодії доказ існування міжчастинкових сил
- •Вандерваальсова взаємодія молекул
- •Іонно-молекулярна взаємодія
- •Будова твердого тіла загальна характеристика твердого стану речовини
- •Будова ідеальних кристалів 7.2.1. Основні положення
- •Кристалічна гратка
- •Типи кристалічних ґраток
- •Будова іонних кристалів основні типи кристалічних ґраток іонних сполук
- •Металічний стан і його особливості кристалічна структура металів
- •Хімічний зв'язок у металах
Міжчастинкові взаємодії доказ існування міжчастинкових сил
Існування речовин у різних агрегатних станах свідчить про те, що між незарядженими частинками (атомами, молекулами) можуть діяти сили притягання, які не укладаються в звичайні валентні уявлення. Зокрема, дією цих сил пояснюються:
1) перехід з газуватого стану в рідкий або твердий;
2) відмінність між реальними та ідеальними газами. Сили взаємодії між частинками реальних газів уперше врахував Ван дер Ваальс (1873) у рівнянні стану газів;
3) явище Джоуля—Томсона (1854) — охолодження газу під час його адіабатного проникнення крізь пористу перетинку. Воно вказує на те, що при розширенні долаються сили притягання;
4) конденсація інертних газів, які не утворюють звичайних валентних зв'язків, у рідкий та твердий стани з виділенням енергії;
5) процеси адсорбції, сублімації, каталізу, розчинення і сольватації.
Ці сили являють собою взаємодію електронів і ядер різних частинок декількох типів, але їх об'єднують під загальною назвою міжчастпинкових, або вандерваальсових сил. Найважливішою і відмінною рисою вандерваальсових сил є їх універсальність, оскільки вони діють без винятку між усіма атомами і молекулами. Міжчастинкові сили відрізняються від хімічних тим, що вони виявляються на значно більших відстанях (на яких дія хімічних сил зникає), характеризуються малою енергією і відсутністю насичуваності та напрямленості. Вони швидко послаблюються зі збільшенням відстані між частинками, причому відштовхування спадає значно швидше притягання. Як правило, вандерваальсові сили між частинками зростають зі збільшенням числа електронів у частинці, тобто приблизно пропорційно формульній масі. Оскільки вони діють між валентно-насиченими частинками, то їх називають також залишковими силами.
Вандерваальсова взаємодія молекул
Міжмолекулярна взаємодія має електромагнітну і квантово-механічну природу і складається з сил притягання та відштовхування. Сили притягання є результатом дії трьох ефектів: орієнтацій-ного, індукційного та дисперсійного:
![]()
Енергія всіх трьох доданків пов'язана з дипольною взаємодією різного походження (рис. 6.47).
Орієнтаційний ефект виникає лише між полярними молекулами, які мають власний дипольний момент. Внаслідок хаотичного теплового руху молекули при зближенні орієнтуються так, що різнойменно заряджені кінці їхніх диполів притягаються (рис. 6.47, а). Енергія диполь-дипольного притягання визначається співвідношенням (Кеезом, 1912)
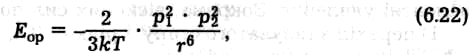
де р1 і р2 — постійні дипольні моменти взаємодіючих молекул; r — відстань між центрами диполів; k — константа Больцмана; Т — абсолютна температура.
Чим полярніші молекули, тим сильніше вони притягаються і тим більша енергія орієнтаційного ефекту. З підвищенням температури ефект зменшується, бо підсилений тепловий рух порушує взаємну орієнтацію диполів. Найсильніше орієнтаційний ефект виявляється у молекул, що мають великий дипольний момент і малі розміри (Н2О, NH3). У молекул, що мають малий дипольний момент (CO) або великі розміри (SO2), орієнтаційний ефект менший, а у неполярних частинок (СО2, інертні гази) він взагалі відсутній.
Індукційний ефект зумовлений дією індукованих диполів молекул, які можуть виникати в неполярних молекулах внаслідок постійного дипольного моменту сусідніх молекул (рис. 6.47, б). Взаємодія постійного диполя однієї молекули та індукованого диполя іншої спричинює зниження енергії системи з двох молекул. У свою чергу індукований диполь збільшує дипольний момент полярної молекули. Енергію взаємодії диполя з індукованим диполем обчислюють за формулою (Дебай, 1920)
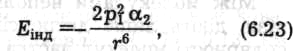
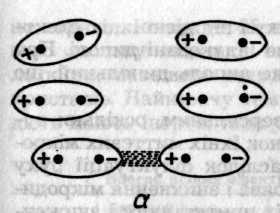
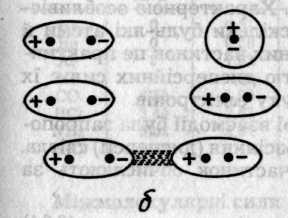
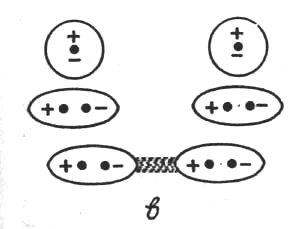
Рис. 6.47. Схематичне зображення орієнтаційного (а), індукційного (б)
та дисперсійного (в) ефектів між молекулами
Оскільки орієнтація наведеного диполя визначається лише напрямком постійного диполя, то енергія індукованої взаємодії не залежить від температури. Вона збільшується зі зростанням дипольного моменту й поляризованості та швидко спадає зі збільшенням відстані.
Енергія індукційного ефекту в десять-двадцять разів менша від енергії орієнтаційного ефекту. Вона суттєва лише для таких молекул, які легко поляризуються. Наприклад, індукційний ефект амоніаку вищий, ніж води, оскільки поляризованість молекул NH3 більша ніж Н2О, хоч дипольний момент амоніаку менший.
Під час взаємодії двох полярних молекул під дією їхніх електричних полів у них виникають додатково індуковані диполі. При цьому індукований ефект накладається на диполь-дипольний, що збільшує взаємне притягання.
Дисперсійний ефект є найбільш універсальним, оскільки зумовлюється взаємодією частинок за рахунок їхніх миттєвих мікро-диполів (рис. 6.47, в), які виникають внаслідок флуктуації руху електронів і коливань ядер. Синхронна поява і зникнення мікроди-полів різних частинок супроводжується їх притяганням і зниженням енергії системи. Якщо синхронність порушується, то диполі руйнуються й частинки відштовхуються. Характерною особливістю дисперсійних сил є їх загальність, оскільки будь-які атоми й молекули мають електрони. Для неполярних частинок це практично єдине джерело сил. Іншою особливістю дисперсійних сил є їх адитивність — результат узгодженого руху електронів.
Кількісна характеристика дисперсійної взаємодії була запропонована Лондоном (1930) на основі теорії розсіяння (дисперсії) світла. Енергію цієї взаємодії для однакових частинок обчислюють за формулою

де hvo/2 — енергія коливань атомів при Т = 0 К з частотою v0. Наближено величину hv0 можна вважати рівною потенціалу іонізації.
Відносний внесок кожного з розглянутих видів взаємодії у сумарний ефект залежить в основному від двох властивостей взаємодіючих молекул — полярності та поляризованості.
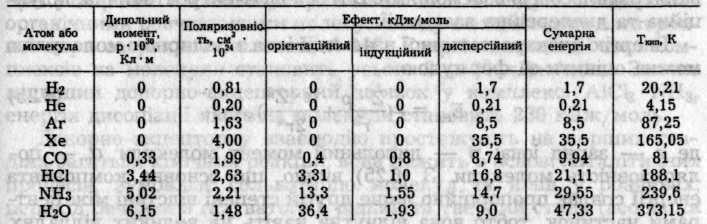
Між молекулами неполярних речовин або атомами інертних газів діють лише дисперсійні сили притягання. Зі збільшенням полярності молекул частка індукційних та орієнтаційних сил між ними зростає. Зі зростанням поляризованості молекул збільшується дисперсійний ефект. Індукційний ефект залежить від обох факторів, але сам має другорядне значення. Відносні значення трьох ефектів для деяких полярних і неполярних частинок наведені в табл. 6.2.
Знак мінус у рівняннях (6.22) — (6.24) означає, що для роз'єднання атомів або молекул необхідно виконати роботу, тобто, що діють сили притягання. Фактично ці рівняння стосуються енергії взаємодії. Силу притягання fпр визначають диференціюванням за r, a тому вона обернено пропорційна r7 у кожному випадку.
Порівняно з ковалентним зв'язком вандерваальсова взаємодія досить слабка. Про слабкість вандерваальсо-вого зв'язку свідчать низька температура плавлення, висока леткість, невелика твердість і незначна густина молекулярних кристалів. Найнижчу температуру плавлення й мінімальну твердість мають інертні гази у твердому стані.
Таблиця 6.2. Внесок різних ефектів в енергію вандерваальсової взаємодії
Міжмолекулярні сили принципово відрізняються від кулонівсь-ких своєю однозначністю — вони виявляються лише в притяганні. Однак при тісному зближенні частинок починають виявлятися сили взаємного відштовхування електронних оболонок атомів, що входять до складу частинок. Ці сили більш близькодіючі, ніж сили притягання, і зменшуються при збільшенні відстані за законом
![]()
Внаслідок урівноваження сил притягання та відштовхування кожному атому й кожній молекулі можна приписати певний радіус. Природно, що вандерваальсові радіуси завжди більші, ніж ковалентні. Наприклад, для Іоду ці радіуси становлять 0,177 і 0,134 нм.
Міжмолекулярна взаємодія характеризується потенціальною енергією взаємодії, що враховує як енергію притягання, так і енергію відштовхування
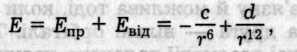
де с і d — сталі притягання та відштовхування. Обчислити потенціальну енергію при величезній кількості пар взаємодіючих частинок практично неможливо. Тому звичайно вираз Е(r) підбирають емпірично так, щоб він узгоджувався з експериментом. Особливо широкого застосування набула формула Леннард-Джонса (1924)
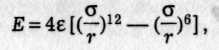
де ε — максимальна енергія притягання (аби глибина потенціальної ями.
