
- •1. Основные понятия кинематики.
- •2. Скорость.
- •3. Ускорение.
- •4. Равномерное прямолинейное движение.
- •5. Равнопеременное прямолинейное движение.
- •6. Кинематика вращательного движения твёрдого тела.
- •7. Понятие силы.
- •8. Законы Ньютона.
- •9. Законы сохранения и изменения импульса.
- •10. Работа сил. Консервативные и неконсервативные силы.
- •11. Мощность.
- •12. Кинетическая и потенциальная энергия.
- •13. Закон сохранения механической энергии.
- •14. Теоремы об изменении энергии.
- •15. Закон всемирного тяготения.
- •16. Упругий и неупругий удары.
- •17. Момент инерции.
- •18. Момент силы.
- •19. Основной закон динамики вращательного движения.
- •20. Момент импульса.
- •21. Закон сохранения момента импульса.
- •22. Кинетическая энергия вращательного движения тел.
- •23. Уравнения динамики вращательного и поступательного движений.
- •24. Основные положения молекулярно-кинетической теории.
- •25. Уравнение состояния идеального газа.
- •26. Газовые законы для изопроцессов.
- •27. Работа газа.
- •28. Внутренняя энергия газа. Понятие степеней свободы.
- •29. Первое начало термодинамики.
- •30. Теплоёмкость.
- •31. Закон Кулона.
- •32. Напряжённость электростатического поля.
- •33. Принцип суперпозиции электростатических полей.
- •34. Поток вектора напряжённости.
- •35. Расчёт полей с помощью теоремы Гаусса.
- •36. Работа сил электростатического поля. Условие потенциальности электростатического поля.
- •37. Потенциал электростатического поля. Принцип суперпозиции. Связь напряжённости и потенциала электростатического поля.
- •38. Электрический ток. Сила и плотность тока.
- •39. Закон Ома в дифференциальной форме.
- •40. Эдс. Напряжение. Закон Ома для неоднородного участка цепи.
- •41. Работа и мощность тока. Закон Джоуля-Ленца.
- •42. Правила Кирхгофа.
- •43. Магнитное поле. Закон Био-Савара-Лапласа.
- •44. Сила Ампера. Взаимодействие параллельных проводников.
- •45. Сила Лоренца.
- •46. Закон электромагнитной индукции. Магнитный поток. Правило Ленца.
- •47. Явление самоиндукции. Индуктивность контура.
- •48. Явление взаимоиндукции. Взаимная индуктивность.
- •49. Механические колебания.
- •50. Упругие волны.
- •51. Стоячие волны.
- •52. Интерференция света.
- •53. Кольца Ньютона в отражённом свете. Радиус светлых колец.
- •54. Кольца Ньютона в отражённом свете. Радиус тёмных колец.
- •55. Дифракция света. Принцип Гюйгенса-Френеля. Метод зон Френеля.
- •56. Дифракция на щели.
- •57. Дифракционная решётка.
- •58. Дифракционная решётка, как спектральный прибор.
25. Уравнение состояния идеального газа.
Идеальный газ — математическая модель газа, в которой предполагается, что потенциальной энергией взаимодействия молекул можно пренебречь по сравнению с их кинетической энергией. Между молекулами не действуют силы притяжения или отталкивания, соударения частиц между собой и со стенками сосуда абсолютно упруги, а время взаимодействия между молекулами пренебрежимо мало по сравнению со средним временем между столкновениями.
Для описания состояния газа было получено уравнение состояния идеального газа, которое называется уравнением Менделеева-Клапейрона:
p*V = (m/M)*R*T,
где R = 8,31 Дж/(моль*К) — универсальная газовая постоянная.
26. Газовые законы для изопроцессов.
Изопроцессами называются такие изменения состояния газа, при которых изменяются лишь два параметра из пяти, входящих в уравнение состояния идеального газа.
Изотермический процесс: pV = const (температура остается постоянной; M, т = const) — закон Бойля-Мариотта
Изобарный процесс: V/T = const (давление остается постоянным; М, т = const) это закон Гей-Люссака.
Изохорный процесс: p/T = const (объем остается постоянным; M, m = const) это закон Шарля.
Адиабатный процесс – процесс, происходящий
без теплообмена системы с окружающей
средой: ![]() .
1 начало термодинамики:
.
1 начало термодинамики: ![]() ;
уравнение Пуассона:
;
уравнение Пуассона: ![]() .
Работа:
.
Работа: ![]()
27. Работа газа.
Работа газа (при изобарном, изотермическом, адиобатном процессах)
dA=Fdh; dA=PSdh, Sdh=dV – объем цилиндра. ![]() частный
дифференциал, зависит от процесса.
Работа – процесс.
частный
дифференциал, зависит от процесса.
Работа – процесс.
P=const (изобарный): ![]()
T=const (изотермический): ![]()
V=const (изохорный): А=0
Адиабатный:
28. Внутренняя энергия газа. Понятие степеней свободы.
Внутренняя энергия: ![]() ;
произвольной массы газа:
;
произвольной массы газа: ![]()
Число степеней свободы – кол-во независимых величин, с помощью которых мб задано положение системы. Всего 6 степеней: 3 – поступательные и 3 вращательные. При упругой связи: 3 поступательные, 2 вращательные и 1 колебательную. Упруго связанные материальные точки: 3 степени свободы.
Закон равнораспределения: на каждую
степень свободы молекулы проходится в
среднем одинаковая кинетическая энергия,
равная 1/2kT. Средняя энергия молекулы:
![]() .
Внутренняя энергия:
.
Внутренняя энергия:
29. Первое начало термодинамики.
Количество теплоты, полученное системой, идет на изменение ее внутренней энергии и на совершение работы над внешними телами: Q = ΔU + A.
В изохорном процессе газ работы не совершает, и ΔU = Q. В изобарном процессе A = pΔV = p (V2 – V1). В изотермическом процессе ΔU = 0, и A = Q; вся теплота, переданная телу, идет на работу над внешними телами. Графически работа равна площади под кривой процесса на плоскости p, V.
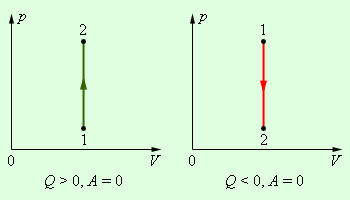
Первое начало термодинамики для изохорного процесса.

Первое начало термодинамики для изобарного процесса.

Первое начало термодинамики для изотермического процесса.

Первое начало термодинамики для адиабатного процесса.
Адиабатным называется квазистатический процесс, при котором системе не передается тепло из окружающей среды: Q = 0. В адиабатном процессе вся работа совершается за счет внутренней энергии газа.
Кол-во теплоты, сообщенное системе идет
на приращение ее внутренней энергии и
на совершение системой работы над
внешними силами (в интегральной форме):
![]() ,
в дифференциальной форме:
,
в дифференциальной форме: ![]() состояние.
состояние.
