
10201
.pdf
130
iп 2500 1,93t, кДж/ кг.
Таким образом, энтальпия влажного воздуха
(288)
При сушке различных продуктов нагретым воздухом влагосодержание его увеличивается за счет испарения воды. Этот процесс называют адиабатным испарением воды, если теплоту, необходимую для испарения, берем только из окружающего воздуха. Температура воздуха при этом понижается, причем если этот процесс продолжается до полного насыщения воздуха, то температура его понижается до так называемой температуры адиабатного насыщения воздуха,
известной также под названием истинной температуры мокрого термометра.
На практике для определения относительной влажности воздуха часто пользуются психрометром – прибором, состоящим из двух термометров. Ша-
рик одного из них обернут влажной тканью, вследствие чего показания сухого и мокрого термометров различны. Температура, показываемая мокрым термо-
метром психрометра, не равна истинной температуре мокрого термометра, а
всегда несколько выше ее. Объясняется это притоком теплоты через выступа-
ющий столбик ртути и восприятием шариком термометра теплоты, излучаемой окружающими предметами.
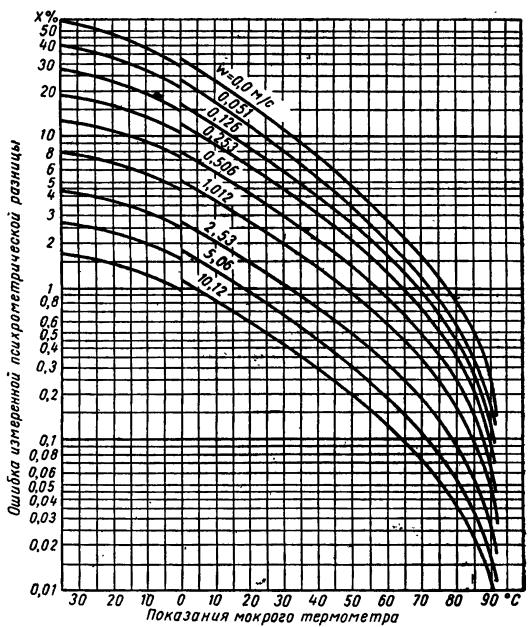
Истинная температура мокрого термометра tм определяется из формулы
|
|
|
|
|
x(tc tм ) |
, C, |
(289) |
tм tм |
1000 |
||
|
|
|
где t'м – показания мокрого термометра; tс – t'м – психрометрическая разность;
х – поправка к показанию мокрого термометра в процентах, определяемая из рис. 80.
Отклонение показаний мокрого термометра от истинной температуры мокрого термометра значительно уменьшается, если шарик термометра омыва-
ется потоком воздуха, имеющим большую скорость, а также, если шарик и столбик термометра защищены от восприятия теплоты, отдаваемой окружаю-
щими предметами.
131
Рис. 80
Диаграмма I-d влажного воздуха, предложенная проф. Л. К. Рамзиным,
весьма удобна для определения параметров влажного воздуха. Она также зна-
чительно упрощает решение различных задач, связанных с изменением состоя-
ния влажного воздуха и, особенно, с процессами осушения. В этой диаграмме по оси абсцисс отложено влагосодержание d, а по оси ординат – энтальпия I
влажного воздуха (на 1 кг сухого воздуха). Барометрическое давление принято
В = 745 мм рт. ст. (среднегодовое давление для центральной полосы РФ). Для более удобного расположения отдельных линий на диаграмме координатные

132
оси в ней проведены под углом 135° (рис. 81).
В выполненных диаграммах наклонная ось влагосодержания не вычерчи-
вается, а вместо нее из начала координат проводится горизонталь, на которую значения d спроектированы с наклонной оси. Поэтому линии I = const идут наклонно, параллельно наклонной оси абсцисс, линии же d = const идут верти-
кально, параллельно оси ординат. В диаграмме I-d построены также изотермы
(t = const), весьма близкие к прямым.
Рис. 81
Кривая φ = 100% является своего рода пограничной кривой, кривой насыщения. Вся область над линией φ = 100% соответствует влажному насы-
щенному воздуху (для различных значений φ). Область, лежащая под этой ли-
нией, характеризует состояние воздуха, насыщенного водяным паром.

133
Рис. 82
Кроме указанных кривых, в последних изданиях диаграмм I-d приведены также линии постоянных истинных температур мокрого термометра tм. Внизу диаграммы построена кривая рп = f (d) по формуле (280) в прямоугольной си-
стеме координат. По оси ординат отложено парциальное давление в мм рт. ст., а
по оси абсцисс – влагосодержание.

134
На рис. 82 дана диаграмма I-d для воздуха при барометрическом давлении
В = 745 мм рт. ст. Процесс подогрева или охлаждения влажного воздуха изоб-
ражается на этой диаграмме как процесс при постоянном влагосодержании
(d = const), а процесс сушки – как процесс с постоянной энтальпией (i = const).
Диаграмма I-d дает возможность по двум каким-либо параметрам влажного воздуха (обычно φ и t) определить I, d и рп. По этой диаграмме можно также найти и точку росы. Для этого нужно из точки, характеризующей состояние воздуха, провести вертикаль (d = const) до пересечения с линией φ = 100 %.
Изотерма, проходящая через эту точку, определяет температуру точки росы.
Состояние влажного воздуха можно также определить по диаграмме I-d,
если известны показания сухого и мокрого термометров психрометра. Внося необходимую поправку в показание мокрого термометра по формуле (289),
находим истинную температуру мокрого термометра. Далее из точки, соответ-
ствующей относительной влажности φ = 100 % и истинной температуре мокро-
го термометра, проводят параллельно изотерме tм, прямую до пересечения с изотермой сухого термометра tc. Полученная точка характеризует состояние влажного воздуха.
Задача
Определить влагосодержание воздуха при температуре t = 60 °С и баро-
метрическом давлении В = 99325 Па (745 мм рт. ст.), если относительная влаж-
ность воздуха φ = 60 %.
Решение
По формуле (278)
dρп ,
ρн
а так как по уравнению (277)
φpп , pн
135
то
pп 0,6 0,019917 0,012 МПа.
По таблицам перегретого водяного пара для р = 0,012 МПа и t = 60 °С
находим v = 12,78 м3/кг. Тогда
|
|
|
|
|
|
ρ |
|
|
1 |
0,078 кг/ м3 . |
||||
|
|
|
|
|
|
п |
|
|
||||||
|
|
|
|
12,78 |
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
||
Парциальное давление воздуха |
|
|
|
|||||||||||
pв p pп 99325 12000 87325 |
Па 0,0873 МПа. |
|||||||||||||
Плотность влажного воздуха |
|
|
|
|||||||||||
|
|
|
|
p |
|
|
|
0,0873 106 |
|
|||||
ρ |
|
|
|
|
в |
|
|
|
|
|
|
0,913 кг/ м3 , |
||
в |
|
|
|
|
|
|
|
|
||||||
|
|
RT |
|
287 (273 60) |
|
|||||||||
|
|
|
|
|
||||||||||
поэтому |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
d |
|
0,078 |
0,0854 кг/ кг 85, 4 г/ кг. |
||||||||||
|
0,913 |
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|||||
Значение d можно также определить из формулы (279):
d 622 |
pп |
622 |
0,012 |
85, 2 г/ кг. |
B p |
0,0873 |
|||
|
п |
|
|
|
14. ТЕРМОДИНАМИКА ХИМИЧЕСКИХ ПРОЦЕССОВ
Химическими процессами называются процессы, в результате которых образуются новые вещества, отличающиеся по своим физическим и химиче-
ским свойствам от исходных веществ.
Все химические процессы или химические реакции сопровождаются или выделением теплоты, или ее поглощением. Реакции, происходящие с выделе-
нием теплоты, называются экзотермическими, а реакции, сопровождающиеся поглощением теплоты – эндотермическими.
Химические реакции обычно рассматриваются при постоянном объеме или постоянном давлении и одновременно при постоянной температуре до и после реакции. Такие реакции называются соответственно изохорно-
изотермическими и изобарно-изотермическими реакциями.
При протекании химических реакций число молей реагирующих веществ может оставаться неизменным ( п = п2 – п1 = 0), увеличиваться ( п = п2 – п1 > 0)
или уменьшаться ( п = п2 – п1 < 0), где п1 и п2 – число молей реагентов соответ-
ственно до и после реакции, а п – изменение числа молей.
Первый закон термодинамики в применении к химическим процессам имеет следующий вид;
q U L, |
(290) |
где U – изменение внутренней энергии системы;
q – теплота, подводимая к системе или отданная ею;
L – работа, совершаемая системой или полученная ею.
Изменение внутренней энергии U считается положительным при увели-
чении внутренней энергии системы и отрицательным – при ее уменьшении.
Теплота q, подводимая к системе, считается положительной, а отводимая от нее – отрицательной.
Работа L, совершаемая системой, считается положительной, а получаемая ею – отрицательной.
Работа, производимая системой в химических процессах, может состоять
137
из работы расширения и работы, не связанной с изменением объема системы. В
дальнейшем будем считать, что расширение есть единственный вид работы, со-
вершаемый системой (для подавляющего большинства химических процессов это в действительности так). Тогда уравнение (290) первого закона термодина-
мики принимает вид
v2
q U pdv.
v1 |
(291) |
|
|
Тепловым эффектом Q реакции называется количество теплоты, которой |
|
система обменивается с внешней средой при условии, что температура до и по-
сле реакции остается одной и той же. Знаки теплоты, подводимой к системе или отводимой от нее, и теплового эффекта реакции противоположны. По-
этому тепловой эффект экзотермической реакции считается отрицательным, а
эндотермической – положительным.
Для изохорных процессов уравнение (291) принимает вид qv U .
Следовательно, |
|
Qv U U1 U2, |
(292) |
т. е. тепловой эффект Qv в изохорных реакциях равен уменьшению внутренней энергии системы.
Для изобарных реакций уравнение (291) имеет вид qp I ,
следовательно,
Qp I I1 I2 , |
(293) |
т. е. тепловой эффект Qp в изобарных реакциях равен уменьшению энтальпии системы.
Соотношение тепловых эффектов Qv и Qp для идеальных газов зависит от изменения в реакции числа молей:
Qv Qp μR nT . |
(294) |
Таким образом, в реакциях, где число, |
молей уменьшается (Δn < 0), |
138
Qv < Qp; в реакциях, где число молей увеличивается (Δn > 0), Qv > Qp, а в реак-
циях, где число молей остается неизменным ( n = 0), Qv < Qp.
При пользовании уравнением (294) следует иметь в виду, что если в реак-
ции участвуют твердые или жидкие вещества, то при определении n следует
брать лишь изменение числа молей газообразных компонентов реакции.
Русским академиком Г. И. Гессом в 1840 г. опытным путем был установ-
лен следующий закон, которому дано имя Гесса: тепловой эффект реакции не зависит от пути ее протекания и от промежуточных процессов, а зависит
лишь от начального и конечного состояния.
Из закона Гесса вытекают два важнейших следствия:
1. Тепловой эффект реакции равен сумме теплот образования конечных
продуктов реакции минус сумма теплот образования исходных веществ:
Q Qобр.кон Qобр.исх . |
(295) |
2. Тепловой эффект реакции равен сумме теплот сгорания исходных |
|
веществ минус сумма теплот сгорания продуктов реакции: |
|
Q Qср.исх Qср.кон . |
(296) |
Пользуясь этими следствиями, можно вычислить тепловые эффекты ре-
акций, осуществление которых на практике затруднительно или совершенно
невозможно.
Тепловые эффекты химических реакций изменяются с изменением тем-
пературы. Закон изменения теплового эффекта в зависимости от температуры
определяется уравнением
Q Q αT βT 2 |
γT 3, |
(297) |
0 |
|
|
где Q – тепловой эффект реакции при температуре Т, К; Q0 – тепловой эффект реакции при абсолютном нуле; α, β, γ – коэффициенты, определяемые на осно-
вании уравнения реакции и уравнений истинных мольных теплоемкостей реа-
гентов.
Для реакции вида
nAB nBB  nDD
nDD
139
и уравнения температурной зависимости истинной теплоемкости
μc a bT dT 2 |
|||||
коэффициенты α, β и γ соответственно: |
|||||
(na1) (na2 ) nAaA nBaB nCaC nDaD; |
|||||
(nb1) (nb2 ) |
nAbA nBbB nCbC nDbD |
; |
|||
|
|||||
2 |
2 |
|
|
||
(nd1) (nd2 ) |
|
nAdA nBdB nC dC nDdD |
. |
||
|
|||||
3 |
3 |
|
|
||
(298)
(299)
(300)
Величины nA, nB, nC и nD – числа молей веществ A, В, С и D, а величины а, b и d с соответствующими индексами – коэффициенты уравнения истинной теплоемкости каждого реагента. Величина Q0, входящая в уравнение (297),
определяется по значению теплового эффекта реакции для известной темпера-
туры.
Формула (297) дает возможность найти значение теплового эффекта ре-
акции при любой температуре, если известны тепловой эффект реакции при ка-
кой-либо температуре и зависимости теплоемкостей всех реагентов от темпера-
туры.
Изменение теплового эффекта реакции при изменении температуры мо-
жет быть также определено по таблицам теплоемкостей. В этом случае следует пользоваться формулой
Q |
Q |
n |
μc t2 |
t |
n |
μc t1 t , |
(301) |
2 |
1 |
1 |
0 |
2 |
2 |
0 1 |
|
где Q1 – тепловой эффект реакции при температуре t1 °С; Q2 – тепловой эффект реакции при температуре t2 °С; n1 μc t02 – сумма произведений из числа молей каждого исходного вещества на его среднюю мольную теплоемкость в преде-
лах от 0 до t2 °С; n2 μc t01 – сумма произведений из числа молей каждого исход-
ного вещества на его среднюю мольную теплоемкость в пределах от 0 до t1 °С.
Характеристическими или термодинамическими функциями называют такие функции состояния системы, при помощи которых можно наиболее про-
сто определить термодинамические свойства системы, а также находить усло-
