
8781
.pdf61
что можно записать в виде: |
|
|
|
|
|
|
p1V1 |
= |
p2V2 |
. |
(1.5) |
|
|
|
|||
|
T1 |
|
T2 |
|
|
Таким образом, при любом процессе в разреженном газе начальные и конечные параметрами связаны равенством (1.5), а поскольку конечное состояние выбрано произвольно, можно заключить, что при любом состоянии
разреженного газа произведение давления на объем, деленное на абсолютную температуру, для данной массы газа есть величина постоянная:
pV |
= B = const . |
(1.6) |
|
T
Значение постоянной B зависит от массы и рода газа. Из формулы (1.6) следует, что
pV=BT.
Это выражение является уравнением состояния идеального газа и часто называется формулой Клайперона - Менделеева.
Замечание к процедуре вывода уравнения состояния При получении окончательного выражения мы рассмотрели конкретный
термодинамический процесс, состоящий из двух изопроцессов. Результат не изменится, если рассмотреть любой другой путь, состоящий из двух изопроцессов (p1 → p2 при V=const + V1 → V2 при p=const, или T1 → T2 при V=const +V1 → V2 при T=const и т. п.). Рекомендуем вам в качестве полезного упражнения доказать, что результат не зависит от пути, который рассматривается.
Универсальная газовая постоянная. В соответствии с законом,
установленным Авогадро, моли всех газов занимают при одинаковых условиях (т.е. при одинаковых температуре и давлении) одинаковый объем - Vμ . В
частности, при так называемых нормальных условиях (н.у.), т.е. при температуре 00 C и давлении 1атм (1,01×105 Па ), объем моля любого газа Vμ =22,4л/моль= 22,4 ×10−3 м3 / моль. Это позволяет при помощи формулы (1.6)
найти константу B для одного моля газа, которая обозначается R:
R = |
pVμ |
= |
1,01×105 |
× 22,4 ×10−3 |
× |
Па × м3 |
/ моль |
= 8,31 |
Дж |
|
. |
(1.8) |
|
T |
|
273 |
|
|
моль× |
|
|||||||
|
|
|
К |
|
|
К |
|
||||||
Важно, что согласно закону Авогадро, величина R будет одной и той же для любого газа, поэтому ее называют универсальной газовой постоянной.От уравнения (1.7), записанного для одного моля газа
рVμ =RT, (1.9)
легко перейти к уравнению для любой массы газа m. Если один моль газа имеет объем Vμ , то ν молей при тех же условиях будут иметь объем в ν раз больший:
V=νVμ , т.е. Vμ =V/ν. Подставляя это равенство в формулу (1.7), получим:
рV=νRT, |
(1.10) |
62
причем число молей может быть выражено через массу газа и его молярную массу: ν=m/µ. Таким образом, уравнение состояния для любой массы идеального газа может быть записано в виде:
pV = |
m |
RT . |
(1.11) |
μ |
|||
Это есть обобщенное уравнение Клайперона - Менделеева. |
|
||
1.4.3. Примеры решения задач на уравнение состояния газа
Уравнение состояния газа позволяет найти неизвестные параметры газа в данном состоянии.
|
|
Задача 1 |
||
Вычислить плотность азота при температуре 7° С и давлении 100 атм. |
||||
Дано: |
|
Решение: |
|
|
N2 |
|
Плотность это масса единицы объема р=m/V (*) |
||
p=100 атм=1,01·105 Па |
|
pV=m/µ·Rta, следовательно, V=mRT/(µp) |
||
|
|
подставляя объем в (*), получим: |
||
Т=280°К |
|
|
|
|
|
|
|
|
|
р=? |
|
p= µp/(RT). Осталось определить µ. |
||
|
|
|||
Молекула азота состоит из двух атомов с относительной атомной массой |
||||
14, следовательно (см. стр. |
|
6) µ = 28 ×10−3 кг / моль . Подставляем численные |
||
значения: |
|
|
|
|
р = |
|
1,01×107 × 28кг |
@ 120кг / м3 . |
|
8,31×103 × 280м3 |
||||
|
|
|||
Плотность получилась очень высокой - примерно в десять раз меньше плотности воды, что является следствием большого давления.
Задача 2
Из баллона со сжатым водородом емкостью 10 л вследствие неисправности
вентиля утекает газ. При |
температуре 7°C манометр показывал 5 10 3 н/м2 . |
|||||
Через некоторое время, при температуре 14°C, манометр показал такое же |
||||||
давление. Определить утечку газа, считая газ идеальным. |
|
|||||
Дано: |
|
Решение: |
|
|||
|
Заметим, что объем баллона не меняется: |
|||||
Н2, |
|
|||||
|
V2=V1. |
|
||||
V=10л=10−2 м3 |
|
Запишем уравнение состояния утечки: |
||||
Т1=280К |
|
|
|
|
|
|
р1=5×10 3 Па |
|
p1V1 = |
m1 |
(1) |
||
|
|
|
|
RT1 |
||
|
μ |
|||||
Т2=287К, р2=р1 |
|
и для состояния 2 (после утечки): |
||||
|
|
m2 |
|
|||
|
|
p2V2 = |
(2) |
|||
|
|
|||||
|
|
|
RT2 |
|||
|
μ |
|||||
Поскольку p2=p1 V2=V1 (а значит, и p1V1=p2V2) из (1) и (2) следует:

|
|
|
63 |
|
|
m1 |
|
m2 |
|
T1 |
|
|
RT1 = |
|
RT2 , то есть m2 = m1 |
|
. |
μ |
μ |
T |
|||
|
|
|
2 |
|
|
С другой стороны, масса m1 газа до утечки может быть найдена из (1):
|
|
|
|
m = μ |
|
p1V1 |
. |
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
1 |
|
RT1 |
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
Следовательно, можно найти массу газа, покинувшего баллон m=m1-m2: |
||||||||||||||||||
Dm = m1 |
- m1 |
T |
|
|
|
T |
= μ |
p V |
- |
T |
||||||||
1 |
= m1 1 - |
|
|
1 |
|
1 1 |
1 |
|
1 |
. |
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
T2 |
|
|
|
T2 |
|
RT1 |
|
|
T2 |
||||||
Подставляя данные, получим |
−3 5 ×103 ×10−2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
Dm = 2 ×10 |
7 |
|
|
кг = 1,05 ×10 |
−6 |
кг . |
||||||||||||
|
8,31× 280 |
|
|
287 |
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
1.5. Основное уравнение молекулярно-кинетической теории
Как следует из названия раздела, здесь мы отойдем на время от термодинамического метода и обратим внимание на статистический подход. Задача данного раздела - количественно объяснить давление газа на стенки сосуда как результат совместного действия молекул, составляющих газ. Вы также убедитесь на примере газа, что термодинамический и статистический подходы действительно дополняют друг друга, давая новую информацию. В частности, будет найдена связь средней кинетической энергии молекул газа с температурой.
Физическая модель идеального газа. В разделе 1 был оценен характерный размер d молекулы (на примере воды), который оказался равным 3 ×10−10 м. Там же говорилось, что несжимаемость воды, по-видимому, связана с тем, что молекулы практически касаются друг друга, то есть размер d сравним с расстоянием между центрами молекул. В газах это, по-видимому, не так, поскольку объем может сильно уменьшаться.
Оценим среднее расстояние dср между молекулами газа при нормальных
условиях. Согласно закону Авогадро 1 моль любого газа при нормальных условиях занимает объем 22,4 10 −3 м3 /моль. Значит, на одну молекулу приходится объем в Na раз меньший:
V = |
22,4 ×10−3 |
м3 = 3,7 ×10−26 м3 . |
|
|
|||
1 |
6 |
×1023 |
|
|
|
||
Поскольку V1 dср , получим:
dср = 3  3,7 ×10−28 × м3 @ 3,3 ×10−9 × м
3,7 ×10−28 × м3 @ 3,3 ×10−9 × м
Таким образом, в газе среднее расстояние между молекулами на порядок больше характерного размера молекул: dср/d 10. Это обстоятельство позволяет принять следующую модель идеального газа:

64
1)Газ сильно разрежен, так что собственный объем молекул газа Vмол Nаm/μ V1 существенно меньше объема сосуда, в котором находится газ (Vмол. < V).
2)Силами взаимодействия между молекулами такого разреженного газа можно пренебречь и учитывать взаимодействие только при столкновении молекул.
3)Столкновения молекул газа между собой и со стенками сосуда являются абсолютно упругими (молекулы - упругие шарики).
4)Молекулы газа совершают беспорядочное тепловое движение, т.е. направления скоростей ориентированы в пространстве совершенно беспорядочно. Это означает, что в каждом направлении в данный момент движется одинаковое число молекул, т.е. N/6, где N - полное число молекул газа (N/3 молекул движется параллельно каждой из осей координат, причем половина из них движется в положительном направлении, а другая - в противоположную сторону).
Давление молекул на стенку сосуда. Давление согласно
определению равно силе, с которой газ воздействует на площадку единичной площади, перпендикулярно площадке:
p = F , S
где S - площадь плоской площадки, например стенки сосуда.Величина суммарной силы воздействия молекул на площадку по III закону Ньютона равна суммарной силе, действующей на систему молекул со стороны площадки. Следовательно, сила может быть найдена по II закону Ньютона для системы материальных точек:
|
F = |
P , |
|
|
t |
где P - суммарное изменение импульса всех молекул, сталкивающихся за время |
||
t с площадкой |
S. |
|
Для того, |
чтобы вычислить P, |
необходимо, во-первых, знать число |
молекул N', которые ударяются о площадку за малое время t, и, во-вторых, изменение импульса каждой молекулы.
Если молекула массы m0 налетает в направлении, перпендикулярном площадке, со скоростью υ, то в результате абсолютно упругого удара с тяжелой площадкой (масса сосуда много больше массы молекулы) молекула отскочит с такой же скоростью в противоположном направлении (это известно из механики). То есть изменение импульса одной молекулы равно:
P1 = m0υ − (−m0υ) = 2m0υ .
Теперь необходимо вычислить число молекул N'. Сколько молекул столкнутся с площадкой за время t? Это будут все молекулы, расположенные
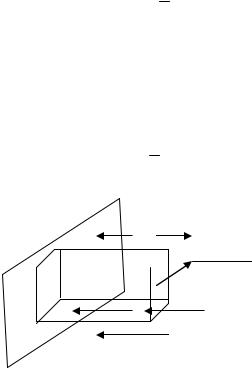
65
в объеме V и летящие в направлении, перпендикулярном площадке. Значит, это составит 1/6 от всех молекул, содержащихся в объеме V:
N ¢ = 1 nDV ,
6
где n - концентрация молекул газа, т.е. число молекул в единице объема.
Чем определяется объем V? Это тот объем, из которого молекулы, движущиеся в сторону площадки, успевают ее достичь за время t (см. рис.1.6). Значит, высота равна υΔt, а основание - S, что позволяет определить V= S υΔt и записать выражение для числа столкновений:
N ¢ = 1 nDSυDt .
6
υΔt  S
S
Рис. 1.6. Объем V, из которого молекулы достигают площадки за время t
Поэтому P=2m υt N'= |
1 |
nm υ 2 |
× DS × Dt и окончательно получим: |
||||||
|
|||||||||
0 |
3 |
|
0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
p = |
F |
= |
P |
= |
1 |
nm υ 2 . |
||
|
|
Dt × DS |
|
||||||
|
|
|
DS |
|
3 |
0 |
|||
|
|
|
|
|
|
|
|
|
|
Таким образом, мы получили формулу:
|
|
|
p = |
1 |
|
nm υ 2 . |
(1.12) |
|
|
|
|
|
|||||
|
|
|
3 |
0 |
|
|||
|
|
|
|
|
|
|
||
Используя понятие средней кинетической энергии теплового движения |
||||||||
молекул ε = |
1 |
m υ 2 |
, уравнение (1.12) можно записать в виде: |
|
||||
|
|
|||||||
2 |
0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
p = |
2 |
nε . |
(1.13) |
||
|
|
|
|
|||||
|
|
|
|
|
3 |
|
|
|
Это есть основное уравнение молекулярно-кинетической теории идеального газа,} которое означает:
давление в газе пропорционально средней энергии теплового движения молекул и числу молекул в единице объема.
1.6. Замечание о средней квадратичной скорости. Распределение Максвелла молекул по скоростям
66
Выше мы говорили о средней энергии теплового движения молекул. Дело в том, что молекулы движутся неупорядоченно, т.е. их скорости имеют не только случайные направления, но и величину. Спрашивается: какой смысл имеет величина υ2, если разные молекулы имеют разные значения скорости?
Если газ содержит N молекул и занимает объем V, то концентрация молекул равна n=N/V. Предположим, что N1 молекул имеют величину скорости, равную υ1, N2 молекул - скорость υ2 …N k молекул - значение скорости υk. Естественно, что N1 + N2 + … +Nk =N. В таком случае число молекул первой
группы N1', достигающих площадки |
|
|
S за время t, будет равно: |
|
|
|
|
|
||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
′ |
|
1 N1 |
|
υ1 S t . |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
N1 = |
|
6 V |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
Та же величина для молекул второй группы будет |
|
′ |
= |
1 |
N |
2υ |
2 S |
t / 6 , и так |
||||||||||||||||||||||||||||||||||||||
|
|
|
||||||||||||||||||||||||||||||||||||||||||||
|
|
|
||||||||||||||||||||||||||||||||||||||||||||
|
N 2 |
6 |
||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
далее |
|
до молекул |
|
k-й |
группы, |
из |
|
которых |
достигнет |
площадки |
за время |
|||||||||||||||||||||||||||||||||||
′ |
1 |
N kυk S t / 6 |
. Изменение импульса молекулы каждой группы также будет |
|||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||
tN k = |
6 |
|||||||||||||||||||||||||||||||||||||||||||||
различным: 2 m0υ1, 2 m0υ2, …, 2 m |
0υк. Поэтому суммарное изменение импульса |
|||||||||||||||||||||||||||||||||||||||||||||
следует записать в виде суммы: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
′ |
|
′ |
|
|
|
|
|
|
|
|
|
|
′ |
|
1 m0 |
|
|
|
2 |
|
|
|
|
|
2 |
|
|
2 |
|||||||||
P = |
P1 + P2 + ... + |
|
|
|
|
|
2 N |
|
|
|
|
|
|
|
|
|
|
= |
|
|
|
|
|
|
|
(N1υ1 |
+ N 2υ2 |
+ ... + N kυk ) t , |
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||
Pk = 2m0 (υ1 N1 + υ |
2 |
+ ... + υk N k ) |
3 V |
|
|
|||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
то есть вместо формулы (1.12) получим выражение: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||
|
|
|
|
|
|
p = |
1 |
|
m0 |
[N υ |
2 |
+ N υ 2 |
+ ... + N |
υ |
|
2 ]. |
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
k |
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||
|
|
|
|
|
|
|
3 V |
1 1 |
|
|
|
|
|
|
2 2 |
|
|
|
|
|
|
|
k |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
Учитывая, что n=N/V и сравнивая полученное выражение с формулой |
||||||||||||||||||||||||||||||||||||||||||||||
(1,12), придем к выводу, что под υ2 следует понимать сумму: |
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||||||
|
|
|
|
|
N υ 2 |
+ N υ 2 + ... + N |
k |
υ |
k |
2 |
|
|
N |
1 |
|
2 |
|
|
|
N |
2 |
|
2 |
|
|
|
N |
k |
|
|
2 |
|
|
|||||||||||||
|
|
|
(υкв ) 2 = |
1 1 |
2 2 |
|
|
|
|
|
|
|
= |
|
|
υ1 |
+ |
|
|
|
υ2 |
|
+ ... + |
|
|
|
υk |
. |
(1.14) |
|||||||||||||||||
|
|
|
|
|
|
|
|
N |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
N |
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
N |
|
|
|
|
|
N |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
Таким образом, при упрощенном выводе формулы (1.12) мы заменили реальные скорости частиц некоторой средней скоростью, которая согласно только что полученной формуле является средней квадратичной скоростью, квадрат которой равен среднему арифметическому квадратов скоростей всех молекул газа. В частности, если имеется только 2 молекулы, движущиеся со скоростями υ1 и υ2 (k=2, N1=N2=1, N=2), υ2=(υ21+υ22)/2.
Средняя энергия теплового движения молекул равна кинетической
энергии молекулы, движущейся со средней квадратичной скоростью.
В действительности молекулы могут иметь не дискретные, а непрерывные
значения скоростей. Следовательно, в реальности число групп k молекул,
имеющих разные скорости, бесконечно велико k→∞. В этом случае

67
относительные доли числа молекул N1/N, N2/N, …, имеющих соответствующие
скорости, следует заменить аналогичной величиной dF(υ):
υ = dN (υ) dF ( ) ,
N
которая равна числу молекул, имеющих величину модуля скорости большую υ-dυ, и меньшую υ+dυ, деленную на полное число частиц. Понятно, что чем больше величина dυ, тем больше dF(υ): dF(υ)=f(υ) dυ, где f(υ) - функция, характеризующая распределение молекул по величине скорости.
С учетом сказанного формула (1.14) в этом случае может быть переписана в виде (сумма преобразуется в интеграл):
(υкв ) 2 = |
1 |
∫ |
υ 2 × dN (υ) = |
∫ |
υ 2 × dF (υ) = |
∞ υ 2 × f (υ) × dυ , |
(1.15) |
|
N |
||||||||
|
|
|
∫0 |
|
причем интегрирование проводится по всем возможным значениям модуля скорости.
В случае идеального газа, находящегося в тепловом равновесии, функция f(υ) была получена Дж.. Максвеллом и имеет вид:
|
μ |
|
3 / 2 |
|
|
μυ 2 |
|
|
|
|
|
|
|
|
|
2 |
|
||
f (υ) = 4π |
|
|
|
- |
×υ |
|
, |
||
|
|
exp |
|
|
|||||
|
2πRT |
|
|
|
2RT |
|
|
|
|
где μ - молярная масса газа, а T - равновесная температура. Таким образом, величина (υкв)2 для одноатомного идеального газа определится значением интеграла2
|
|
|
|
|
μ |
|
3 / 2 |
∞ |
|
|
|
|
μυ 2 |
|
3RT |
|
(υ |
кв ) |
2 |
= 4π |
|
|
∫0 |
υ |
4 |
|
- |
|
× dυ = |
|
. |
||
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
× exp |
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
μ |
|
||||
|
|
|
|
|
2πRT |
|
|
|
|
|
|
2RT |
|
|
||
Таким образом, средняя квадратичная скорость молекул одноатомного газа равна:
υкв = |
3RT |
. |
|
||
|
μ |
|
Далее мы получим этот результат элементарными методами, что показывает справедливость упрощенного подхода, примененного при выводе основного уравнения молекулярно-кинетической теории.
Сопоставление с уравнением Клайперона - Менделеева.
Воспользовавшись тем, что концентрация молекул n=N/V, основное уравнение молекулярно-кинетической теории можно записать в виде:
pV = 2 Nε .
3
Сравнивая это выражение с уравнением состояния идеального газа (1.11), приходим к выводу, что:
2 при вычислении интеграл можно преобразовать к интегралу Пуассона
∫0∞ exp(-aυ 2 ) × dυ = 1/ 2
 π / a
π / a

68
ε= 3 m RT .
2 μ N
Сдругой стороны, число молекул газа можно выразить через число молей
ичисло Авогадро: N=νNа= mμ Nа. Поэтому для средней кинетической энергии
молекул получим формулу:
ε = |
3 |
|
RT |
. |
(1.16) |
|
|
||||
2 |
|
N a |
|
||
Напомним, что согласно формуле (1.8), универсальная газовая постоянная R относится к одному молю газа, содержащему Nа молекул. Из последнего выражения видно, что удобно ввести новую постоянную k, представляющую собой универсальную газовую постоянную в расчете на одну молекулу:
k = |
R |
= 1,38 |
×10 |
−23 |
Дж |
(1.17) |
N a |
|
К |
||||
|
|
|
|
|
Фундаментальная постоянная k называется постоянной Больцмана. Теперь формулу (1.16) можно записать в виде:
ε = |
3 |
кТ . |
(1.18) |
|
|||
2 |
|
|
|
Интересно, что средняя кинетическая энергия молекул газа определяется только температурой газа. Следовательно, если два газа имеют молекулы разной массы, то среднеквадратичная скорость больше у газа с более легкими молекулами.
В заключение данного пункта приведем альтернативную форму уравнения состояния идеального газа, которую можно получить, если в уравнении (1.11) заменить универсальную газовую постоянную, воспользовавшись выражением (1.17):
р=nkT. |
(1.19) |
Такое же соотношение получится, если подставить величину ε из формулы (1.18) в основное уравнение молекулярно-кинетической теории.
1.7. Закон равнораспределения энергии по степеням свободы. Внутренняя энергия идеального газа
Как было показано ранее, средняя кинетическая энергия ε поступательного движения молекулы идеального газа может быть выражена через среднюю квадратичную скорость υ:
ε = m0υ 2 . 2
С другой стороны, квадрат любого вектора можно представить как сумму квадратов его координат:
υ2=υ2x+υ2y+υ2z.
Беспорядочность движения по всем направлениям означает, что должно быть: υ2x=υ2y=υ2z . Следовательно,
υ2x=υ2y=υ2z=υ2/3

69
С другой стороны, величины m0υ2x/2, m0υ2y/2, m0υ2z/2 представляют собой энергию поступательного движения вдоль каждой из трех осей координат или энергию, приходящуюся на одну степень свободы.
Числом степеней свободы называется число независимых координат,
которые необходимо задать для определения положения тела в пространстве.
Положение материальной точки в пространстве определяется тремя координатами - 3 степени свободы. Для того, чтобы задать положение гантельки (т.е. тела, состоящего из двух жестко связанных материальных точек), необходимо задать положение ее центра масс (три координаты) и еще два угла, которые составляет ось гантельки с двумя из осей координат (угол с третьей осью координат не является независимым) - 5 степеней свободы. В общем случае несимметричное твердое тело имеет 6 степеней свободы.
В случае поступательного движения молекул газа, как мы уяснили, на каждую степень свободы приходится 1/3 общей энергии молекулы, т.е.
ε 0 = 1 kT .
2
Если молекула состоит из двух и более атомов, полное число степеней свободы i увеличивается:
i=iпост+iвр.
При этом в тепловом равновесии на каждую степень свободы по- прежнему будет приходиться энергияε0 . Таким образом, с учетом возможности вращательного движения сложных молекул средняя энергия ε движения одной молекулы равна:
ε = ε |
|
× i = |
i |
kT , |
i=i |
+i |
|
. |
0 |
|
вр |
||||||
|
2 |
|
пост |
|
|
|||
|
|
|
|
|
|
|
||
Из сказанного ясно, что энергия движения двухатомных молекул равна 5kT/2 (iвр=2), а трех и более атомных молекул - 3kT (iвр=3).
Внутренняя энергия идеального газа. Как уже говорилось, расстояние между молекулами газа при нормальных условиях примерно в 10 раз больше характерного размера молекул. Это означает, что молекулы находятся далеко друг от друга и силой взаимодействия между ними, а следовательно энергией их взаимодействия, можно пренебречь. Именно такая модель невзаимодействующих молекул соответствует идеальному газу.
Внутренняя энергия идеального газа представляет собой суммарную
кинетическую энергию всех молекул данной массы газа.
Средняя кинетическая энергия одной молекулы равна <ε0>=ikT/2, где i - число степеней свободы:
i=3 - для газов, молекулы которых состоят из одного атома и не имеют вращательных степеней свободы (это имеет место для всех инертных газов, например He;
i=5 - для O2, N2, H2 и большинства других простых газов, имеющих двухатомные молекулы;
70
i=6 - для CO2, паров воды H2O) и других газов, имеющих трех-и более атомные молекулы.
Поскольку в одном моле газа содержится Nа молекул, внутренняя энергия одного моля газа равна:
U μ |
= N a ε 0 = iN a |
kT |
= |
iRT |
. |
(1.20) |
2 |
|
|||||
|
|
2 |
|
|
||
Если масса газа равна m, это составляет n=m/m молей. Следовательно, внутреняя энергия Um массы m газа определится формулой:
U m |
= νU μ = |
m |
× |
iRT |
. |
(1.21) |
|
|
|||||
|
|
μ 2 |
|
|||
Важно! Внутренняя энергия идеального газа зависит только от температуры и не меняется при изменении объема и давления (если при этом
T=const).
В случае других веществ и реальных газов (сжатые до p=100 атм. и более при комнатной температуре газы) ситуация другая. Поскольку концентрация молекул n=p/(kT) возрастает с ростом давления, то объем V1=1/n, приходящийся на одну молекулу, становится сравнимым с объемом самой молекулы. Молекулы сильно сближаются и становится существенной энергия взаимодействия между ними (потенциальная энергия). В этих условиях внутренняя энергия будет зависеть и от расстояния между молекулами, т.е. от объема газа.
1.8. Примеры решения задач
Задача 1
Найти число молекул в 1 см3 газа, находящегося при t=27оC под давлением
10-12 атм.
|
|
|
Решение: |
|
Дано: |
|
|
|
|
V=1 см3=10-6м3 |
N=n×V, n- концентрация |
|||
р=10-12атм=10-7Па |
||||
Т=27 |
о |
С=300К |
Согласно 1.19 n=p/(kT). |
|
|
Подставляя данные получим: |
|||
N=? |
||||
|
||||
|
|
|
n=10-7/(1,38×10-23×300) м-3=2,45×1013м-3 |
|
Окончательный ответ будет: N=2,45×1013×10-6=2,45×10-7 молекул. |
||||
|
|
|
Задача 2 |
|
Определить внутреннюю энергию а)водорода (H2), б)гелия (He), в)углекислого газа (CO2) находящегося в 1см3 в состоянии, соответствующем предыдущей задаче.
Решение:
Заметим, что число молекул N в заданном объеме, полученное в предыдущей задаче, не зависит от вида газа.
