
- •Содержание
- •I. Спектроскопические методы анализа Фотометрический метод анализа сточных и природных вод
- •Сущность фотоколориметрического метода анализа
- •Лабораторная работа № 1 Определение железа в природных водах с сульфосалициловой кислотой
- •Порядок выполнения работы
- •Обработка результатов и оформление работы
- •Лабораторная работа № 2 Определение хрома в сточных водах
- •Лабораторная работа № 3 Определение меди в сточных и природных водах аммиачным методом
- •II. Спектрофотометрия
- •Теоретическая часть
- •Лабораторная работа № 4 Определение остаточного мономера в полимерах, используемых для изготовления контактных линз
- •Порядок выполнения работы
- •1. Назначение органов управления и индикации
- •2. Включение спектрофотометра
- •2.1. Закрыть фотоэлемент, установив рукоятку 49 переключения шторки в положение закр и переключателем 21 установить ширину щели 0,15 нм.
- •2.5. Выключение спектрофотометра производить нажатием кнопки сеть.
- •II. Порядок работы
- •1. Подготовка к измерению
- •1.5. Перед каждым новым измерением, когда неизвестна величина выходного напряжения, следует устанавливать ширину щели 0,15 нм во избежание засвечивания фотоэлементов.
- •1.6. Снимать показания следует при плотно закрытой крышке кюветного отделения.
- •2. Измерение оптической плотности
- •2.1. Установить рукоятку 49 в положение закр.
- •III. Электрохимические методы анализа Ионоселективные электроды и их применение
- •Лабораторная работа № 5
- •Опыт 2. Определение рН вытяжки из почвы
- •Опыт 3. Ионометрическое определение содержания нитрата в вытяжке из почвы (или в водном растворе)
- •1.1. Сорбенты, применяемые в тсх.
- •1.2. Аналитическая тсх
- •1.2.2. Условия проведения эксперимента
- •1.2.3. Материалы и приборы
- •1.2.5. Количественное определение методом тсх
- •1.2.5.1. Полуколичественный анализ
- •1. Корень квадратный из площади пятна анализируемого вещества;
- •2. Lg концентрации анализируемого вещества;
- •3. Опорные точки на калибровочном графике
- •1.3. Распределительная хроматография на бумаге
- •2.2. Лабораторная работа № 7. Разделение железа (III) и меди (II) с помощью хроматографии на бумаге
- •Список литературы
- •Методы и приборы контроля окружающей среды
- •450078, Г. Уфа, ул. Чернышевского, 145; тел. (347) 278-69-85.
III. Электрохимические методы анализа Ионоселективные электроды и их применение
Цель работы: ознакомление с потенциометрическим методом анализа и определение содержания различных катионов и анионов в объектах окружающей среды с использованием ионоселективных электродов.
Подобно определению величины рН, представляющей собой десятичный логарифм активности иона водорода, взятый с обратным знаком рН = – lg aн, рассчитывают и логарифмы активности других ионов, обозначая их через рХ (р – начальная буква слов Potens или power – показатель). Таким образом, рХ = – lg ax, X - К+, Na+, NH+4, Mg2+ или NO–3, Cl–, F– и др.; ах – активности этих ионов в растворах.
Измеряют рХ при помощи электронных систем с ионоселективными индикаторными электродами.
 Ионоселективными
(ионообменными) или мембранными называют
электроды, на межфазных границах которых
происходят ионообменные реакции. Для
определения активности иона в растворе
рХ используют два электрода, из которых
один ионоселективный, а другой – электрод
сравнения. Потенциал ионоселективного
индикаторного электрода по отношению
к
электроду сравнения зависит от активности
определяемого иона в растворе и
описывается уравнением Нернста.
Ионоселективными
(ионообменными) или мембранными называют
электроды, на межфазных границах которых
происходят ионообменные реакции. Для
определения активности иона в растворе
рХ используют два электрода, из которых
один ионоселективный, а другой – электрод
сравнения. Потенциал ионоселективного
индикаторного электрода по отношению
к
электроду сравнения зависит от активности
определяемого иона в растворе и
описывается уравнением Нернста.
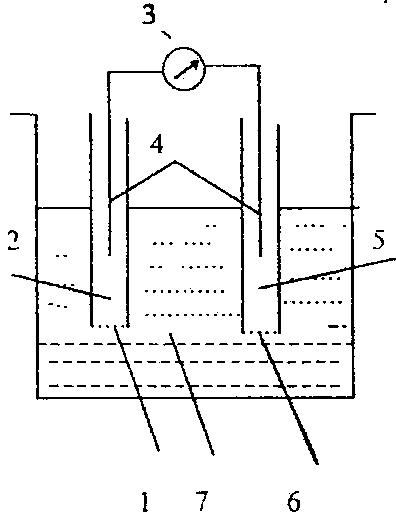
Рис. 1 Схема ячейки с ионоселективными электродами:
1 – ионоселективная мембрана; 2 – ионоселективный электрод;
3 – вольтметр; 4 – вспомогательный (хлорсеребряный) электрод;
5 – электрод сравнения; 6 – жидкостный контакт; 7 – исследуемый раствор
Мембрана ионоселективного электрода (рис. 1) проницаема только для определенного вида ионов. Поэтому при диффузии через нее возникает электродный потенциал, устанавливается электрохимическое равновесие, препятствующее дальнейшему проникновению ионов во внутренний раствор. Но равновесный потенциал ионоселективного электрода зависит от активности определяемого иона в растворе. Поэтому достаточно измерить потенциал ионоселективного электрода (с помощью хлорсеребряного электрода сравнения), чтобы найти активность (рХ) иона в растворе.
В настоящее время промышленность выпускает ионоселективные электроды различного назначения. Среди них различают стеклянные; твердые электроды (с гомогенной или гетерогенной мембраной); жидкостные электроды на основе жидких компонентов, анионитов или хелатов и др.
Используя ионоселективные электроды, определяют активность ионов в растворах – рН, рК, pNa, pNH4, pMg, pNO3, pCl, pF, активности других ионов, а также изучают окислительно-восстановительный потенциал различных сред (почвы, растительного материала и т.п.).
Лабораторная работа № 5
Опыт 1. Определение рН раствора на иономере ЭВ-74
До начала измерения переключатель иономера установите в положение «t» и «-1-19». Включите иономер в сеть и прогрейте его 30 минут.
Слегка приподнимите стаканчик с электродами, отодвиньте столик, промойте электроды дистиллированной водой из промывалки. Остатки воды с электродов удалите фильтровальной бумагой.
Ход определения. Получите у преподавателя испытуемый раствор, налейте его в стаканчик иономера (до половины объема) и погрузите в него электроды.
После этого последовательно нажмите кнопки прибора «Катионы, анионы», «рХ» и «-1-19».
Заметьте положение стрелки на шкале «-1-19» показывающего прибора и нажмите кнопку соответствующего диапазона. Если показание по шкале «-1-19» оказалось между цифрами 8-9, то следует нажать кнопку диапазона 4-9.
Запишите показание стрелки иономера по шкале «0-5» и прибавьте к нему начальную цифру выбранного диапазона. На этом определение величины рН испытуемого раствора закончено.
Электроды до следующего определения оставьте в дистиллированной воде. Выключите иономер из сети.
