
- •1Закон Кулона
- •4Электрические поля систем зарядов. Электрический диполь
- •5 Электрический потенциал
- •6Связь между потенциалом и напряженностью
- •7. Безвихревой характер электростатического поля
- •2.4 Электрический ток в электролитах газах и вакууме
- •11.1 Диэлектрики в электрическом поле
- •11.3. Электреты. Пьезоэлектрики.
- •11.4. Сегнетоэлектрические кристаллы.
- •12. Энергия системы зарядов и электрического поля
- •1.12.1. Электрическая емкость. Конденсаторы
- •12.2. Энергия взаимодействия электрических
7. Безвихревой характер электростатического поля
И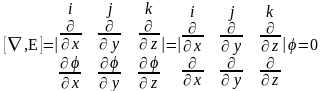 з
условия E
= -Ñφ
следует одно важное соотношение, а
именно величина векторного произведения
[Ñ,E]
для стационарных электрических полей
всегда равна нулю. По опредедению,
поскольку определитель содержит две
одинаковые строки. Величина [Ñ,E]
называется ротором или вихрем и
обозначается как rotE.
з
условия E
= -Ñφ
следует одно важное соотношение, а
именно величина векторного произведения
[Ñ,E]
для стационарных электрических полей
всегда равна нулю. По опредедению,
поскольку определитель содержит две
одинаковые строки. Величина [Ñ,E]
называется ротором или вихрем и
обозначается как rotE.
Мы получаем важнейшее уравнение электростатики rotЕ = 0.
 Электростатическое
поле - безвихревое поле. Работа при
перемещении заряда по любому замкнутому
пути в электростатическом поле равна
нулю.
Электростатическое
поле - безвихревое поле. Работа при
перемещении заряда по любому замкнутому
пути в электростатическом поле равна
нулю.
2.4 Электрический ток в электролитах газах и вакууме
Вещества, проводящие ток и разлагающиеся при этом, называются проводниками второго рода или электролитами.
Процесс разделения веществ электрическим током – электролизом.К электролитам относятся растворы кислот, щелочей и солей как в воде, так и в других растворителях.
Носителями тока при электролитической проводимости являются ионы. Расщепление молекул на ионы производится под действием растворителя – электролитическая диссоциация
Напряженность электрического Е заставляет ионы с отрицательным зарядом (анионы) передвигаться к аноду, с положительным зарядом (катионы) – к катоду.На электродах ионы нейтрализуются:
анионы отдают аноду свои избыточные электроны, которые переходят во внешнюю металлическую цепь и движутся к катоду; катионы приобретают у катода недостающие электроны.
Нейтрализация ионов на поверхности электродов – необходимое звено в прохождении тока через гальваническую цепь.
Прямым следствием процесса электролиза: накопление у электродов продуктов химического разложения электролита.
Количество выделяющихся веществ при электролизе на электродах определяется законами Фарадея.
Первый закон Фарадея: при электролизе за время t на электродах выделяются количества вещества m, пропорциональные количеству электричества q, прошедшего за это время:
m = kq.
k - электрохимический эквивалент, равный количеству выделенного вещества на электроде при прохождении через электролит единицы количества электричества F. Этот заряд носит название фарадей, F = 96485 Кл, универсальная константа
Второй закон Фарадея: при прохождении тока последовательно через несколько электролитов количество выделенного вещества за время t в разных электролитах пропорционально химическому эквиваленту этих веществ.
Химический эквивалент равен M/z, где М – атомный или молекулярный вес ионов, z – валентность иона.
В торой
закон Фарадея выражается уравнением:
торой
закон Фарадея выражается уравнением:
Соединяя оба закона Фарадея: количества выделяющего веществ при электролизе на электродах равно m=(M/z*F)g-заряд (ку) m=(M/z*F)it. В случае нейтрализации на электродах одновалентных ионов при прохождении через электролит заряда в 1 фарадей на электродах выделяется 1 моль вещества.
Концентрацию растворов принято измерять числом химических эквивалентов, содержащихся в 1 л.
Раствор, содержащий 1 химический эквивалент в литре, называют нормальным раствором электролита.
Если в литре раствора содержится 0,01 химического эквивалента, то говорят, что концентрация раствора равна 0,01 нормального (это кратко обозначают так: 0,01N).
Энергия источника тока при электролизе тратится:на перемещение ионов в электролите;на разрядку ионов на электродах. Затраченная энергия на перемещение ионов превращается в тепло, а на разрядку ионов - в химическую энергию полученных при электролизе продуктов.
Электролиз соли начинается с определенного напряжения, потенциала разложения; если напряжение ниже, ток через раствор не протекает. Для быстрого протекания электролиза напряжение должно значительно превышать потенциал разложения, при этом избыточная электроэнергия обращается в тепло.Электролиз при напряжении, вдвое превышающем потенциал разложения:50% энергии идёт на химическую работу, 50% превращается в тепло.
При электролизе главную роль играют явления, происходящие на поверхности электродов. Ионы не способны проникнуть в металл, как и электроны перейти в раствор.
Движение тех и других останавливается на поверхности электрода, здесь происходит их взаимная нейтрализация.
Электролиз имеет широкое применение: Гальванотехническое оцинкование, никелирование, хромирование изделий из железа, многих деталей в машиностроении.
Гальванические элементы
При погружении металла в электролит наблюдается их взаимная электризация,между ними возникает контактная разность потенциалов: металл заряжается отрицательно, жидкость – положительно.
Это объясняется способностью металлов переходить в раствор в виде ионов – электролитической упругостью растворения металлов.
Электроны атомов металла остаются в исходном металле и сообщают ему отрицательный заряд:
Zn ® Zn2+ + 2e-
(переходит в раствор) (остаются в металле)
Вдоль поверхности металлической пластинки образуется двойной электрический слой из электронов и ионов.
Металл и раствор представляют собой полуэлемент.
Наличие разности потенциалов в «полуэлементе» не обеспечивает электрического тока, заряды в нём находится в состоянии равновесия.
Напряжение определяется химической природой электродов, электролитических растворов и концентрацией растворов и находится на уровне » 1,1 В.
Аккумуляторы
Процессы в аккумуляторе и гальваническом элементе имеют обратное направление.
Электромотор – поглотитель энергии.
Генератор – источник электроэнергии.
Обратный разрядному ток через гальванический элемент восстанавливает химические вещества, которые обеспечивают действие элемента (зарядка элемента).
На этом основано действие аккумуляторов.
Аккумуляторы – те же гальванические элементы, но в них электроды и электролиты подобраны с таким расчетом, чтобы легко достигалась обратимость.
Аккумуляторы можно вновь заряжать (восстанавливать) током.
На практике наибольшее распространение имеют свинцовые (кислотные) аккумуляторы.
Свинцовый аккумулятор в незаряженном виде состоит из свинцовых пластин в виде решеток; отверстия замазывают тестом из окиси свинца PbO и воды.
Для «формовки» электродов их погружают в раствор серной кислоты и пропускают ток.
Окись свинца превращается в недоокисную соль серной кислоты Pb2SO4 (являющуюся неустойчивым соединением).
При зарядке аккумулятора пластины присоединяют к противоположным полюсам источника тока, происходит электролиз.
На катоде Pb2SO4 водородом восстанавливается в губчатый металлический свинец,
на аноде Pb2SO4 кислородом превращается в пористый слой перекиси свинца Pb2O5.
При разрядке аккумулятора все процессы происходят в обратном направлении.
Затраченная при зарядке энергия возвращается в виде электрического тока.
Эти процессы можно представить следующей формулой:
Pb2SO4 + Н2 + 2PbO2 Pb2 + H2SO4 + Pb2O5
При разрядке аккумулятора концентрация серной кислоты понижается.Степень разрядки контролируется по удельному весу раствора серной кислоты в аккумуляторе.
Свинцовые аккумуляторы обеспечивают ~ 20 А-ч на каждый килограмм веса аккумулятора, это соответствует запасу электроэнергии на каждый килограмм веса аккумулятора ~ 35¸40 Вт-ч.
Топливный элемент
Топливной элемент - устройство прямого преобразования химической энергии в электрическую.
Топливные элементы имеют два важных отличия от аккумуляторов: 1) они функционируют до тех пор, пока топливо и окислитель поступают из внешнего источника; 2) химический состав электролита в процессе работы не изменяется, т.е. топливный элемент не нуждается в перезарядке.
Процессы топливном элементе по своей природе является обратным процессу электролиза
Топливный элемент состоит:
из двух электродов и электролита; систем подвода топлива (водорода) на один электрод и окислителя (О2) на другой; системы для удаления продуктов реакции;катализаторов - для ускорения химической реакции.
В топливном элементе с кислым электролитом водород подается через полый анод.
На аноде происходит разложение молекул водорода на атомы.
Атомы Н в результате хемосорбции отдают свои электроны и превращаются в положительно заряженные ионы.
Этот процесс описывается следующими уравнениями:
2Н2 4Н 4Н 4Н+ +4е-
Ионы водорода диффундируют через электролит к катоду, электроны – во внешнею цепь.
Подаваемый кислород на катод переходит в электролит.
При соединении О2 с ионами водорода и электронами, поступающими из внешней цепи, образуется вода:
О2 +4Н+ + 4е- 2Н2О
Поток электронов и ионов водорода поддерживает баланс заряда и вещества в электролите
Поток электронов во внешней цепи представляет собой постоянный ток.
Реакции в топливных элементах обеспечивают ЭДС около 1 В.
Размыкание цепи или прекращение движения ионов останавливает работу топливного элементВ описанном элементе водород и кислород переходят в электролит через микропористые углеродные или металлические электроды.
Высокая плотность тока достигается в элементах, работающих при повышенной температуре (около 250 °С) и высоком давлении. Элементы с ионообменными мембранами, способные работать на водороде и кислороде при нормальных температуре и давлении В этих элементах вместо жидкого электролита между электродами располагается полимерная мембрана, через неё свободно проходят ионыВ таких элементах наряду с кислородом используется воздух. Образующаяся при работе вода не растворяет электролит и может быть легко удалена.
Несамостоятельный газовый разряд
Газы в нормальном состоянии электрически нейтральны. Они состоят из незаряженных атомов, молекул и не проводят электрический ток. Ток проводят ионизованные газы, (часть атомов потеряли внешние электроны и превратилась в положительные ионы). Электрический ток в газах называют газовым разрядом. Ионы в газах возникают при нагреве, под действием света, излучения, электрических полей (внешние ионизаторы). Минимальная энергия, необходимая для удаления из нейтрального атома электрона, называется энергией ионизации. Энергия ионизации обычно выражается в эВ. Плотность электрического тока между пластинами равна:
j = en+u+ + en-u-.Скорости направленного движения зарядов u пропорциональны напряженности электрического поля:
u± = b±E,
где b± - подвижность ионов.
Численно b равна скорости направленного движения зарядов в поле единичной напряженности. Размерность [b] = m2/B*c
Плотность тока
j = en(b+ + b-)E - закон Ома для тока в газе при несамостоятельном разряде.
В слабых электрических полях закон Ома хорошо выполняется, j ~ E (кривая ОС, рис.). C увеличением E все ионы будут достигать пластин конденсатора. Плотность тока достигает насыщения и далее не зависит от Е (участок ВС).
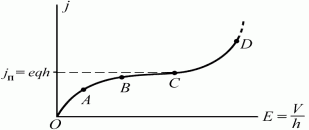
Если убрать внешний ионизатор, ток между пластинами прекращается.Такой разряд получил название несамостоятельного газового разряда (кривая ОС).
