
Лабораторная работа № 3
Тема: Определение кислотности почвы потенциометрическим методом
Теория. Кислотно-основные свойства (реакция среды) почвы имеют важное генетическое и агротехническое значение. Они определяют интенсивность внутрипочвенного выветривания, подвижность химических элементов и соединений, биологическую активность почвы, трансформацию органического вещества. Для выращивания сельскохозяйственных растений важно соответствие реакции среды почвенного раствора диапазону оптимальных значений рН, который различен для разных видов. Важен учет кислотно-основных свойств почв для эффективного использования удобрений, которые сами могут быть факторами изменений рН почвенного раствора.
Кислотность почв - это способность почвы подкислять почвенный раствор имеющимися в почве кислотами и обменно-поглощенными катионами водорода, а также алюминия, способного при вытеснении из ППК образовывать гидролитически кислые соли.
Внешним источником подкисления почв могут быть атмосферные осадки, содержащие растворы кислот (угольной, серной, азотной), особенно в промышленных районах. При разложении растительных остатков, поступающих на почву, образуются органические кислоты, особенно это характерно для лесного (в большей степени хвойного) опада.
В почвах имеются также внутренние источники кислотности:
- корни и микоорганизмы образуют при дыхании СО2, который растворяется в почвенном растворе с образованием угольной кислоты;
- Н+ выделяется в процессе разложения органического вещества почвы в результате минерализации, нитрификации и выщелачивания;
- органические кислоты, которые выделяются из растительности, органического вещества почвы и корней растений;
- корни выделяют Н+ и ОН–, чтобы их поверхность оставалась электронейтральной в ходе поглощения ионов питательных веществ. Таким образом, корни могут быть источниками кислот и оснований;
- педогенные минералы являются кислыми, выделяя Н+ в ходе их растворения почвенной водой;
- уничтожение естественной растительности вызывает ускоренное разложение органического вещества, вымывание нитратов и развитие кислотности;
- в процессе нитрификации аммонийных удобрений образуются ионы Н+.
Различают актуальную (активную, реальную) и потенциальную (пассивную, резервную).
А к т у а л ь н а я к и с л о т н о с т ь обусловлена наличием свободных ионов водорода в почвенном растворе. Она определяется в водной вытяжке (при соотношении почва: вода 1 : 5 или 1: 2,5). Актуальную кислотность определяют как для кислых, так и для щелочных почв. Обозначают символом рН (Н2О).
П о т е н ц и а л ь н а я к и с л о т н о с т ь обусловлена ионами водорода и алюминия, находящимися в обменно-поглощенном состоянии в ППК. По способу определения ее подразделяют на обменную и гидролитическую.
О б м е н н а я к и с л о т н о с т ь - это та часть потенциальной кислотности, которая определяется при взаимодействии с почвой 1 н. раствора гидролитически нейтральной соли KCI (рН 5,6). При этом взаимодействии ионы Н+ и Al3+ в ППК замещаются ионом К+:
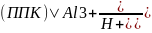 + 4KCl
↔ (ППК)4К + AlCl3
+ HCl
+ 4KCl
↔ (ППК)4К + AlCl3
+ HCl
AlCl3 + H2O ↔ Al(OH)3 + 3HCl
Обменная кислотность характеризуется величиной pH (KCI) и обычно ниже значения рН (Н2О). Значения обменной кислотности могут быть использованы при определении необходимости в известковании почвы, но для этих целей чаще используют другой показатель – гидролитическую кислотность почвы.
По значениям обменной кислотности производят оценку кислотности почв (табл. 1).
Таблица 1
Группировка почв по степени кислотности
Класс |
Степень кислотности |
Величина рН (КCl) |
I |
Очень сильнокислые |
менее 4,0 |
II |
Сильнокислые |
4,1 – 4,5 |
III |
Среднекислые |
4,6 – 5,0 |
IV |
Слабокислые |
5,1 – 5,5 |
V |
Близкие к нейтральной |
5,6 –6,0 |
VI |
Нейтральные |
более 6,0 |
Г и д р о л и т и ч е с к а я к и с л о т н о с т ь (Нг) – дает более полное представление о потенциальной кислотности почв, т. к. замещение Н+ и Al3+ в ППК производится при воздействии на почву 1 н. раствором гидролитически щелочной соли ацетата натрия CH3COONa с рН 8,2. Выражается в ммоль/100 г почвы.
+ 4CH3COONa + 3H2O → (ППК)4Na + Al(OH)3↓ + 4CH3COOH
Кроме расчета доз извести, гидролитическую кислотность используют также при вычислении показателя, получившего название степени насыщенности почвы основаниями.
Оценку потенциальной кислотности почв производят по величине гидролитической кислотности (табл. 2)
Таблица 2
Степень кислотности почвы по величине Нг
Класс |
Степень кислотности |
Величина Нг, ммоль/100 г почвы |
I |
Очень сильнокислые |
более 6,0 |
II |
Сильнокислые |
5,1 – 6,0 |
III |
Среднекислые |
4,1 – 5,0 |
IV |
Слабокислые |
3,1 – 4,0 |
V |
Близкие к нейтральной |
2,1 – 3,0 |
VI |
Нейтральные |
менее 2,0 |
Устранение вредной кислотности почв осуществляется известкованием – внесением в почву извести Са(ОН)2, карбоната кальция СаСО3 и некоторых других известковых материалов.
+ 2СаСО3
+ 3H2O
→
 +
Al(OH)3
+ H2CO3
(CO2
+ H2O)
+
Al(OH)3
+ H2CO3
(CO2
+ H2O)
Щелочность почв связана с избытком ионов ОН–. Эти ионы образуются при выветривании алюмосиликатов почвообразующей породы, но в большей степени – при наличии в почве гидролитически щелочных солей (Na2CO3, NaHCO3, Ca(HCO3)2) и ионов Na+ в ППК. Подщелачивание почв возможно также вследствие выпадения щелочной пыли из атмосферы, загрязняемой предприятиями стройиндустрии. Различают актуальную и потенциальную щелочность.
А к т у а л ь н а я щ е л о ч н о с т ь определяется содержанием в почвенном растворе гидролитически щелочных солей, преимущественно карбонатов и гидрокарбонатов щелочных и щелочноземельных металлов. Актуальная щелочность может определяться значением рН водной вытяжки.
П о т е н ц и а л ь н а я щ е л о ч н о с т ь почв определяется содержанием обменного Na+, переходя в почвенный раствор, он подщелачивает его.
Оценку щелочности почв производят по значениям рН водной вытяжки (табл. 3)
Таблица 3
Группировка почв по степени щелочности
Класс |
Степень щелочности |
Величина рН (Н2О) |
I |
Слабощелочные |
7,2 – 7,5 |
II |
Щелочные |
7,6 – 8,5 |
III |
Сильнощелочные |
8,5 – 10,0 |
IV |
Резкощелочные |
10,1 – 12,0 |
Для борьбы с повышенной щелочностью почв применяют их гипсование, т.е. внесение гипса СаSO4·2H2O.
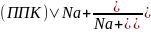 +
СаSО4
→ (ППК)Са2+
+ Na2SO4
+
СаSО4
→ (ППК)Са2+
+ Na2SO4
С процессами ионного обмена связано и такое свойство почв, как к и с л о т н о -о с н о в н а я б у ф е р н о с т ь , то есть сопротивляемость почвы изменению рН при действии кислоты или основания. Почва является «буферной» средой, поскольку противостоит резким изменениям рН. Буферная способность почвы зависит от емкости поглощающего комплекса, который выполняет важную функцию регулятора концентрации почвенного раствора.
Цель работы: Познакомиться и освоить методы определения различных видов кислотности почв. Уметь объяснять: из каких составляющих складывается актуальная и разные виды обменной кислотности. Иметь представление о почвенном поглощающем комплексе (ППК).
Реактивы и оборудование: дистиллированная вода, раствор хлорида калия с молярной концентрацией С(КС1) = 1.0 моль/дм3, раствор уксуснокислого натрия с молярной концентрацией C(CH3COONa) = l.0 моль/дм3, рН-метр, ротатор (мешалка), стеклянные колбы на 100 мл с широким горлом, закрывающиеся пробками (или стеклянные стаканчики на 100 мл), мерные цилиндры, буферные растворы с рН 1.68, 3.56, 4.01, 6.86, 9.18.
Приготовление реактивов:
Раствор КС1, 1М. В мерную колбу на 1 литр поместите 74.5 г КС1, добавьте дистиллированную воду, растворите и доведите до метки дистиллированной водой.
Раствор CH3COONa, 1М. В мерную колбу на 1 литр поместите 82 г CH3COONa, добавьте дистиллированную воду, растворите и доведите до метки дистиллированной водой.
Буферные растворы с рН 1.68,3.56,4.01,6.86,9.18. Готовят из фиксаналов в ампулах, согласно инструкции.
Принцип метода:
Измерение рН почвы производится потенциометрически в надосадочной жидкости суспензии, приготовленной при соотношении почва: вода равном 1:2,5. Жидкостью служит либо вода - рН (Н2О), либо раствор соли - рН(КС1) и pH(CH3COONa).
Ремарки:
Перед измерениями откалибруйте рН-метр по буферным растворам для нужного вам диапазона рН. Из-за разницы в наклоне калибровочной линии измерения за пределами калибровочного диапазона могут быть ошибочными.
Буферные растворы не следует хранить слишком долго. Растворы с рН 9 и 10 особенно чувствительны в CO2 и довольно быстро могут стать ненадежными.
Ход работы:
1. Определение актуальной кислотности - рН водной вытяжки [рН (Н2О)]
Возьмите навеску 10 г мелкозема воздушно-сухой почвы в чистую, сухую 100 миллилитровую колбу с широким горлом (или в стаканчик). Добавьте 25 мл дистиллированной воды, закройте колбу пробкой.
Встряхивайте на мешалке в течение двух часов.
Перед тем, как открыть колбу для производства измерений, встряхните ее раз или два руками.
Поместите электрод в верхнюю часть суспензии.
Когда показания прибора стабилизируются, считайте значение рН (точность 0.01 единицы рН).
Примечание: показания прибора считаются установившимися, когда в течение 30 секунд они меняются не более, чем на 0.1 единицу рН (или 0.02 единицы за 5 секунд). В карбонатных почвах достичь стабилизации показаний может быть трудно из-за неравновесных условий.
