
г
7
По
механизму пассивного антипорта
функционируют транслоказы внутренней
мембраны митохондрий, в частности,
АДФ/АТФ-транслоказа.
При
активном транспорте перенос вещества
осуществляется против градиента
концентрации и поэтому сопряжен с
энергетическими затратами. Если перенос
лигандов через мембрану связан с
затратой энергии АТФ, то такой перенос
называется первично-активным
транспортом. Примером
могут служить
Nа+К+-АТФаза
и Са2+-АТФаза,
локализованные в плазматической
мембране клеток человека и Н+,К+-АТФаза
слизистой оболочки желудка.
Вторично-активный
транспорт. Перенос
некоторых веществ против градиента
концентрации зависит от одновременного
или последовательного переноса Na+
(ионов натрия) по градиенту концентрации.
При этом, если лиганд переносится в том
же направлении, что и Na+,
процесс называется активным
симпортом. По
механизму активного симпорта происходит
всасывание глюкозы из просвета кишечника,
где ее концентрация низка. Если же
лиганд переносится в противоположном
ионам натрия направлении, то такой
процесс называется активным
антипортом. Примером
может служить Na+
,Са+ -обменник плазматической
мембраны.
Сигнальными
молекулами могут быть неполярные и
полярные вещества. Неполярные вещества,
например стероидные гормоны, проникают
в клетку, проходя через липидный бислой.
Полярные сигнальные молекулы в клетку
не проникают, но связываются специфическими
рецепторами клеточных мембран. Такое
взаимодействие вызывает цепь
последовательных процессов в самой
мембране и внутри клетки. К полярным
сигнальным молекулам относят белковые
гормоны (например, инсулин, соматотропин,
паратгормон), нейромедиаторы (например,
ацетилхолин, глицин, ГАМК), факторы
роста, цитокины.
Передача
сигнала с помощью внутриклеточных
рецепторов
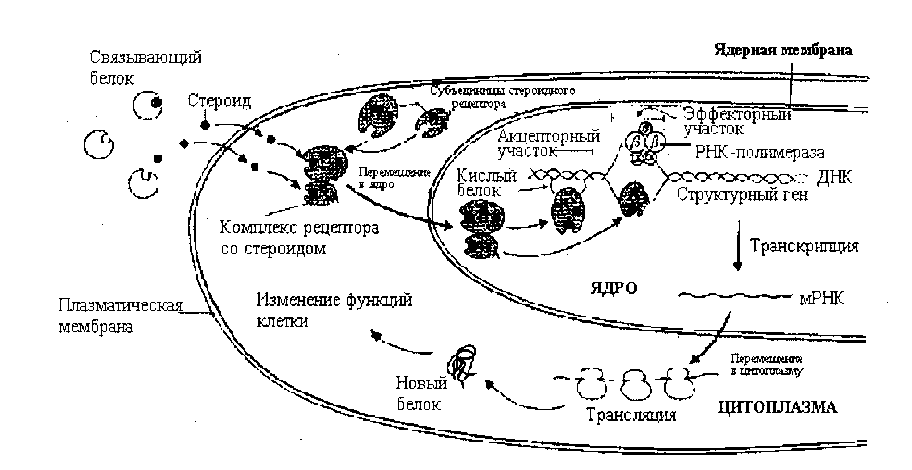
Гормоны
стероидной природы реализуют свои
эффекты, проникая в клетку и связываясь
с цитозольными или ядерными рецепторами.
Плазматическая мембрана не является
для них непреодолимой преградой ввиду
их липофильности и небольшой молекулярной
массы. Поступив в клетку, стероидные
образуют комплекс со специфическим
цитозольным рецептором, что приводит
к изменению конформации рецептора и
снижению сродства к белкам-шаперонам,
отделяющимся от комплекса гормон-рецептор.
Далее гормон-рецепторный комплекс
поступает в ядро, где связывается со
специфическими регуляторными элементами
ДНК - т.е. с определенными нуклеотидными
последовательностями, чувствительными
к гормонам (энхансером или сайленсером).
Результатом этого взаимодействия
является синтез всех видов РНК и как
следствие, синтез на рибосомах новых
количеств белка.Трансмембранная передача сигнала
Эффекты
гормонов, которые передают сигнал через
внутриклеточные рецепторы, развиваются
не сразу, т.к. на протекание матричных
биосинтезов (транскрипции и трансляции)
требуются часы.
В
отличие от стероидных гормоны
белково-пептидной природы не способны
проникать через клеточную мембрану и
потому реализуют свои эффекты через
трансдукционные системы, т.е. специальные
системы, передающие сигнал снаружи
внутрь клетки. Можно выделить 4 основных
класса трансдукционных систем:
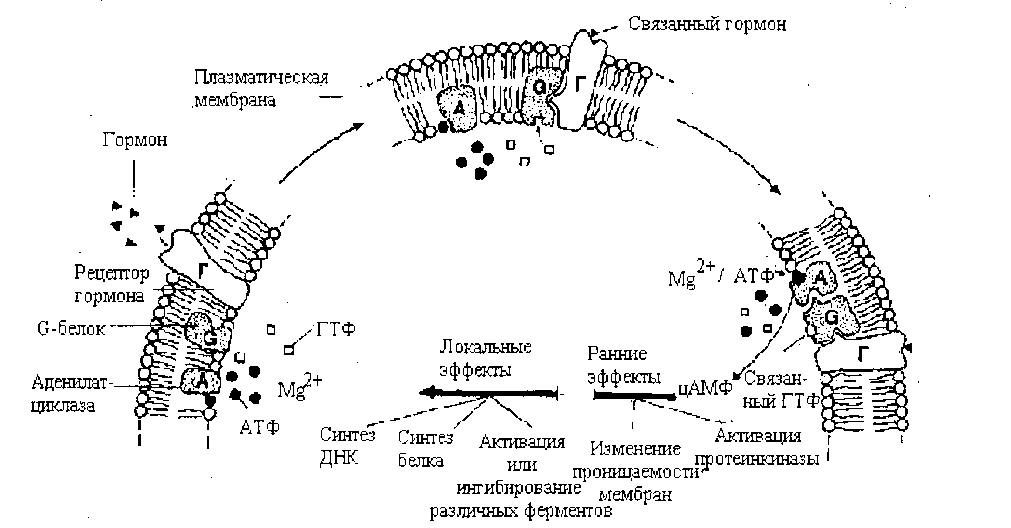
Системы,
передающие сигнал при участии G-белков.
Последние представляют собой семейство
низкомолекулярных мембранных белков,
связывающих гуаниловые нуклеотиды.
Образовавшийся на поверхности клеточной
мембраны гормон-рецепторный комплекс
активирует G-белок.
Механизм активации заключается в
замещении ГДФ, содержащейся в неактивном
G-белке, на ГТФ и последующей
диссоциации α-субъединицы от ингибиторных
βγ-субъединиц. После передачи сигнала
G-белок возвращается в
исходное неактивное состояние вследствие
действия ГТФазы, имеющейся у G-белка
и гидролизующей ГТФ до ГДФ. Описаны
две системы, функционирующие с участием
G-белков:
а) трансдукционная
система, в которой эффекторным ферментом
является аденилатциклаза, катализирующая
образование цАМФ. Примерами могут
служить системы, включаемые Н2-гистаминовым
рецептором, V2-
рецептором вазопрессина, рецептором
глюкагона, β1 и β2-адренорецепторами
и т.д.
б) трансдукционная
система, в которой эффекторным ферментом
является фосфо липаза С. Последняя
гидролизует мембранный
фосфатидилинозитолдифосфат (ФИФ2)
с
образованием вторичных посредников:
инозитолтрифосфата (ИФз)
и
диацилглицерола (ДАГ).
9
Примерами
могут служить системы, включаемые V1
-рецептором вазопрессина, α1-адренорецептором,
рецептором ангиотензина и т.д.
Система,
в которой эффекторным ферментом
является гуанилатциклаза, катализирующая
образование цГМФ. Примером может
служить система, включаемая рецептором
предсердного натрий-уретического
пептида.
Системы,
в которых эффекторным ферментом
является тирозинкиназа - фермент,
катализирующий фосфорилирование
белков-субстратов по остаткам тирозина.
Примерами могут служить системы,
включаемые рецептором инсулина и
различных ростовых факторов: фактора
роста нервов, тромбоцитов, эпидермиса
и т.д.
Системы,
в которых рецептор одновременно
является ионным каналом. Примером
может служить рецептор ГАМК, являющийся
одновременно каналом для СI-,
а также никотиновый ацетилхолиновый
рецептор одновременно являющийся
Nа+-каналом.
Таким
образом, белково-пептидные гормоны
внутрь клетки не проникают, но в
результате активации соответствующих
трансдукционных систем внутри клетки
образуются (или поступают извне)
химические посредники, которые реализуют
функции гормона внутри клетки. Эти
посредники получили название вторичных
мессенджеров (посредников). При этом в
роли первого сигнала рассматривается
сам гормон. В настоящее время можно
выделить не менее 4 типов вторичных
гормональных посредников: 1) циклические
нуклеотиды (цАМФ и цГМФ), 2) ионы Са, 3)
метаболиты фосфатидилинозитола и 4)
циклическая АДФ-рибоза.
цАМФ
- как вторичный гормональный посредник
Роль
цАМФ в качестве вторичного посредника
установлена амер. ученым Сазерлендом
в 1957 году. В 1971 году за это открытие и
разработку теории о вторичном гормональном
посреднике ему присуждена Нобелевская
премия.
Реализация
гормональных эффектов через цАМФ
представляется следующим образом.
Гормон изменяет уровень цАМФ в клетке,
модулируя активность аденилатциклазы
(АЦ). Аденилатциклаза встроена в мембрану
и состоит из 3-х компонентов:
рецепторов,
локализованных на наружной поверхности
плазматической мембраны. При этом все
рецепторы можно разделить на 2 типа:
1) Rs - повышающие уровень
цАМФ путем активации АЦ и 2) Ri
- понижающие уровень цАМФ путем
ингибирования АЦ.
регуляторных
белков (Gs и Gi),
действующих как трансдуктор между
соответствующими рецепторами и
каталитической субъединицей АЦ. При
этом регуляторные белки состоят из
3-х субъединиц: α, β и γ. β и γ- субъединицы
у всех G-белков одинаковы,
а α-субъединицы различны.
каталитической
субъединицы АЦ или собственно АЦ,
которая обладает ферментативной
активностью и катализирует реакцию:
АТФ
+ Н20 → цАМФ + Н4Р207
10
Функционирование
аденилатциклазной системы:
комплекс
Hs-Rs
взаимодействует с Gs-белком,
активируя его, что выражается в замещении
ГДФ на ГТФ, после чего α-субъединица
отделяется от комплекса из βγ-субъединиц
и активирует каталитическую субъединицу
АЦ. Последняя катализирует образование
цАМФ из АТФ.
Образовавшийся
цАМФ реализует свои эффекты через цАМФ-
зависимую протеинкиназу (ПК А). Последняя
представляет собой тетрамер, состоящий
из 2
регуляторных (R) и 2
каталитических (С) субъединиц.
Присоединение цАМФ к R-субъединицам
вызывает диссоциацию тетрамера, при
этом образующийся димер из двух
С-субъединиц является активной формой
ПК А. ПК А фосфорилирует белки по остаткам
серина и треонина, изменяя их функциональную
активность.
Прекращение
действия цАМФ связано с функционированием
3 ферментов: 1) фосфодиэстеразы (ФДЭ)
циклических нуклеотидов,
гидролизующей
цАМФ и переводящей его в ациклическую
форму 2) фосфопротеинфосфатазы,
катализирующей дефосфорилирование
белков и переводящей их тем самым в
исходное функциональное состояние и
3) ГТФазы, катализирующей гидролиз ГТФ
до ГДФ, и тем самым вызывающей диссоциацию
комплекса α-субъединица Gs-белка
- аденилатциклаза, что переводит
последнюю в неактивную форму.
Взаимодействие
Hi со специфическим
рецептором приводит к образованию
комплекса Hi-Ri
и активации Gi-белка.
α-субъединица Gi-белка
отделяется от βγ-субъединиц, в результате
чего последние приобретают способность
взаимодействовать с α-субъединицей
Gs-белка и, таким образом,
ингибировать каталитическую субъединицу
АЦ.
11
Вторичные
посредники липидной природы
Их
предшественником является
фосфатидилинозитолдифосфат (ФИФ2),
образующийся в результате фосфорилирования
фосфатидилинозитола (ФИ), локализованного
преимущественно в обращенном к цитоплазме
слое клеточной мембраны. Гидролиз этого
фосфолипида под действием фосфолипазы
С (ФЛ С) приводит к образованию 2-х
вторичных посредников липидной природы:
ИФ3
и ДАГ.
Гормон,
связываясь со специфическим рецептором,
активирует Gq- белок. При
этом ГТФ замещает в Gq-белке
ГДФ, α-субъединица отделяется от
ингибиторных βγ-субъединиц и присоединяется
к фосфолипазе С, переводя ее в активную
форму. Последняя гидролизует ФИФ2
с образованием ДАГ и ИФ3.
ИФ3
хорошо растворим в воде, поэтому он
диффундирует в цитоплазму, взаимодействует
со специфическим рецептором на цистернах
эндоплазматического ретикулума и
вызывает освобождение депонированного
в них Са2+
. ДАГ плохо растворим в воде, поэтому
он остается в пределах липидного слоя
мембраны и взаимодействует с доменом
протеинкиназы С, чувствительным к ДАГ.
Результатом является повышение сродства
протеинкиназы С к Са2+.
Активированная Са2+
протеинкиназа С катализирует
фосфорилирование белков-мишеней по
остаткам серина и треонина, изменяя их
функциональное состояние.
цГМФ
- как вторичный гормональный посредник
Гуанилатциклазная
система, регулируемая атриальным
натрий-уретическим пептидом, представлена
одной или несколькими полипептидными
цепями, на одной стороне которых
находится рецептор, а на другой
(обращенной в цитоплазму) - каталитический
домен. Этот домен, при образовании
гормон-рецепторного комплекса,
демонстрирует гуанилатциклазную
активность, катализируя реакцию
образования цГМФ из ГТФ:
ГТФ
+ Н20 → цГМФ + ФФ
Образующийся
цГМФ реализует свои эффекты через
протеинкиназу G, которая
катализирует фосфорилирование
белков-мишеней по остаткам серина и
треонина, изменяя их функциональную
активность.
Са2+
как вторичный гормональный посредник
Система,
регулирующая внутриклеточное содержание
Са2+, состоит из
рецептора,
G-белка и рецептор-зависимого
Са2+ -канала. Взаимодействие
гормона с G-белком открывает
рецептор-зависимый Са2+-канал и
Са2+ по градиенту концентрации
(концентрация Са2+ вне клетки
составляет 10-3 М, а внутри клетки
– 10-7
М) поступает в клетку. В цитоплазме он
взаимодействует с кальмодулином (КМ)
- термостабильным низкомолекулярным
белком, имеющим центры с высоким
сродством для связывания Са2+.
Образующийся комплекс Са2+-кальмодулин
способен изменять активность целого
ряда ферментов: Са2+/КМ-зависимой
протеинкиназы, ФДЭ-I
(Са2+/КМ-зависимой ФДЭ) и других.
Са2+/КМ-зависимая
протеинкиназа реализует свои эффекты
в клетке, катализируя фосфорилирование
белков-мишеней по остаткам серина и
12
треонина.
Прекращение действия сигнала достигается
действием двух ферментов: 1) Са2+-АТФазы,
которая откачивает Са2+ из клетки
в межклеточное пространство (изофермент
плазматической мембраны) или закачивает
Са2+ в цистерны эндоплазматического
ретикулума (изофермент ЭПР), и 2)
фосфопротеинфосфатазы, катализирующей
дефосфорилирование фосфопротеинов,
переводя их в исходное функциональное
состояние.
