
- •Методические указания и контрольные задания
- •«Водно-химические режимы промышленных предприятий»
- •2 Учебно-методическая литература
- •2.1. Основная литература
- •2.2. Дополнительная литература
- •Тема №1 Расчет эффективности использования воды на промышленном предприятии
- •Исходные данные для расчета
- •Контрольные вопросы
- •Расчет предельно допустимой карбонатной жесткости
- •Тема №3 Борьба с биообрастанием. Определение дозы хлора
- •Исходные данные для расчета
- •Контрольные вопросы
- •Тема № 4 Определение основных параметров водно-химического режима оборотного цикла
- •Тема № 5 Обработка воды в схемах оборотного водоснабжения. Обработка охлаждающей воды серной кислотой (подкисление)
- •Контрольные вопросы
- •Тема №6 Определение необходимой степени очистки сточных вод
- •Определение необходимой степени очистки по взвешенным веществам
- •Определение необходимой степени очистки сточных вод по бпКполн
- •Определение необходимой степени разбавления по запаху, окраске и привкусу
- •Определение необходимой степени очистки по изменению активной реакции среды
- •4) Определим необходимую степень очистки сточных вод по бпКполн
- •5) Произведем расчет необходимой степени очистки сточных вод по температуре воды водоема
- •Исходные данные для расчета
- •Контрольные вопросы
- •Тема № 7 Расчет необходимого количества аппаратов для очистки сточных вод
- •Исходные данные для расчета
- •Контрольные вопросы
- •Тема №8 Системы охлаждения оборотной воды. Расчет расходов добавочной воды
- •Контрольные вопросы
- •Тема № 9
- •Исходные данные для расчета
- •Контрольные вопросы
Расчет предельно допустимой карбонатной жесткости
На внутренних охлаждаемых поверхностях конденсаторов паровых турбин, воздухоохладителей генераторов и по всему тракту охлаждающей воды могут образовываться отложения за счет следующих процессов:
- нанос и оседание взвешенных веществ (органические примеси, песок);
- выделение твердых веществ из водяного раствора (преимущественно карбоната кальция);
- образование продуктов коррозии.
На стенках конденсаторных труб способны обитать живые организмы, что приводит к зарастанию труб. Характер и интенсивность загрязнения внутренней поверхности конденсаторных труб и связанные с этим нарушения их работы зависят от многих факторов, к которым относится физико-химический состав охлаждающей воды, ее биологические особенности, конструкция конденсатора и режим его работы (скорость движения воды в трубах, температурный перепад и т. д.), коррозионная стойкость конденсаторных труб.
Рассмотрим
условия образования отложений карбоната
кальция на поверхности, охлаждаемой
водой, обладающей карбонатной жесткостью.
В стабильной воде гидрокарбонатные
ионы
![]() ,
с одной стороны, находятся в динамическом
равновесии с ионами
,
с одной стороны, находятся в динамическом
равновесии с ионами
![]() и Н+,
а с другой стороны – с недиссоциированными
молекулами растворенной в воде СО2.
Со своей стороны растворенная в воде
углекислота находится в равновесии с
газообразной углекислотой, присутствующей
в пространстве над водой.
и Н+,
а с другой стороны – с недиссоциированными
молекулами растворенной в воде СО2.
Со своей стороны растворенная в воде
углекислота находится в равновесии с
газообразной углекислотой, присутствующей
в пространстве над водой.
Это
так называемое углекислотное равновесие
нарушается при нагревании воды, вследствие
чего часть растворенной в ней углекислоты
удаляется. При этом происходит термический
распад гидрокарбонат-ионов с образованием
![]() и летучей СО2:
и летучей СО2:
![]()
Процесс распада гидрокарбонатов протекает тем быстрее, чем выше температура и чем энергичнее перемешивание. В прямоточных системах охлаждения распад гидрокарбонатов обусловлен нагреванием воды, а в оборотных системах, кроме того, потерей растворенной в воде углекислоты при разбрызгивании воды в градирнях или брызгальных бассейнах.
Увеличение концентрации карбонатных ионов при наличии в воде катионов кальция приводит к образованию труднорастворимого осадка СаСО3, обладающего способностью кристаллизоваться и давать плотные отложения на охлаждаемых поверхностях:
![]()
Так
как величина произведения растворимости
для карбоната кальция
![]() весьма мала (4,4·10-9),
то при значительной концентрации Са2+
концентрация
должна быть низкой. Вместе с карбонатом
кальция на охлаждаемых поверхностях
конденсаторов могут откладываться
взвешенные
вещества,
которые как бы цементируются карбонатом
кальция.
весьма мала (4,4·10-9),
то при значительной концентрации Са2+
концентрация
должна быть низкой. Вместе с карбонатом
кальция на охлаждаемых поверхностях
конденсаторов могут откладываться
взвешенные
вещества,
которые как бы цементируются карбонатом
кальция.
На поверхности конденсаторных труб и трубопроводов циркуляционной системы охлаждения могут возникать также отложения гидроксида железа Fe(OH)3 в тех случаях, когда в охлаждающей воде присутствуют соединения железа. При нагревании циркуляционной воды, содержащей гидрокарбонат закиси железа, при обогащении ее кислородом и потере ею растворенной свободной углекислоты (вследствие аэрации воды в градирнях или брызгальных бассейнах), происходит окисление закисного железа в окисное и гидролиз, с образованием гидрата окиси железа.
Расчет предельно допустимой карбонатной жесткости
Жесткость воды характеризует молярную концентрацию эквивалентов солей кальция и магния (фактор эквивалентности = ½). При оценке качества оборотной воды жесткость воды выражают в ммоль/дм3, жесткость очищенной воды и конденсата выражают в мкмоль /дм3. Отсюда, если жесткость воды составляет 5 ммоль/дм3, массовая концентрация солей жесткости составит
- в пересчете на ионы кальция, мг/дм3
![]()
- в пересчете на ионы кальция, мг/дм3
![]()
где ½ - фактор эквивалентности для ионов кальция и магния
По отношению между общей жесткостью воды Жо и концентрацией в ней ионов НСО3¯ природные воды можно разделить на две группы:
- первая группа, когда Жо ≥ c(НСО3¯);
- вторая группа, когда Жо < c(НСО3¯);
В водах первой группы различают жесткость общую (Жо), карбонатную (Жо = c(НСО3¯), некарбонатную (Жнк) , жесткость кальциевую (ЖCa) и магниевую (ЖMg). Между ними существует следующая зависимость:
Жо = Жк + Жнк = Жса + ЖMg
Для вод второй группы, которые называются щелочными, понятие карбонатной и некарбонатной жесткости теряет смысл, поскольку
c(НСО3¯ ) >Жо .
Для этих вод следует различать жесткость общую, кальциевую и магниевую.
На практике часто приходится определять жесткость смеси двух и нескольких потоков воды. Например, в конденсаторы паровых турбин через неплотности проникает жесткая охлаждающая вода, вследствие чего жесткость конденсата увеличивается. В этом случае бывает необходимо установить долю проникающей в конденсатор воды. Решение подобного рода задач основывается на следующих равенствах
![]()
где Жсм – жесткость смеси;
![]() жесткость
первого и второго потоков, соответственно;
жесткость
первого и второго потоков, соответственно;
a, b – значение доли единицы первого и второго потоков, соответственно.
Значение
предельно допустимой
(по стабильности) карбонатной
жесткости охлаждающей
воды
![]() можно приближенно рассчитать по
эмпирической формуле, справедливой для
поверхностных вод с окисляемостью, не
превышающей 30 мг/дм3
О2
при температуре, равной 40 °С:
можно приближенно рассчитать по
эмпирической формуле, справедливой для
поверхностных вод с окисляемостью, не
превышающей 30 мг/дм3
О2
при температуре, равной 40 °С:
-
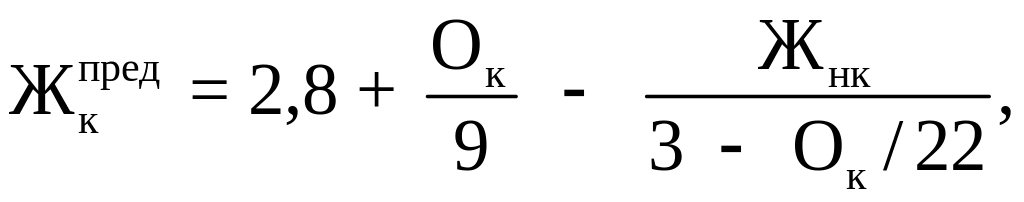
(4.19)
где Жнк – некарбонатная жесткость, ммоль/дм3;
Ок – окисляемость воды, мг/дм3 О2.
Пример
Природная вода характеризуется содержанием следующих примесей:
с(Са2+) = 74 мг/дм3; с(Mg2+) = 13,2 мг/дм3;
![]() ммоль/дм3;
ммоль/дм3;
![]() моль/дм3;
моль/дм3;
![]() ммоль /дм3;
ммоль /дм3;
![]() ммоль/дм3
; окисляемость
-5,0 мгО2/дм3;
ммоль/дм3
; окисляемость
-5,0 мгО2/дм3;
Определить значение предельно допустимой карбонатной жесткости.
Решение Молярная концентрация эквивалента кальция равна, ммоль/дм3
![]()
Молярная концентрация эквивалента магния равна, ммоль/дм3
![]()
Общая жесткость воды (концентрация солей кальция и магния) составляет, ммоль экв/дм3
Жо = 3,7 + 1,1 = 4,8
Некарбонатная жесткость воды составляет, ммоль/дм3
Жнк = Жо – Жк = 4,8 – 3,0 =1,8
Значение предельной допустимой карбонатной жесткости, ммоль/дм3
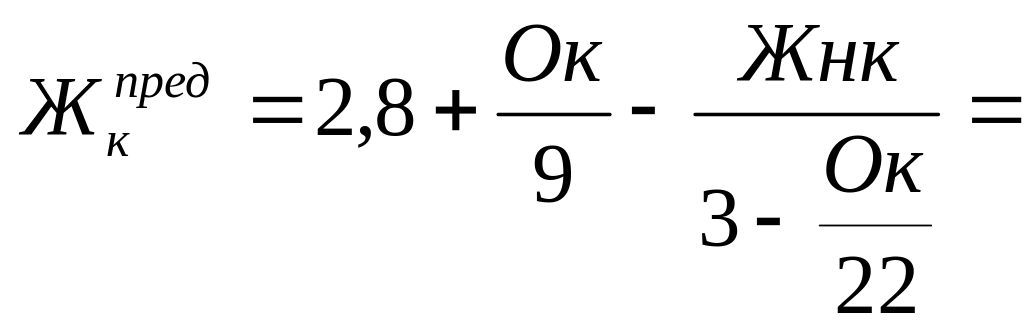 2,7
2,7
Контрольное задание № 2
Природная вода характеризуется содержанием следующих примесей, ммоль/дм3 (исходные данные в таблице)
Вариант № |
Окисляемость, мгО2/дм3 |
Концентрация примесей, мг/дм3 |
Концентрация примесей, ммоль/дм3 |
||||
|
|
|
|
|
|
||
1 |
4 |
90 |
9,1 |
4,5 |
4,5 |
3,9 |
4,5 |
2 |
5 |
80 |
8,2 |
4,3 |
4,3 |
3,7 |
4,3 |
3 |
6 |
70 |
7,1 |
4,1 |
4,0 |
3,5 |
3,0 |
4 |
7 |
95 |
9,5 |
4,0 |
4,1 |
3,9 |
4,6 |
5 |
8 |
85 |
8,5 |
4,6 |
4,2 |
3,7 |
4,1 |
6 |
9 |
75 |
7,5 |
4,7 |
4,3 |
3,6 |
3,5 |
7 |
8 |
92 |
9,2 |
4,8 |
4,4 |
3,9 |
4,9 |
8 |
7 |
82 |
8,2 |
4,9 |
4,5 |
3,8 |
4,7 |
9 |
6 |
72 |
7,2 |
4,0 |
4,6 |
3,5 |
3,2 |
10 |
5 |
93 |
9,3 |
4,1 |
4,7 |
3,8 |
5,9 |
11 |
4 |
83 |
8,3 |
4,2 |
4,2 |
3,8 |
5,8 |
12 |
9 |
73 |
7,3 |
4,3 |
4,1 |
3,6 |
4,1 |
13 |
8 |
94 |
9,4 |
4,4 |
4,9 |
3,9 |
5,2 |
14 |
7 |
84 |
8,0 |
4,5 |
4,7 |
3,7 |
5,0 |
15 |
6 |
74 |
8,0 |
4,6 |
4,0 |
3,2 |
4,4 |
16 |
5 |
64 |
6,0 |
4,7 |
4,0 |
3,1 |
3,9 |
17 |
4 |
59 |
7,0 |
4,8 |
4,0 |
3,0 |
3,0 |
18 |
10 |
69 |
8,0 |
4,9 |
4,1 |
3,3 |
3,2 |
19 |
12 |
79 |
7,0 |
4,3 |
4,3 |
3,4 |
4,0 |
20 |
11 |
89 |
8,0 |
4,5 |
4,4 |
3,8 |
4,2 |
Определить значение предельно допустимой карбонатной жесткости.
Контрольные вопросы
1 Содержание каких примесей характеризует жесткость воды?
2 Какие виды жесткости воды вам известны?
3 Единицы измерения жесткости.
4 Каковы причины строгого нормирования содержания ионов Са2+ и Mg2+ в водах теплоэнергетических установок?
5 Процессы, приводящие к образованию отложений на стенках оборудования и по тракту охлаждающей воды.
6 От каких параметров зависит распад гидрокарбонат-ионов?
7 Последствия распада гидрокарбонат-ионов.
8 Какую формулу используют для вычисления доли охлаждающей воды, проникшей в конденсатор через неплотности, если известны значения жесткости I-го и II- го потоков и смеси воды?
