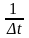- •Правила техники безопасности. Знакомство с техникой выполнения лабораторных работ. Основные свойства важнейших классов неорганических веществ.
- •Лабораторная работа № 1 Основные классы неорганических соединений
- •Порядок выполнения работы
- •Лабораторная работа №2 Химическая кинетика .Химическое равновесие.
- •Лабораторная работа №3 Электролитическая диссоциация
- •Лабораторная работа №4 Способы выражения концентрации растворов
- •Формулы перехода от одних выражений концентраций растворов к другим
- •100 Г раствора - 1 г NaCl
- •201,315 Г раствора - х г NaCl
- •1. Что такое раствор? Какими способами можно выразить содержание растворенного вещества в растворе?
- •Лабораторная работа №5 Приготовление растворов заданной концентрации
- •Лабораторная работа №6 Окислительно-восстановительные реакции
- •Лабораторная работа №7
- •Пример 6.
- •Пример7.
- •Лакмус содержит так называемую азометиновую кислоту, недиссоциированные молекулы которой красного цвета, а анионы – синего цвета.
Порядок выполнения работы
Задание 1. Получение и свойства гидроксидов
Опыт 1.Получение основного гидроксида
Налить в пробирку 3-4 мл воды, добавить 1-2 капли фенолфталеина и всыпать немного порошка магния. Пробирку подогреть. Результаты опыта записать в виде уравнения реакции. Объяснить наблюдаемые явления.
Опыт 2.Получение нерастворимых гидроксидов
В отдельные пробирки налить по 2-3 мл растворов солей Mg, Pb, Cu, Ni (II), Fe (III). В каждую пробирку добавить раствор щелочи, отмечая происходящие явления.
Написать уравнения реакций.
Опыт З.Получение и свойства амфотерных гидроксидов
В отдельные пробирки налить растворы солей AL, Cr(III), Zn. Прибавить по каплям раствор щелочи до образования студенистых осадков. Каждый осадок разделить на 2 части ( в 2 пробирки), на одну часть подействовать избытком щелочи, а на другую - раствором кислоты. Объяснить наблюдаемые явления, написать уравнения всех реакций.
Задание 2. Получение солей
Опыт 4. Получение соли при взаимодействии другой соли с кислотой
В пробирку налить 2-3 мл раствора ВаСl2 и прибавить немного раствора H2SO4 Объяснить наблюдаемые явления и написать уравнения реакции.
Опыт 5. Получение соли при взаимодействии двух других солей
Из двух растворимых солей получить сернокислый барий. Написать уравнение реакции.
Контрольные вопросы:
1 . Классификация основных классов неорганических соединений.
Способы получения гидроксидов. Индикаторы на ОН- группу.
Амфотерные гидроксиды. Доказательства амфотерности.
Способы получения солей.
Лабораторная работа №2 Химическая кинетика .Химическое равновесие.
Содержание работы
Целью работы является решение экспериментальных задач по химической кинетике, определении зависимости скорости химической реакции от концентрации реагирующих веществ, температуры, наличия катализатора и расчета условий химического равновесия в системах с обратимыми химическими реакциями.
Скорость химической реакции – изменение концентрации вещества в единицу времени в единице реакционного пространства
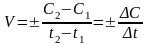
Скорость химической реакции всегда остается положительной, хотя отношения
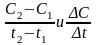 могут
быть положительными, так и отрицательными
в зависимости от того, концентрация
какого из реагирующих веществ измеряется.
могут
быть положительными, так и отрицательными
в зависимости от того, концентрация
какого из реагирующих веществ измеряется.
Скорость зависит от природы реагирующих веществ, их концентрации, температуры, наличие катализатора и других факторов.
Зависимость скорости химической реакции от концентрации реагирующих веществ можно изучить на примере самопроизвольного разложения тиосерной кислоты H2S2O3 при различных ее концентрациях, но при постоянной температуре. Известно, что тиосерная кислота в отличии от ее солей, неустойчива и самопроизвольно разлагается с образованием сернистой кислоты и свободной серы. Сернистая кислота, в свою очередь, разлагается до сернистого газа и воды. Т.е. при добавлении к раствору соли тиосерной кислоты, например, серной кислоты, протекают следующие реакции:
Na2 S2 O3 + H2 S O4 = H2S2O3 + Na2SO4
H2S2O3 = H2SO3 + S
H2S2O3 = H2 O + SO2 и суммарное уравнение
Na2S2O3 + H2S O4 = Na2SO4 + S + H2 O + SO2
Первая реакция идет практически мгновенно, точно так же устанавливается равновесие между H2SO3 H2O и SO2 . а скорость всего процесса определяется скорость самой медленной, второй, реакции.
Согласно закону действия масс скорость химической реакции прямо пропорциональна концентрации реагирующих веществ
аА + bВ → авАВ
Vх.р. = К[ А ]а [В ]в , где К – константа скорости химической реакции.
Скорость химической реакции вырастает в большей степени при увеличении концентрации всех реагентов, а при увеличении концентрации только одного из них возрастает в большей степени в том случае, если это вещество имеет больший стехиометриче6ский коэффициент в уравнении данной реакции.
Зависимость скорости реакции от температуры определяется правилом Вант-Гоффа
Vt
= VH
*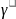
где Vt – скорость реакции при заданной температуре;
VH - скорость реакции при начальной температуре;
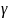 -
температурный коэффициент.
-
температурный коэффициент.
При
повышении температуры увеличивается
число активных молекул, а, следовательно,
увеличивается скорость их взаимодействия,
т.е. скорость реакции. Изменение скорости
химической реакции с температурой
характеризуется температурным
коэффициентом скорости, который
представляет собой отношение констант
скоростей при температурах (Т+10) и T=
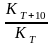 , а т. к. скорости реакций связаны с
константами скорости, то
, а т. к. скорости реакций связаны с
константами скорости, то
T=
=
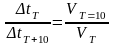
Скорость реакции зависит от наличия катализатора. При гомогенном катализе катализатор и реагенты находятся в одной и той же фазе. Катализаторы, образующие самостоятельную фазу, составляют вместе с реагентами и продуктами реакции гетерогенную систему. Катализатор может многократно участвовать в промежуточных химических взаимодействиях, но обычно его количество значительно меньше, чем реагентов. Катализатор не может сместить химическое равновесие, он может способствовать более быстрому его достижению, причем катализатор в равной степени ускоряет прямую и обратную реакции.
Порядок выполнения работы
Задание 1. Изучение влияния на скорость химической реакции различных факторов
Опыт 1. Влияние концентрации реагирующих веществ на скорость химической реакции
Приготовить четыре раствора тиосульфата натрия Na2S2O3 различной концентрации. Для этого в четыре сухие пробирки внести: в первую –5 капель 1н раствора тиосульфата натрия и 15 капель воды; во вторую –10 капель Na2S2O3 и 10 капель воды; в третью – 15 капель 1н Na2S2O3 и 5 капель воды; в четвертую – 20 капель того же раствора Na2S2O3.. Первые 3 пробирки осторожно встряхнуть. Таким образом, концентрация Na2S2O3 (в молях) будет: в 1 пробирке – 1 с, во второй – 2 с, в третьей – 3 с, в четвертой - 4 с. Отмечать время (по секундомеру) с момента сливания растворов тиосульфата натрия и серной кислоты (начало реакции) до момента появления заметной опалесценции, причем в каждую пробирку прилить по капле 2н раствора серной кислоты.
Данные опыта занести в таблицу 1.1
Таблица 1.1
Номер пробирки
|
Число капель раствора Na2 S2 O3
|
Число капель воды
|
Число капель кислоты H2SO4
|
Время течения реакции, t (сек) |
Скорость реакции1/t, усл. ед.
|
1 |
5 |
15 |
1 |
|
|
2 |
10 |
10 |
1 |
|
|
3 |
15 |
5 |
1 |
|
|
4 |
20 |
0 |
1 |
|
|
Начертить график зависимости скорости реакции от концентрации реагентов, откладывая концентрации реагентов на оси абсцисс, на оси ординат – соответствующие им скорости.
Опыт 2. Влияние температуры на скорость реакции.
Работу проводить в термостате при 20°,30°,40°,50° (также можно воспользоваться водяными банями – стаканом с крышкой, в котором имеется 3 отверстия: для термометра и двух пробирок). Стаканы с водой (кроме стакана №1) поставить на плитки и нагревать воду в стаканах: во втором – до 30°, в третьем - 40°, в четвертом - до 50°. Поддерживать температуру постоянной (± 0,5°С). Каждый стакан накрыть крышкой с тремя отверстиями. В одно из отверстий вставить термометр, конец которого опустить в воду, в другое отверстие – пробирку с 2н раствором серной кислоты и опущенной в него пипеткой, в третье – пробирку с 10 каплями 1н раствора тиосульфата натрия. Через 10 минут включить секундомер. Не вынимая пробирку с тиосульфатом из стакана №1, добавить в нее 1 каплю 2н раствора серной кислоты из пробирки, находящейся в том же термостате. Считая по секундомеру измерить время от момента добавления кислоты до появления заметной опалесценции. Повторить опыт с растворами Na2S2O3 и H2SO4 в стаканах 2, 3, 4. Произвести отсчет времени реакции по секундомеру, как и в первом случае. Полученные данные занести в таблицу 2.1
Таблица 2.1
№ опыта |
Температура, °С |
Промежуток времени от начала отсчета до появления опалесценции |
Скорость
реакции,
|
1 |
20 |
|
|
2 |
30 |
|
|
3 |
40 |
|
|
4 |
50 |
|
|
Представить графически зависимость скорости реакции от температуры; на оси ординат отложить 1/∆t, а на оси абсцисс – температуру.
Опыт 3. Влияние катализатора на скорость реакции.
В две пробирки внести по 10 капель 0,5н раствора роданида калия и по 1 капле 0,5н раствора хлорида железа (III). Отметить наблюдаемые процессы. В одну из пробирок добавить по 1 капле 1н раствора сульфата меди. В обе пробирки внести по 10 капель тиосульфата натрия. Отметить различную скорость, изменения окраски растворов (по секундомеру), имея в виду, что железо (III) восстанавливается в железо(II).
2Fe(SCN)3 + 2Na2S2O3 → Na2S4O6 + 2Fe(SCN)2 + 2NaSCN
Составить таблицу зависимости скорости от катализатора
Таблица 3.1
№ опыта |
Температура |
KSCN, капли |
FeCl3, капли |
CuSO4, капли |
Na2S2O3 , капли |
Время, Сек |
1 |
|
|
|
|
|
|
2 |
|
|
|
|
|
|
Резюмировать все наблюдения по заданию 1
Химическое равновесие. Очень многие реакции не доходят до конца потому, что продукты реакции, взаимодействуя между собой, вновь образуют исходные вещества. Такие реакции называются обратимыми.
А + В ↔ С + Д
Обратимые химические реакции приводят к состоянию химического равновесия, когда скорости прямой и обратной реакции выравниваются.
А + В → C + Д и С + Д → А + В или VПР. = VОБР.
VПР. = К1 [А][В] и VОБР. = К2 [С][Д], К1 =[ А ][ В ] = К2[С][Д]; отсюда

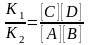 ,
т. к. К1
и К2
– величины постоянные при данной
температуре, то и их отношение при той
же температуре есть величина постоянная,
называемая константой равновесия:
,
т. к. К1
и К2
– величины постоянные при данной
температуре, то и их отношение при той
же температуре есть величина постоянная,
называемая константой равновесия:
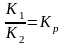 или
или
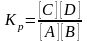
Константа равновесия показывает во сколько раз скорость прямой реакции больше скорости обратной реакции. В этом ее физический смысл.
Задание 2. Смещение химического равновесия при изменении концентрации одного из реагирующих веществ.
Опыт 4. В четыре пробирки внести по 10 капель 0,0025н растворов хлорида железа (III) и роданида калия. При этом образуется Fe(SCN)3 согласно уравнению:
FeCl3 + 3KCSN Fe(CSN)3) + 3KCl
и раствор из почти бесцветного окрашивается в красный цвет. Образовавшиеся растворы перемешать стеклянной палочкой и поставить в штатив. Одну пробирку оставить в качестве контрольной. В остальные пробирки добавить следующие реактивы: в первую – 1 каплю концентрированного раствора хлорида железа (III), во вторую – 1 каплю концентрированного раствора роданида калия, в третьею – несколько кристаллов хлорида калия. Сравнить интенсивность окраски полученных растворов с контрольным.
Дать объяснение наблюдаемым явлениям, пользуясь выражением константы равновесия и принципа Ле Шателье.
Контрольные вопросы:
1. Скорость химической реакции.
2. Средняя и истинная скорость химической реакции
3.Закон действия масс для скорости в гомогенной системе. Константа скорости. Ее физический смысл.
4. Влияние температуры на скорость реакции.
5.Энергия активации. Зависимость энергии активации от механизма химической реакции.
6. Понятие о катализе.
7. Химическое равновесие. Константа равновесия. Ее физический смысл.
8. Смещение химического равновесия. Принцип Ле Шателье, его физическое обоснование.