
- •1. Давление в жидкости, способы его измерения и единицы. Гидростатическое давление и
- •6. Вязкая жидкость. Коэффициент вязкости
- •7. Движение тела в вязкой жидкости. Формула Стокса для шарика и границы ее
- •Формула Стокса — Эйнштейна
- •8. Течение в трубах. Закон Пуазейля и границы его применимости. Гидравлическое сопротивление.
- •9. Ламинарное и турбулентное течение. Число Рейнольдса.
- •10. Уравнение газового состояния и термодинамическая («абсолютная») температура.
- •11. I начало термодинамики. Изопроцессы в идеальном газе. Адиабатический процесс.
- •Основное уравнение молекулярной-кинетической теории
10. Уравнение газового состояния и термодинамическая («абсолютная») температура.
Уравнение состояния идеального газа — формула, устанавливающая зависимость между давлением, молярным объёмом и абсолютной температурой идеального газа. Уравнение имеет вид:
![]()
где
— давление,
 — молярный
объём,
— молярный
объём,— универсальная газовая постоянная
— абсолютная температура,К.
Абсолютная шкала температуры называется так, потому что мера основного состояния нижнего предела температуры — абсолютный ноль, то есть наиболее низкая возможная температура, при которой в принципе невозможно извлечь из вещества тепловую энергию.
Абсолютный ноль определён как 0 K, что равно −273.15 °C.
Шкала температур Кельвина — это шкала, в которой начало отсчёта ведётся от абсолютного нуля.
11. I начало термодинамики. Изопроцессы в идеальном газе. Адиабатический процесс.
Первое начало термодинамики — один из трёх основных законов термодинамики, представляет собой закон сохранения энергии длятермодинамических систем.
Изопроцессы — термодинамические процессы, во время которых количество вещества и ещё одна из физических величин — параметров состояния: давление, объём илитемпература — остаются неизменными
Изобарный
процесс —
процесс изменения состояния
термодинамической системы при постоянном
давлении (![]() )
)
![]()
Адиабати́ческий, или адиаба́тный проце́сс — термодинамический процесс в макроскопической системе, при котором система не обменивается тепловой энергией с окружающим пространством .
![]()
где ![]() —
изменение внутренней
энергии тела,
— работа,
совершаемая системой.
—
изменение внутренней
энергии тела,
— работа,
совершаемая системой.
12. Основное уравнение молекулярно-кинетической теории. Температура и движение
молекул.
Изменение
импульса молекулы равно импульсу силы ![]() :
:
![]()
Давление газа равно
отношению модуля силы давления ![]() к
площади стенки S:
к
площади стенки S:![]() .
.
Основное уравнение молекулярной-кинетической теории
13. Теплоемкость и ее связь с движением молекул.
Теплоёмкость тела — физическая величина, определяющая отношение бесконечно малого количества теплотыδQ, полученного телом, к соответствующему приращению его температуры δT:
![]()
Единица измерения теплоёмкости в системе СИ — Дж/К.
14. Работа газа при изопроцессах. Работа и мощность сердца
ИЗОБАРНЫЙ
ПРОЦЕСС (![]() )
Для
изобарного процесса в идеальном газе
справедлив закон Гей-Люссака:
при
постоянном давлении объем данной массы
газа прямо пропорционален его
термодинамической температуре:
)
Для
изобарного процесса в идеальном газе
справедлив закон Гей-Люссака:
при
постоянном давлении объем данной массы
газа прямо пропорционален его
термодинамической температуре:
![]() или
или ![]() .
.
 Работа
газа при изобарном расширении:
Работа
газа при изобарном расширении:
![]() .
Изменение
внутренней энергии:
.
Изменение
внутренней энергии:
![]() Количество
полученного тепла в соответствии с
первым началом термодинамики:
Количество
полученного тепла в соответствии с
первым началом термодинамики:
![]() .
Молярная
теплоемкость при изобарном процессе:
.
Молярная
теплоемкость при изобарном процессе:
![]() .
.
ИЗОХОРНЫЙ
ПРОЦЕСС (![]() )
Изохорный
процесс в идеальном газе описывается
законом Шарля:
при постоянном объеме
давление данной массы газа прямо
пропорционально его термодинамической
температуре:
)
Изохорный
процесс в идеальном газе описывается
законом Шарля:
при постоянном объеме
давление данной массы газа прямо
пропорционально его термодинамической
температуре:
![]() или
или ![]() .
.
 Работа
газа при изохорном процессе равна
нулю:
Работа
газа при изохорном процессе равна
нулю: ![]() .
Все
полученное тепло идет на изменение
внутренней энергии в соответствии с
первым началом термодинамики:
.
Все
полученное тепло идет на изменение
внутренней энергии в соответствии с
первым началом термодинамики:
![]() .
Молярная
теплоемкость при изохорном процессе:
.
Молярная
теплоемкость при изохорном процессе:
![]() .
.
ИЗОТЕРМИЧЕСКИЙ
ПРОЦЕСС (![]() )
Изотермический
процесс в идеальном газе подчиняется
закону Бойля - Мариотта:
для данной
массы газа при неизменной температуре
произведение значений давления и объема
есть величина постоянная:
)
Изотермический
процесс в идеальном газе подчиняется
закону Бойля - Мариотта:
для данной
массы газа при неизменной температуре
произведение значений давления и объема
есть величина постоянная:
![]() или
или ![]() .
.
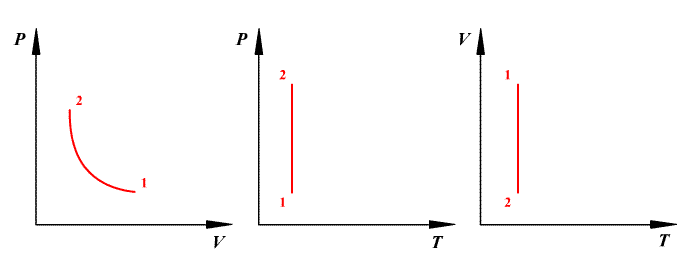 Работа
газа при изотермическом расширении:
Работа
газа при изотермическом расширении:
 .
Изменение
внутренней энергии при изотермическом
процессе равно нулю:
.
Изменение
внутренней энергии при изотермическом
процессе равно нулю:
![]() .
Все
полученное тепло идет на совершение
работы в соответствии с первым началом
термодинамики:
.
Все
полученное тепло идет на совершение
работы в соответствии с первым началом
термодинамики:
![]() .
.
15.II начало термодинамики. Энтропия.
Второе начало термодинамики — физический принцип, накладывающий ограничение на направление процессов передачи тепла между телами.
Энтропи́я — в естественных науках мера беспорядка системы
![]() ,
,
где ![]() —
приращение энтропии;
—
приращение энтропии; ![]() —
минимальная теплота, подведенная к
системе; T — абсолютная температура
процесса;
—
минимальная теплота, подведенная к
системе; T — абсолютная температура
процесса;
16. Тепловые машины и цикл Карно. Термодинамика организма.
Теплова́я маши́на — устройство, преобразующее тепловую энергию в механическую работу (тепловой двигатель) или механическую работу в тепло (холодильник).
 при
при ![]() .
.
Поэтому цикл Карно удобно представить в координатах T и S (температура и энтропия).
17. Необратимые процессы. Явления переноса (диффузии, теплопроводность, вязкость).
Необратимым называется процесс, который нельзя провести в противоположном направлении через все те же самые промежуточные состояния. Все реальные процессы необратимы. Примеры необратимых процессов: диффузия, термодиффузия, теплопроводность, вязкое течение и др. Переход кинетической энергии макроскопического движения через трение в теплоту, то есть во внутреннюю энергию системы, является необратимым процессом.
18. Фазовые переходы. Жидкие кристаллы
Фа́зовый перехо́д (фазовое превращение) в термодинамике — переход вещества из одной термодинамической фазы в другую при изменении внешних условий.
Жи́дкие криста́ллы (сокращённо ЖК) — это фазовое состояние, в которое переходят некоторые вещества при определенных условиях (температура, давление, концентрация в растворе). Жидкие кристаллы обладают одновременно свойствами как жидкостей (текучесть), так и кристаллов (анизотропия). По структуре ЖК представляют собой вязкие жидкости, состоящие из молекул вытянутой или дискообразной формы, определённым образом упорядоченных во всем объёме этой жидкости. Наиболее характерным свойством ЖК является их способность изменять ориентацию молекул под воздействием электрических полей, что открывает широкие возможности для применения их в промышленности.
