
- •Isbn 5-89368-405-2
- •2. Индивидуальный отчет по лабораторной работе должен содержать: ти-
- •4. Соли:
- •6. Взаимодействие двух солей. Налить в пробирку 5 капель 2 н. Рас-
- •2) Нейтральная среда
- •1. Разрушение комплексов в результате осаждения комплексообразо-
- •2. Разрушение комплекса в результате образования нового комплекса.
- •2. Участие комплексных соединений в окислительно-восстановитель-
- •0,5 Н.; сульфата меди (II) 0,5 н.; сульфата железа (II) 0,5 н.; сульфата маг-
- •1 Н.; карбоната натрия 0,1н.; гидрокарбоната натрия 0,1 н.; хлорида аммо-
- •600000, Владимир, ул. Горького, 87.
тульный
лист, цель выполнения работы, теоретическую
часть (не более2. Индивидуальный отчет по лабораторной работе должен содержать: ти-
1 стр.), задание, экспериментальные данные, расчеты, графики (если
они требуются в работе), определение погрешности измерений и/или
вычислений, вывод по проделанной работе.
3. Конкретное число лабораторных, контрольных и других видов работ, а
также их тематика и сроки выполнения приводятся в календарном плане
на семестр для каждой специальности и утверждаются на заседании ка-
федры. До сведения студентов план доводится на первом занятии семе-
стра.
Заключение
Рейтинг-система организации работы студентов стимулирует регуляр-
ную систематическую работу студентов в течение семестра и гарантирует
объективную итоговую оценку, поскольку сам студент участвует в ее фор-
мировании. В то же время студент не может получить положительную
оценку за неудовлетворительное отношение к учебе в течение семестра.
6
Лабораторная
работа № 1
КЛАССЫ
НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
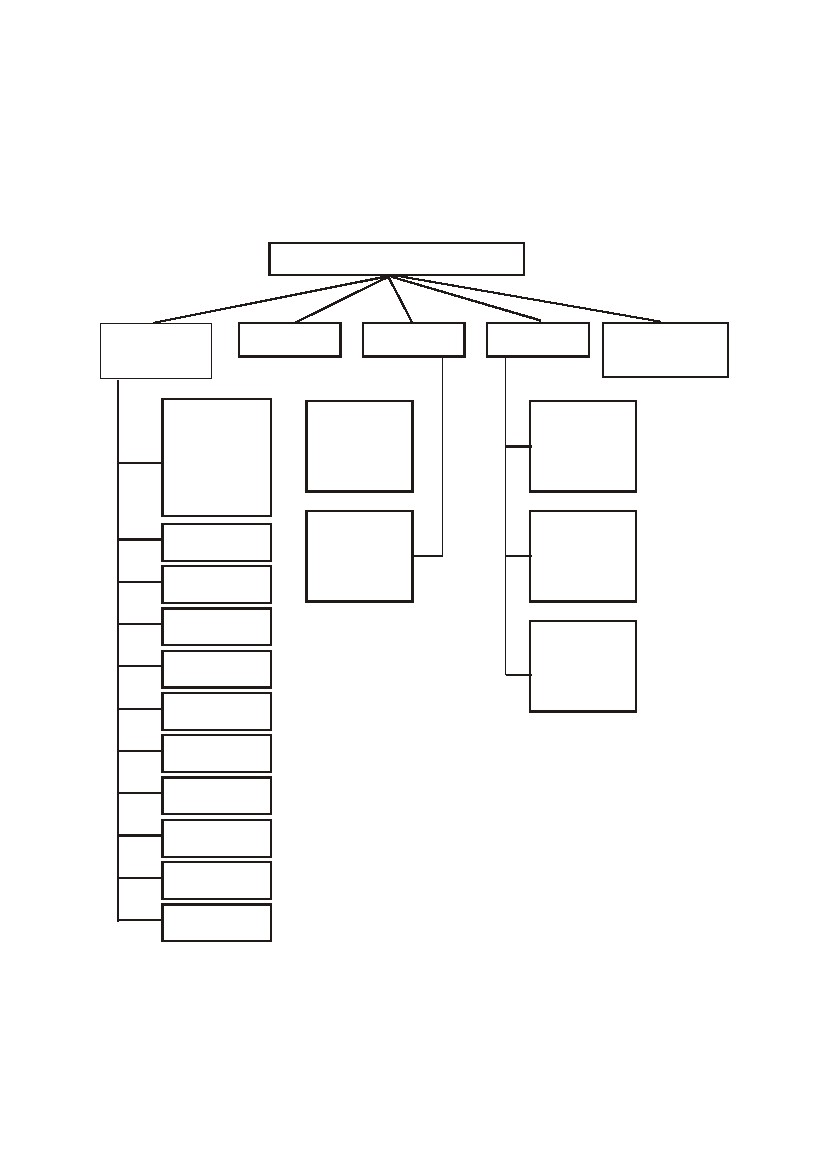
Классификация неорганических соединений
Неорганические вещества в зависимости от состава и свойств делятся
на следующие основные классы (рис. 1):
Неорганические соединения
Бинарные
соединения
Основания
Кислоты
Соли
Комплексные
соединения
Галогениды
(фториды,
хлориды,
бромиды,
иодиды)
Бориды
Карбиды
Нитриды
Фосфиды
Арсениды
Теллуриды
Селениды
Сульфиды
Оксиды
Гидриды
Кислородо-
содержащие
кислоты
Средние
соли
Бескисло-
родные
кислоты
Кислые
соли
Основные
соли
Рис. 1. Основные классы неорганических соединений
7
1. Бинарные соединения представляют собой класс неорганических ве-
ществ, молекулы которых состоят из двух элементов. Среди них: окси-
ды, гидриды, сульфиды, галогениды, карбиды, нитриды и др.
2. Основания – соединения, имеющие в своём составе положительно заря-
женный ион (катион) и гидроксогруппы ОН–. Например: NaOH, Ca(OH)2 и
др.
3. Кислоты – соединения, которые диссоциируют с образованием катиона
водорода Н+ (вернее, иона гидроксония Н3О+). Различают кислоты бес-
кислородные (НCl) и кислородсодержащие (Н2SO4).
4. Соли являются многочисленным классом химических соединений. Соли
можно рассматривать как продукты полного или частичного замещения
иона водорода в кислоте на катион металлов либо гидроксид-иона в ос-
нованиях – на другие анионы. По составу и свойствам различают средние
соли (нормальные) – Na2SO4, кислые соли – K2HPO4 и основные соли –
Al(OH)Cl2.
Номенклатура
Название неорганического соединения в соответствии с современной
номенклатурой ИЮПАК (Международного союза чистой и прикладной
химии) строится следующим образом: сначала называют электроотрица-
тельную (анионную) часть молекулы, а затем – электроположительную (ка-
тионную) в родительном падеже. Название анионной части молекулы, как
правило, образуют от латинского корня элемента. Если элемент катионной
части обладает переменной валентностью, то в скобках указывают его те-
кущую валентность в данном соединении.
1. Бинарные соединения:
CaO – оксид кальция, Fe2O3 – оксид железа (III), LiH – гидрид лития.
2. Основания:
NaOH – гидроксид натрия, Sn(OH)2 – гидроксид олова (II).
3. Кислоты:
бескислородные:
HBr – бромоводородная кислота, HCN – циановодородная кислота,
HSCN – родановодородная кислота;
кислородсодержащие:
H2SO4 – серная кислота, H2SO3 – сернистая кислота,
H3PO4 – ортофосфорная кислота, HPO3 – метафосфорная кислота.
8

