
- •Белки: строение, свойства и функции
- •I.I. Биологические функции белков
- •I.2. Белки и их основные признаки
- •2) Классификация аминокислот в соответствии с полярностью их r-групп (при рН 7)
- •I.4. Физико-химические свойства аминокислот
- •I.4.I. Амфотерные свойства аминокислот
- •I.4.2. Cтереоизомерия аминокислот
- •I.5. Аминокислотный состав белков
- •2. Классификация белков
- •2.I. По растворимости
- •2.2. По форме молекул
- •3. Физические свойства белков
- •4. Структурная организация белковых молекул
- •4.1. Первичная структура белков
- •4.2. Конформация (пространственное расположение) полипептидных цепей в белках
- •4.2.1. Вторичная структура белков
- •4.2.2. Третичная структура белков
- •4.2.3. Способность к специфическим взаимодействиям как основа биологической активности белков
- •4.2.4. Доменная структура белков
- •4.2.5. Ингибиторы функций белков
- •4.2.6. Четвертичная структура белка.
- •Кинетика оксигенирования миоглобина и гемоглобина
- •5. Изофункциональные белки
- •6. Изменения белкового состава организма
4. Структурная организация белковых молекул
Белки - очень крупные молекулы, молярная масса белков колеблется от 4-5 тысяч до 1 млн. грамм/моль (см. таблицу).
Белок |
Мол.масса |
Число ост. |
Число цепей |
Инсулин (бычий) |
5733 |
51 |
2 |
Рибонуклеаза (из поджелудочной железы) |
13683 |
124 |
1 |
Лизоцим (из яичного белка) |
13930 |
129 |
1 |
Миоглобин (из миокарда лошади) |
16890 |
153 |
1 |
Химотрипсин (из поджел. железы быка) |
22600 |
241 |
3 |
Гемоглобин (человека) |
64500 |
574 |
4 |
Сывороточный альбумин (человека) |
68500 |
550 |
1 |
Гексокиназа (из дрожжей) |
102000 |
800 |
2 |
-Глобулин (лошади) |
149900 |
1250 |
4 |
Глутаматдегидрогеназа (из печени быка) |
1000000 |
8300 |
40 |
Некоторые белки в своем составе могут иметь химические группы небелковой природы. Такие белки называют сложными. Небелковый компонент сложных белков называют простетической группой. Сложные белки классифицируются по природе простетической группы. Например, липопротеины это белки, содержащие в своем составе липиды; в состав хромопротеинов входит хромофор – окрашенная группа небелковой природы. Частный случай, когда хромофором является гем. Эти белки называются гемопротеинами. К ним относятся гемоглобин, миоглобин и цитохромы. Простетические группы играют важную роль при функционировании сложного белка.
4.1. Первичная структура белков
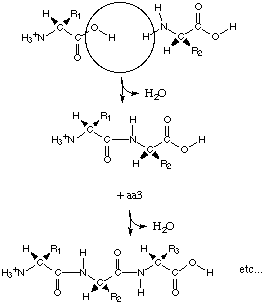 Первичной
структурой белка
называют
состав и последовательность аминокислотных
остатков в белковой молекуле. Первичная
структура белков стабилизируется
пептидными связями, образующимися между
α-карбоксильной группой одной аминокислоты
и α-аминогруппой другой аминокислоты.
Первичной
структурой белка
называют
состав и последовательность аминокислотных
остатков в белковой молекуле. Первичная
структура белков стабилизируется
пептидными связями, образующимися между
α-карбоксильной группой одной аминокислоты
и α-аминогруппой другой аминокислоты.
Каждый пептид имеет два конца. Конец, на котором находится свободная α-аминогруппа называется N-концом, а противоположный конец, на котором находится α-карбоксильная группа, называется С-концом. Нумерация аминокислотных остатков производится с N-конца.
Первичная структура является единственной, которая закодирована на генетическом уровне. Другие, более высокие уровни структурной организации белка определяются первичной структурой. Поэтому даже небольшие изменения первичной структуры могут значительно изменять свойства белка. Так, болезнь серповидноклеточная анемия является результатом замены всего 1 аминокислоты в -цепи гемоглобина (Glu Val).
4.2. Конформация (пространственное расположение) полипептидных цепей в белках
Термин конформация используют для описания пространственного расположения в органической молекуле замещающих групп, способных свободно изменять свое положение в пространстве без разрыва каких бы то ни было связей.
Пептидная цепь обладает значительной гибкостью. В результате внутрицепочечных взаимодействий она приобретает определенную пространственную структуру – конформацию. В белках различают два уровня пространственной организации для одной полипептидной цепи: вторичную и третичную структуры белка. Для белков, содержащих несколько полипептидных цепей, рассматривают пространственную укладку этих цепей относительно друг друга - четвертичную структуру белка.
