
- •6. Ионообменные свойства кристаллов
- •6.1. Явление ионного обмена
- •6.1.2. Структура полисурьмяной кристаллической кислоты.
- •6.2. Экспериментальное определение ионообменной емкости методом потенциометрического титрования.
- •6.2.2.Устройство и принцип действия pH-метра.
- •6.2.3. Метод потенциометрического титрования.
- •6.3. Порядок выполнения работы
- •6.4. Задание к работе
- •6.5. Вопросы для контроля
- •Литература к разделу
6.2.3. Метод потенциометрического титрования.
Ионообменная емкость определяется по точке насыщения ионита, определяемой из изотермы ионного обмена (см. выше). Изотерма ионного обмена представляет собой зависимость концентрации обмениваемых ионов в ионите от их концентрации в окружающем растворе.
При помещении твердого нерастворимого ионита в растворитель происходит частичная диссоциация ионита с образованием вакантных мест в решетке или активных центров на поверхности ионита. При добавлении в суспензию раствора электролита, содержащего обмениваемые ионы, последние при надлежащих условиях поглощаются ионитом. При этом в случае малого количества обмениваемых ионов в растворе по сравнению с емкостью ионита, они практически полностью поглощаются твердой фазой и их концентрация в растворе остается неизменной. При насыщении ионита, добавляемые ионы остаются в растворе, что приводит к повышению их концентрации и свидетельствует об окончании реакции ионного обмена. Концентрацию некоторого компонента в растворе можно определить потенциометрически, т.е. измеряя потенциал индикаторного электрода, который определяется реакцией с этим компонентом. Метод потенциометрического титрования заключается в постепенном изменении концентрации анализируемого компонента в растворе с одновременным контролем потенциала индикаторного электрода. В случае ионитов, в которых роль противоионов, т.е., замещаемых ионов, играют протонсодержащие группировки (H +, H3O+, OH-), используют электроды, обратимые по этим ионам, такой метод потенциометрического титрования называется pH-метрия.
П
Рис.
6.5. Кривая титрования суспензии ПСКК
водным раствором NH4OH
(а) и кривая холостого хода (б).
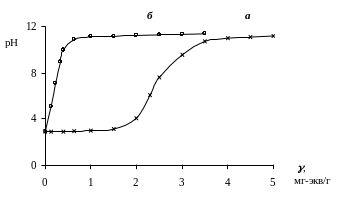 о
результатам потенциометрического
титрования строится кривая титрования,
– т.е., зависимость потенциала индикаторного
электрода от количества титранта,
добавленного в раствор (рис. 6.5). Для
построения изотермы ионного обмена
кривую титрования суспензии ионита
раствором соответствующего электролита
сравнивают с кривой холостого хода –
кривой титрования раствора с pH,
равным pH
исходной суспензии. Построение изотермы
ионного обмена производится следующим
образом. Количество ионов, остающихся
в растворе определяется по кривой
холостого хода: для данной точки на
кривой титрования берется значение pH,
затем на кривой холостого хода для
данного значения pH
измеряется количество щелочных ионов
в растворе – это и есть искомое количество
ионов, остающихся в растворе при
титровании. Количество ионов, перешедших
в твердую фазу (ионит), равно разности
количества ионов добавленных в раствор
и ионов, оставшихся в нем при достижении
равновесия.
о
результатам потенциометрического
титрования строится кривая титрования,
– т.е., зависимость потенциала индикаторного
электрода от количества титранта,
добавленного в раствор (рис. 6.5). Для
построения изотермы ионного обмена
кривую титрования суспензии ионита
раствором соответствующего электролита
сравнивают с кривой холостого хода –
кривой титрования раствора с pH,
равным pH
исходной суспензии. Построение изотермы
ионного обмена производится следующим
образом. Количество ионов, остающихся
в растворе определяется по кривой
холостого хода: для данной точки на
кривой титрования берется значение pH,
затем на кривой холостого хода для
данного значения pH
измеряется количество щелочных ионов
в растворе – это и есть искомое количество
ионов, остающихся в растворе при
титровании. Количество ионов, перешедших
в твердую фазу (ионит), равно разности
количества ионов добавленных в раствор
и ионов, оставшихся в нем при достижении
равновесия.
6.3. Порядок выполнения работы
Включите pH-метр в сеть. Дайте прибору прогреться в течении 10 минут. Взвесьте 0,5-1 г воздушно-сухого порошка ПСКК и смешайте его с 50 мл дистиллированной воды. Установите стакан с суспензией на магнитную мешалку, опустите в него электроды, таким образом, чтобы электроды не касались дна и стенок стакана. Опустите в стакан магнитную вертушку. Включите мешалку в сеть. Ручкой регулировки оборотов вращения установите необходимую интенсивность перемешивания. Перемешивайте в течение 5 минут. Измерьте pH суспензии. Рассчитайте массу щелочи, необходимую для проведения реакции ионного обмена, исходя из реакции (1), предполагая полное замещение заряженных протонных группировок ПСКК на щелочные ионы.
Приготовьте раствор щелочи. Количество щелочи в растворе должно в 1,5-2 раза превышать ее предельное количество, необходимое для проведения реакции ионного обмена (для полного завершения реакции один из реагентов необходимо взять в избытке). Объем раствора для титрования следует выбрать исходя из количества опытов100 мл.
Налейте в бюретку приготовленный раствор (титрант). Небольшими порциями приливайте в суспензию раствор щелочи, начиная с 1 мл. После каждого такого приливания смесь тщательно перемешивается и замеряется pH. Когда изменения pH становятся существенными, порции титранта уменьшают, титрование проводится по 0,1 мл. Результаты измерений желательно оформить в виде таблицы:
N |
V,мл |
pH |
n,мг-экв/г |
|
|
|
|
где V и n – объем и количество добавленного титранта. Миллиграммм-эквивалент – часто используемый в химии синоним миллимоля (10-3 моль). Ионообменная емкость традиционно выражается именно в миллиграмм-эквивалентах на грамм сухого сорбента.
