
- •Введение
- •Химические элементы и простые вещества
- •Сложные вещества
- •2.1 Степень окисления элемента
- •Упражнения для самопроверки
- •2.2 Бинарные соединения
- •2.2.1 Бинарные соединения водорода
- •2.2.2 Оксиды
- •Упражнения для самопроверки
- •2.2.3 Пероксиды
- •2.3 Гидроксиды
- •Упражнения для самопроверки
- •Средние соли
- •Кислые соли
- •Основные соли
- •Номенклатура солей
- •Упражнения для самопроверки
- •2.5 Галогенангидриды
- •Упражнения для самопроверки
- •Приложение
- •Содержание
- •1 Химические элементы и простые вещества 3
- •2 Сложные вещества 5
- •Классы неорганических соединений
- •196013, Санкт-Петербург, Московский пр., 26
2.5 Галогенангидриды
Среди неорганических соединений галогенов можно встретить вещества, формулы которых подобны формулам средних и основных солей, например, PCl3, SiF4, SCl6, TiCl4, VF5, VOCl2, CrF6, CrO2Cl2. Однако физические свойства перечисленных веществ разительно отличаются от свойств солей – при обычных условиях они существуют в виде газов, легко летучих жидкостей или твёрдых веществ. Эти соединения относятся к классу галогенангидридов. Наиболее важным и общим химическим свойством является их отношение к воде. Эти соединения большей частью легко, а в некоторых случаях труднее, разлагаются водой с образованием двух кислот, а именно: галогенводородной кислоты (HF, HCl, HBr, HI) и оксокислоты:
SiCl4 + 4H2O 4HCl + H4SiO4,
CrO2Cl2 + H2O 2HCl + H2CrO4.
Галогенангидриды считаются производными оксокислот.
Галогенангидридами называются соединения, являющиеся продуктами формального замещения гидроксильных групп оксокислот атомами галогенов.
К такому определению галогенангидридов следует подходить исключительно с точки зрения нахождения формул галогенангидридов данных кислот. Реальные методы получения галогенангидридов являются специфическими для каждого представителя этой группы соединений и в данных методических указаниях не рассматриваются.
Формулы галогенангидридов можно вывести из формул соответствующих кислот.
Примеры
а) Формула хлорангидрида угольной кислоты получается подстановкой атомов хлора вместо ОН-групп кислоты:
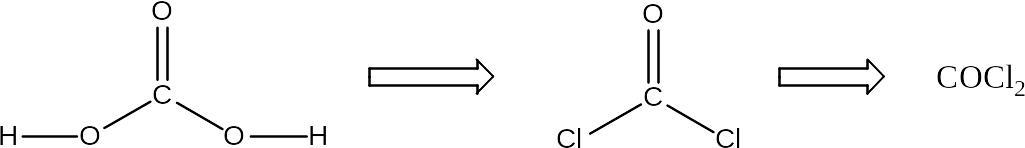
б) Формула бромангидрида фосфористой кислоты выводится аналогичным образом:

Принципиально возможны неполные галогенангидриды, т.е. продукты частичного замещения гидроксильных групп на атомы галогена, а также смешанные галогенангидриды, содержащие атомы различных галогенов, например:
SO2(OH)Cl или HSO3Cl, PBrClF, SOClF
Галогенангидриды можно называть по-русски, как это делается в случае оксокислот, при этом название соединения определяется названием галогенов и кислот, производными которых являются рассматриваемые галогенангидриды, например:
COCl2 – хлорангидрид угольной кислоты;
POBr3 – бромангидрид ортофосфорной кислоты;
SiF4 – фторангидрид ортокремневой кислоты;
SOClF –фтор-хлорангидрид сернистой кислоты:
HSO3Cl – монохлорангидрид серной кислоты или хлоросерная кислота.
Систематические названия галогенангидридов более точно отражают состав каждого из них, например:
COCl2 – дихлорид оксоуглерода;
POBr3 – трибромид оксофосфора;
PBr5 – пентабромид фосфора;
SOClF – фторид-хлорид оксосеры;
CrO2Cl2 – дихлорид диоксохрома.
Электроположителиные части некоторых кислородсодержащих галогенангидридов и основных солей имеют традиционные названия, например:
CrO22+ – хромил, UO22+ – уранил, TiO2+ – титанил,
NO+ – нитрозил, NO2+ – нитроил (нитроний), SbO+ – стибил,
BiO+ – висмутил, SO2+ – тионил, SO22+ – сульфонил.
Поэтому ряд галогенангидридов можно называть по типу солей:
CrO2Cl2 – хлорид хромила;
SOF2 – фторид тионила.
Как известно, нет резкой грани между свойствами металлических и неметаллических элементов. Некоторые элементы (Ge, Sn, As, Sb, Te) занимают как бы промежуточное положение, а их свойства и свойства соединений являются «переходными», проявляют некоторую двойственность.
Одним из примеров проявления таких переходных свойств является характер соединений элемента с галогеном. Так, если сравнивать физические и химические свойства галогенидов элементов главной подгруппы V группы Периодической системы (см. таблицу 3), то нетрудно сделать вывод, что два левых представителя являются типичными галогенангидридами и необратимо разлагаются водой:
NCl3 + 2H2O 3HCl + HNO2 (2HNO2 NO + HNO3);
PCl3 + 3H2O 3HCl + H3PO3.
Таблица 3 Свойства галогенидов элементов V-группы
NCl3 PCl3 AsCl3 SbCl3 BiCl3
Физическое состояние |
жидкость |
жидкость |
жидкость |
твёрдое кристаллич. |
Твёрдое кристаллич. |
Tплавления, оС |
<–40 |
–91 |
–16 |
73,4 |
230 |
Ткипения, оС |
71 |
76 |
131,3 |
218,6 |
447 |
Два правых представителя ряда – типичные соли, и обратимо гидролизуются с образованием основных солей:
SbCl3
+ H2O
![]() SbOCl
+ 2HCl;
SbOCl
+ 2HCl;
BiCl3 + H2O BiOCl + 2HCl.
AsCl3 характеризуется свойствами промежуточными между свойствами галогенангидрида и соли, так его гидролиз протекает как галогенангидрида, но реакция обратима:
AsCl3 + 3H2O 3HCl + H3AsO3.
Таким образом, нельзя провести резкой границы, как между металлами и неметаллами, основными оксидами и кислотными оксидами, так и между солями и галогенангидридами.
