Белки. Структура и функции
Белки или протеины количественно преобладают над всеми другими макромолекулами живой клетки. Белки участвуют во всех биологических процессах, выполняя разнообразные функции: ферментативный катализ; транспорт и накопление; сокращение и движение; иммунная защита; передача информации в клетку; регуляция метаболизма; механическая опора и пр. Каждый белок имеет уникальную, свойственную лишь ему структуру и в такой же мере уникальную функцию, отличающуюся от функций других белков.
Структура белка
Белки - это высокомолекулярные соединения (полимеры), состоящие из -аминокислот - мономерных звеньев, соединенных между собой пептидными связями. Все 20 аминокислот, встречающиеся в белках, это -аминокислоты, общим признаком которых является наличие аминогруппы - NН2 и карбоксильной группы - СООН у -углеродного атома. -аминокислоты отличаются друг от друга структурой группы R и, следовательно, свойствами. Все аминокислоты можно сгруппировать на основе полярности R-групп, т.е. их способности взаимодействовать с водой при биологических значениях рН.
|
Пептидные связи образуются при взаимодействии -аминогруппы одной аминокислоты с -карбоксильной группой другой аминокислоты: Пептидная связь - это амидная ковалентная связь, соединяющая аминокислоты в цепочку. Следовательно, пептиды - это цепочки аминокислот. Полипептидная цепь имеет определенное направление, так как у неё разные концы - либо свободная -аминогруппа (N-конец), либо свободная -карбоксильная группа (С-конец):
|
Изображение последовательности аминокислот в цепи начинается с N-концевой аминокислоты. С неё же начинается нумерация аминокислотных остатков. В полипептидной цепи многократно повторяется группа: -NH-CH-CO-. Эта группа формирует пептидный остов. Следовательно, полипептидная цепь состоит из остова (скелета), имеющего регулярную, повторяющуюся структуру, и отдельных боковых цепей R-групп. Первичная структура характеризуется порядком (последовательностью) чередования аминокислот в полипептидной цепи. Даже одинаковые по длине и аминокислотному составу пептиды могут быть разными веществами потому, что последовательность аминокислот в цепи у них разная. Последовательность аминокислот в белке уникальна и детерминируется генами. Даже небольшие изменения первичной структуры могут серьезно изменять свойства белка. Было бы неправильно заключить, что каждый аминокислотный остаток в белке необходим для сохранения нормальной структуры и функции белка. Например, были выявлены многие варианты последовательностей гемоглобина, функционирующие нормально. Объяснение этого заключается в понимании конформации белка и будет дано позднее.
Конформация полипептидных цепей
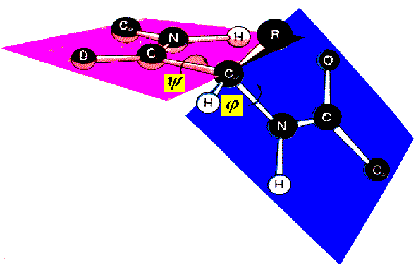
Функциональные свойства белков определяются их конформацией, т.е. расположением полипептидной цепи в пространстве. Уникальность конформации для каждого белка определяется его первичной структурой. В белках различают два уровня конформации пептидной цепи - вторичную и третичную структуру. Вторичная структура белков обусловлена способностью групп пептидной связи к водородным взаимодействиям: C=O....HN.
По обеим сторонам жесткой пептидной связи возможно вращение: и -углы, характеризующие вращение относительно одинарных связей С -C и C -N. |
Пептид стремится принять конформацию с максимумом водородных связей. Однако возможность их образования ограничивается тем, что пептидная связь имеет частично двойной характер, поэтому вращение вокруг нее затруднено. Пептидная цепь приобретает не произвольную, а строго определенную конформацию, фиксируемую водородными связями. Известны несколько способов укладки полипептидной цепи: -спираль - образуется внутрицепочечными водородными связями между NH-группой одного остатка аминокислоты и CO-группой четвертого от нее остатка; -структура (складчатый лист) - образуется межцепочечными водородными связями или связями между участками одной полипептидной цепи изогнутой в обратном направлении; беспорядочный клубок - это участки, не имеющие правильной, периодической пространственной организации. Но конформация этих участков также строго обусловлена аминокислотной последовательностью. Содержание -спиралей и -структур в разных белках различно: у фибриллярных белков - только -спираль или только -складчатый лист; а у глобулярных белков - отдельные фрагменты полипептидной цепи: либо -спираль, либо -складчатый лист, либо беспорядочный клубок.
Конформация полипептидных цепей: а - -спираль, б - -складчатый лист. |
В одном и том же белке могут присутствовать все три способа укладки полипептидной цепи:
|
Третичная структура глобулярных белков представляет ориентацию в пространстве полипептидной цепи, содержащей -спирали, -структуры и участки без периодической структуры (беспорядочный клубок). Дополнительное складывание скрученной полипептидной цепи образует компактную структуру. Это происходит, прежде всего, в результате взаимодействия между боковыми цепями аминокислотных остатков. Существует несколько видов взаимодействия между R-группами, в основном нековалентного характера:
|
Связи, стабилизирующие третичную структуру:
электростатические силы притяжения между R-группами, несущими противоположно заряженные ионогенные группы (ионные связи);
водородные связи между полярными (гидрофильными) R-группами;
гидрофобные взаимодействия между неполярными (гидрофобными) R-группами;
дисульфидные связи между радикалами двух молекул цистеина. Эти связи ковалентные. Они повышают стабильность третичной структуры, но не всегда являются обязательными для правильного скручивания молекулы. В ряде белков они могут вообще отсутствовать.
Пространственная структура миоглобина. В полипептидной цепи показаны только -углеродные атомы. Красным показан гем (небелковый компонент). |
Доменные белки содержат обособленные глобулы - домены, образованные одной и той же пептидной цепью. Домены соединены пептидными перемычками. Вторичная и третичная укладка полипептидной цепи белка полностью определяется его первичной структурой.