- •1.Предмет и методы генетики.
- •2. Виды изменчивости.
- •3. Виды наследственности.
- •4. Клетка как генетическая система.
- •5. Роль ядра и других органелл в прередаче, сохранения и реализации наследственной информации.
- •6.Морфологическое строение и химический состав хромосом.
- •7. Кариотип и его видовые ообенности.
- •8. Роль генотипа и условий среды в формировании фенотипа.
- •8. Митоз.
- •10. Мейоз.
- •11. Гаметогенез. Оогенез.
- •12. Особенности гаметогенеза самцов и самок.
- •13.Полиплоидия и ее значения.
- •14. Паталогии мейоза и митоза и ее значения.
- •15.Оплодотворение
- •18. Правило частоты гамет и его знаечние
- •19. Виды доминирования
- •20. Анализирующее скрещивание
- •22. Полигибридное скрещивание.
- •24. Плейотропное действие генов.
- •25.Виды взаимодействия неаллельных генов.
- •26. Эпистаз
- •27. Полимирия.
- •29. Летальные гены.
- •35. Генетический анализ полного сцепления.
- •30. Сцепленное наследование признаков
- •32. Особенности наследования признаком при неполном и полном сцелении
- •38. Типы определения пола
- •39. Кариотипы мужского и женского пола у разных видов животных.
- •40. Гомо и гетерогаметный пол
- •43. Опыты п регулированию соотношению пролов
- •44. Наследование признаков огран. Полом
- •45. Наследование признаков сцепленных с полом
- •46. Наследование признако
- •47. Практическое использование наследования признаков
- •48. Нуклеиновые кислоты, доказательства их роли в наслндственности.
- •49. Виды днк и рнк
- •50. Комплементарность
- •51.Строение днк
- •52. Репликация днк
- •57. Генетический код и его свойства.
- •58. Структурные гены и гены регуляции
- •59. Регуляция действий генов
- •60. Оперон
- •65. Лизогения и лизогенное состояние клеток
- •61. Обмен генетической информацией у прокариот
- •67. Строение бактерий и вирусов
- •68.Понятие о профаге и лизогении у бактерий
- •75. Анеуплоидия.
- •76. Транслокации.
- •77.Гетероплоидия
- •78. Генетические анамалии у с.Х. Животных
- •87. Типы наследственных аномалий
- •83. Генная инженерия
- •84. Практическое использование групп крови и полиморфных систем в животноводстве.
- •88. Генетический груз популяций
- •93.Методы получения трансгенных животных
52. Репликация днк
Репликация (удвоение) ДНК. ДНК находится в хромосомах, и репликация ее происходит перед каждым удвоением хромосом и делением клетки. Дж. Уотсон и Ф. Крик предложили схему удвоения ДНК, согласно которой спиралевидная двухцепочная ДНК сначала раскручивается (расплетается) вдоль оси. При этом водородные связи между азотистыми основаниями рвутся и цепи расходятся. Одновременно к нуклеотидам каждой цепи пристраиваются комплементарные азотистые основания нуклеотидов второй цепи, где против аденина встает тимин, против тимина — аденин, против гуанина — цитозин и т. д., которые с помощью ферментов ДНК-полимераз связываются в новые полинуклеотидные цепи. В результате из одной образуются две новые дочерние молекулы ДНК. Каждая дочерняя молекула, наследуя структуру одной цепи материнской молекулы, строго сохраняет специфичность заключенной в ней информации. Поскольку матрицей для репликации служит одна из двух цепей молекулы, такой тип синтеза ДНК носит название полуконсервативной ауторепродукции.
Дальнейшие исследования показали, что репликация бактериальных и других молекул ДНК начинается в определенной точке старта. В хромосомах эукариот обнаружено по нескольку таких начальных точек. Цепи ДНК в точке инициации репликации разъединяются под влиянием особого белка геликазы (рис. 19). Возникают одноцепочные участки ДНК, которые становятся матрицами для репликации-притяжения комплементарных нуклеотидов. Эти одноцепочные участки связываются с особыми белками, которые их стабилизируют (препятствуют их комплементарному взаимодействию). Особый фермент топоизомераза (у прокариот называется ДНК-гиразой) способствует расщеплению спирали ДНК в области репликационной вилки.
Репликация на материнской цепи, идущей от точки старта в направлении 5'->3', идет в виде сплошной линии. Эта цепь получила название лидирующей. Синтез на второй цепи 3'->5' идет отдельными фрагментами в противоположном направлении (тоже 5'-»3'). Эта цепь получила название запаздывающей. Фрагментами являются небольшие участки ДНК (у кишечной палочки около 2000 нуклеотидов, у эукариот около 200). Они называются по имени открывшего их японского ученого Р. Оказаки. После завершения синтеза фрагменты Оказаки соединяются при помощи фермента лигазы в общую полинуклеотидную цепочку. У эукариот репликация ДНК и соединение различных ее репликационных участков происходят в фазе S-периода интерфазы. После завершения этой фазы в каждой хромосоме имеется две молекулы ДНК, которые становятся двумя идентичными хроматидами.
Структура, способная к репликации (хромосома, плазмида, вирусный геном), называется репликоном.
Самоудвоение молекул ДНК — основа устойчивости генетической информации данного вида и обеспечивает материальную непрерывность наследственного вещества клетки.
57. Генетический код и его свойства.
Представление о том, что генетическая информация о структуре белковых молекул зашифрована в ДНК путем определенного расположения нуклеотидов, конкретизировал Ф. Крик в гипотезе последовательности, согласно которой последовательность элементов гена определяет последовательность аминокислотных остатков в полипептидной цепи. Было установлено, что наследственную информацию с ДНК считывает иРНК, которая образуется комплементарно одной из цепей ДНК. Однако не было известно, каким образом переводится нуклеотидная последовательность иРНК в аминокислотную последовательность полипептидной цепи. Можно было предположить, что генетический код не может состоять из одного или двух нуклеотидов, так как их только четыре и сочетаний из двух (43) может быть только 16, а аминокислот 20. Г. Гамов в 1954 г. впервые высказал мысль о том, что генетический код должен быть триплетным. В этом случае получается (43) 64 сочетания, и их вполне достаточно для кодирования всех аминокислот.
Начало экспериментальному анализу природы генетического кода положили М. Ниренберг и Дж. Маттеи в 1961 г. Они создали простейшие синтетические полимеры типа иРНК. Искусственно полученный полимер, содержащий только уридиновые нуклеотиды, в которых основанием является урацил, вводили в бесклеточную среду, полученную из кишечной палочки. В результате был получен полипептид, состоящий только из фенил-аланина — полифенилаланин. Кодон для фенилаланина был расшифрован как УУУ.
К расшифровке генетического кода активно подключился С. Очоа с сотр. В течение 3—4 лет в лабораториях М. Ниренбер-га и С. Очоа был определен состав большинства кодонов. Однако требовалось определить последовательность нуклеотидов в ко-донах. Это удалось сделать при помощи двух методов. Г. Корана с сотр. разработал метод химического синтеза ДНК-подобных полимеров с заданной последовательностью нуклеотидов, что позволяло получить РНК также с заранее известной последовательностью нуклеотидов и использовать ее в бесклеточной системе белкового синтеза. Второй метод предложили М. Ниренберг и П. Ледер, исходя из того, что промежуточными продуктами при синтезе белка являются аминокислоты, связанные с тРНК. Убедившись в том, что одного триплета иРНК (трех нуклеотидов) достаточно для связывания с рибосомой и тРНК, ученые использовали тринуклеотидные матрицы с известным чередованием оснований для того, чтобы изучить, какую аминокислоту доставит тРНК.
В результате использования методов, разработанных Г. Кора-ной, М. Ниренбергом и П. Ледером, к 1966 г. были определены все триплеты, кодирующие ту или иную аминокислоту. Триплет иРНК получил название кодона. Генетический код был полностью расшифрован (табл. 8), значит, была выяснена природа связи между структурой гена и соответствующего белка. Было установлено, что 61 триплет кодирует аминокислоты, 3 триплета не соответствуют никакой аминокислоте и определяют конец трансляции.
Выявлены следующие особенности генетического кода: 1) генетический код триплетный (каждая аминокислота кодируется тремя нуклеотидами); 2) неперекрывающийся (соседние триплеты не имеют общих нуклеотидов); 3) вырожденный (за исключением метионина и триптофана все аминокислоты имеют более одного кодона); 4) универсальный (в основном одинаков для всех живых организмов); 5) в кодонах для одной аминокислоты первые два нуклеотида, как правило, одинаковы, а третий варьирует; 6) имеет линейный порядок считывания и характеризуется колит-арностью, т. е. совпадением порядка расположения кодонов в иРНК с порядком расположения аминокислот в синтезирующейся полипептидной цепи.
Сравнительно недавно выяснилось, что в митохондриях нарушается универсальность генетического кода. Четыре кодона в митохондриях изменили свой смысл: кодон УГА отвечает триптофану, АУА — метионину, а кодоны АГА и АГТ стали терминирующими. В митохондриях синтезируется небольшое количество белков, которые используются ими же. Открытие новых кодонов у митохондрий может служить доказательством того, что код эволюционировал, что он не сразу стал таким, каким мы его знаем теперь.
53. Синтез белка
54 Транскрипция
55. Трансляция
56 роль рнк и в синтезе белка
СИНТЕЗ БЕЛКА В КЛЕТКЕ
В настоящее время можно считать установленным, что наследственность реализуется в процессе биосинтеза белка. Синтез ферментов и других белков, необходимых для жизнедеятельности и развития организмов, происходит в основном на первой стадии интерфазы, до начала репликации ДНК. В процессе синтеза белка различают этапы транскрипции и трансляции.
Транскрипция заключается в том, что наследственная информация, записанная в ДНК (гене), точно транскрибируется (переписывается) в нуклеотидную последовательность иРНК. Синтез иРНК начинается с участка инициации транскрипции, называемого промотором. Промотор расположен перед геном и включает около 80 нуклеотидов. У вирусов и бактерий этот участок включает около 10 нуклеотидов (один виток спирали). Транскрипция осуществляется с помощью ферментов РНК-полимераз. РНК-полимераза прочно связывается с промотором и «расплавляет» его, разъединяя нуклеотиды комплементарных цепей. Затем этот фермент начинает двигаться вдоль гена и по мере разъединения цепей ДНК на одной из них, которая является смысловой, ведет синтез иРНК, согласно принципу компле-ментарности присоединяя аденин к тимину, урацил к аденину, цитозин к гуанину и гуанин к цитозину. Те участки гена, на которых полимераза образовала иРНК, вновь соединяются, а синтезируемая молекула иРНК постепенно отделяется от ДНК. Конец синтеза иРНК определяется участком остановки транскрипции — терминатором. Нуклеотидные последовательности промотора и терминатора узнаются специальными белками, регулирующими активность РНК-полимеразы.
В 1977 г. было обнаружено, что у эукариот в последовательности нуклеотидов ДНК имеются отрезки, не содержащие информации, которые были названы интронами. Участки -ДНК, несущие информацию, называются экзонами.
При считывании информации с определенного участка ДНК (гена) сначала образуется транскрипт всей последовательности (про-мРНК), а затем происходит процесс созревания иРНК, называемый процессингом. При процессинге происходит сплайсинг, который заключается в том, что в ядре интроны из РНК как бы «выпетливаются» и удаляются, а информативные участки — экзо-ны соединяются при помощи ферментов лигаз в одну непрерывную последовательность иРНК. Перед выходом из ядра к начальной части иРНК (5'-концу) присоединяется остаток метилированного гуанина, называемый «колпачком», а к концу иРНК (З'-концу) присоединяется примерно 200 остатков адениловой кислоты. В таком виде зрелая иРНК (матричная РНК) проходит через ядерную мембрану в цитоплазму, где соединяется с рибосомой. Считают, что у эукариот «колпачок» иРНК играет роль в связывании с малой субчастицей.
Трансляция заключается в том, что последовательность расположения нуклеотидов в иРНК переводится в строго упорядоченную последовательность расположения аминокислот в молекуле синтезируемого белка. Процесс трансляции включает два этапа: активирование аминокислот и непосредственно синтез белковой молекулы.
Активирование свободных аминокислот и присоединение их к тРНК осуществляются при помощи ферментов аминоацил-тРНК-синтетаз. Точность процесса трансляции зависит, по-видимому, в значительной мере от того, с какой точностью каждая синтета-за выберет одну определенную аминокислоту и присоединит ее к соответствующей тРНК. Считается, что в молекуле каждой ами-ноацил-тРНК-синтетазы имеется по крайней мере три центра связывания: для аминокислоты, тРНК и АТФ. Сначала осуществляется связь аминоацил-тРНК-синтетазы с определенной аминокислотой, а затем активированная аминокислота присоединяется к акцепторному участку (ЦЦА) транспортной РНК. В результате образуется аминоацил-тРНК (аа-тРНК). Нагруженная аминокислотой тРНК взаимодействует с одним из белковых факторов, который в комплексе с ГТФ необходим для транспорта тРНК к рибосоме и связывания с ней.
В период трансляции происходит реализация генетической информации в процессе синтеза белковой молекулы определенной структуры. Синтез подразделяется на три стадии: инициации, элонгации и терминации.
Инициация. В период стадии инициации рибосома сначала представлена двумя отдельными субчастицами, так как для начала процесса необходима рибосома диссоциированная.
Инициация синтеза полипептидной цепи начинается с присоединения малой субчастицы рибосомы к соответствующему центру связывания на иРНК. Сигналом инициации трансляции служит кодон для метионина АУТ, который расположен в начале иРНК (рис. 21). К кодону АУГ своим антикодоном УАЦ присоединяется тРНК, нагруженная аминокислотой метионином (у бактерий инициаторной является тРНК, которая переносит фор-милметионин). Затем к комплексу, состоящему из малой субъединицы, иРНК и тРНК, присоединяется большая субъединица рибосомы. В результате образуется полностью собранная рибосома (80S), включающая одну молекулу иРНК и инициаторную тРНК с аминокислотой. В большой субъединице имеется аминоацильный и пептидильный центры. Сначала первая аминокислота (метио-нин) попадает в аминоацильный центр. В процессе присоединения большой субчастицы рибосомы иРНК продвигается на один кодон, тРНК из аминоацильного центра перемещается в пептидильный центр. В аминоацильный центр поступает следующий кодон иРНК, который может принять следующую аминоацил-тРНК. С этого момента начинается вторая стадия трансляции.
Элонгация. В эту стадию многократно повторяется цикл присоединения аминокислот к растущей полипептидной цепи. Так, в аминоацильный центр рибосомы строго в соответствии с кодо-ном иРНК поступает вторая нагруженная тРНК, которая своим

антикодоном соединяется с комплементарным кодоном иРНК. Сразу же при помощи фермента пептидилтрансферазы предшествующая аминокислота (метионин) своей карбоксильной группой (СООН) соединяется с аминогруппой (NH2) вновь пришедшей аминокислоты. Между ними образуется пептидная связь (—СО—NH—). В результате тРНК, принесшая метионин, освобождается, а в аминоацильном центре к тРНК присоединен уже дипептид. Для дальнейшего процесса элонгации требуется освободить аминоацильный центр. И он освобождается.
В результате процесса транслокации дипептидил-тРНК продвигается из аминоацильного центра в пептидильный. Это происходит благодаря перемещению рибосомы на один кодон при участии фермента транслоказы и белкового фактора элонгации. Освободившаяся тРНК и кодон иРНК, который был связан с ней, выходят из рибосомы. В освободившийся аминоацильный центр следующая тРНК приносит аминокислоту в соответствии с поступившим туда кодоном. Эта аминокислота при помощи пептидной связи соединяется с предыдущей. При этом рибосома снова продвигается еще на один кодон, и процесс повторяется. Полипептидный синтез в рибосоме идет до тех пор, пока в аминоацильный центр не поступит терминирующий кодон.
Терлшнация. После того как в аминоацильный центр рибосомы поступит терминирующий кодон иРНК (УАА, УАГ или УГА), к нему присоединяется один из белковых факторов терминации и блокируется дальнейшая элонгация цепи. Полипептидная цепь отделяется от тРНК и рибосомы, освобождаются тРНК и иРНК. Рибосомные субъединицы диссоциируют и могут принять участие в синтезе следующей полипептидной цепи.
На одной молекуле иРНК работает не одна рибосома, а многие (до 100). На каждой из рибосом строится полипептидная цепь. У бактерий транскрипция и трансляция связаны между собой и трансляция начинается до завершения синтеза иРНК на ДНК. Образующиеся при синтезе белка полипептидные цепи претерпевают постгрансляционные преобразования и в конечном итоге выполняют специфические функции, принимая участие в определении признаков организма.
66. Перенос генетического материала из одной клетки в другие
62.Трансформация
63.Трансдукция
64.Конъюгация у бактерий.
69. Использование процесса конъюгации
КОНЪЮГАЦИЯ
Конъюгация — перенос генетического материала от одной бактериальной клетки (донора) к другой (реципиенту) при их непосредственном контакте. Процесс конъюгации у бактерий обнаружили Дж. Ледерберг и Э. Татум в 1946 г. Они провели следующий эксперимент. Были отобраны два ауксотрофных мутантных штамма Е. coli К-12: не способный синтезировать метионин и биотин штамм Met" Bio~ и не способный синтезировать треонин и лейцин штамм Thr~ Leu~\ Оба штамма в течение ночи выращивали вместе на полноценной среде. Затем смешанную культуру центрифугировали, отмывали от полноценной среды и высевали на минимальную питательную среду. На минимальной питательной среде без метионина, биотина, треонина и лейцина появились прототрофные колонии Met+ Bio+ Thr+ Leu+ с частотой около 1 на каждые 107 клеток. Дополнительные опыты показали, что ни трансформации, ни трансдукции в данном случае не происходило. Из этого следовало, что образование рекомбинант-ных геномов происходило в результате контакта родительских клеток. Вскоре были получены микрофотографии конъюгирую-щих бактерий кишечной палочки, которые свидетельствов^али о том, что между бактериями при конъюгации образуется "цито-плазматический мостик.
В 1952 г. Хейс установил неравноценную роль родительских штаммов при конъюгации. Выяснилось, что один штамм является донором (мужским), другой — реципиентом (женским). Клетки-доноры обладают половым фактором F. Он является конъюгатив-ной плазмидой и представляет собой циркулярно замкнутую молекулу ДНК. Половой фактор F автономно существует в цитоплазме. Бактериальные клетки с фактором F обозначают F4", а не имеющие его — F~. В составе генома конъюгативной плаз-миды имеется tra-оперон, гены которого контролируют образование половых ворсинок (пилей) донорской клетки, необходимых для осуществления контакта с реципиентной клеткой, коныога-тивный перенос собственной плазмиды или хромосомной ДНК, а также репликацию автономной плазмиды.
Механизм переноса генетического материала при конъюгации из бактерии донора в бактерию реципиента показали В. Вольман и Ф. Жакоб. При конъюгации фактор F может перейти из мужской в женскую клетку и превратить ее в F4". Доноры F4" переносят довольно эффективно F-плазмиду во все клетки F~, a гены хромосомы — с низкой частотой (10~5).
Половой фактор F обладает способностью включаться в геном бактерии и тогда из цитоплазматической структуры превращается в фрагмент хромосомы. Клетки, в которых возникает этот процесс, образуют Hfr-штамм. Доноры Hfr переносят бактериальную хромосому с фиксированной точки — сайта интеграции плазмиды, ориентированным образом и с высокой частотой (10 2— 10 3). Интегрированный F-фактор переносится последним. Генетическим методом идентифицировано около 25—30 сайтов интеграции фактора F в хромосому. При конъюгации клетки-доноры F4" или Hfr соединяются с клетками-реципиентами F~~ при помощи конъюгационного мостика — особой протоплазматической трубки, образуемой клеткой F"1". В клетке донора Hfr под влиянием фермента эндонуклеазы в точке внедрения фактора F происходит разрыв цепи ДНК. Свободный конец одной из цепей ДНК постепенно начинает передвигаться через конъюгационный мостик в клетку реципиента (F~) и сразу же достраиваться до двух-цепочной структуры. На оставшейся в клетке-доноре цепи ДНК синтезируется вторая цепь.
Так как фактор F у разных штаммов Hfr включается в хромосому и разрывает ее в разных местах, переход хромосом в реци-пиентную клетку начинается с разных участков. Для переноса всей цепи ДНК в клетку реципиента требуется при 37 °С 100 мин, но конъюгационный мостик очень хрупкий, легко разрывается, и, как правило, вся цепь не успевает перейти. Поэтому с более высокой частотой передаются гены, расположенные около начальной 0-й точки хромосомы донора. Затем ДНК донора в гомологичных участках вступает в контакт с ДНК реципиента, и в результате кроссинговера некоторые участки одной цепи ДНК реципиента заменяются фрагментами ДНК донора.
Искусственное прерывание конъюгации через определенное время после начала скрещивания и выявление рекомбинантов дали возможность определить последовательность перехода разных генов донора в клетку F~. На основании определения времени передвижения фрагментов разной длины из клеток Hfr в клетки F~ было установлено расстояние между генами в минутах, что позволило построить карты хромосом.
В основе построения карт хромосом лежат последовательность расположения генов в хромосоме и расстояние между ними в минутах. Вся окружность хромосомы Е. coli составляет 100 мин. К настоящему времени на карту Е. coli К-12 нанесено более 1000 генов, что составляет около 30 % ее генетической емкости (рис. 23). Иногда включенный в хромосому Hfr половой фактор освобождается и при этом (подобно профагу) может захватить с собой прилегающий к нему участок ДНК бактерии. При конъюгации половой фактор вместе с фрагментом ДНК иногда переходит в женскую клетку, превращая ее в мужскую и передавая ей свойства, контролируемые фрагментом хромосомы донора. Процесс переноса генетической информации при помощи полового фактора называется сексдущией.
ТРАНСДУКЦИЯ
Трансдукция — перенос генов из одной бактериальной клетки в другую при помощи бактериофага. Впервые это явление установили в 1952 г. Н. Зиндер и Дж. Ледерберг. Они проводили исследования на патогенных для мышей бактериях Salmonella typhimurium. Были отобраны два штамма этих бактерий: штамм 22А ауксотрофный, не способный синтезировать триптофан (Т~), и штамм 2А, способный синтезировать триптофан (Т1"). Эти штаммы засевали в U-образную трубку, разделенную внизу бактериальным фильтром (рис. 24). В одно колено трубки засевали штамм 22А (Т~), в другое — штамм 2А (Г*). После определенного периода инкубации бактерии штамма 22А при посеве на минимальную питательную среду дали небольшое количество колоний (частота появления трансдуцированных клеток была равна 110~*). Это свидетельствовало о том, что некоторые клетки приобрели способность синтезировать триптофан. Каким же образом бактерии могли приобрести это свойство? Исследования показали, что штамм 22А был лизогенен по фагу Р-22. Этот фаг освобождался из лизоген-ной культуры, проходил через фильтр и лизировал штамм 2А. Присоединив часть генетического материала штамма 2А, фаг возвращался обратно и передавал этот генетический материал штамму 22А. Штамм 22А приобретал специфические наследственные свойства штамма 2А, в данном случае свойство синтезировать триптофан. Аналогичным образом могут быть трансдуцированы и другие признаки, в том числе способность к сбраживанию, устойчивость к антибиотикам и т. д.
Явление трансдукции установлено также у кишечной па- лочки и актиномицетов. Как правило, трансдуцируется один ген, реже два и очень редко три сцепленных гена. При переносе генетического материала заменяется участок молекулы ДНК фага. Фаг при этом теряет свой собственный фрагмент и становится дефектным. Включение генетического материала в хромосому бактерии реципиента осуществляется механизмом типа кроссинговера. Происходит обмен наследственным материалом между гомологичными участками хромосомы реципиента и материала, привнесенного фагом.
Различают три вида трансдукции: общую, или неспецифическую, специфическую и абортивную. При неспецифической трансдукции в период сборки фаговых частиц в их головку вместе с фаговой ДНК может включиться любой из фрагментов ДНК пораженной бактерии. В результате в реципиентные клетки могут переноситься различные гены бактерии донора. Неспецифическую трансдукцию могут осуществлять фаги Р-1 и Р-22 у эшерихий, шигелл и сальмонелл. При специфической трансдукции профаг включается в определенное место хромосомы бактерии и трансдуцирует определенные гены, расположенные в хромосоме клетки донора рядом с профагом. Например, фаг X (лямбда) в состоянии профага всегда включается в одно и то же место в хромосоме кишечной палочки и трансдуцирует локус, обусловливающий способность к сбраживанию галактозы. При отделении профагов от ДНК хозяина прилегающие к профагу бактериальные гены вместе с ним выщепляются из состава хромосомы, а часть генов профага остается в ее составе. Частота общей трансдукции составляет от 1 на 1 млн до 1 на 100 млн. Специфическая трансдукция происходит чаще.
Установлено, что фрагмент хромосомы донора, перенесенный в клетку реципиента, не всегда включается в хромосому реципиента, а может сохраняться в цитоплазме клетки. При делении бактерий он попадает только в одну из дочерних клеток. Такое состояние получило название абортивной трансдукции.
ТРАНСФОРМАЦИЯ
Трансформация — поглощение изолированной ДНК бактерии донора клетками бактерии реципиента. Явление трансформации кратко освещено при изложении доказательств роли ДНК в наследственности. В процессе трансформации принимают участие две бактериальные клетки: донор и реципиент. Трансформирующий агент представляет собой часть молекулы ДНК донора, которая внедряется в геном реципиента, изменяя его фенотип. В процессе трансформации клетки донора и реципиента не соприкасаются друг с другом. Механизм переноса генетического материала заключается в том, что из клеток донора выделяются в окружающую среду молекулы или фрагменты молекул ДНК. Сначала эта ДНК адсорбируется на оболочке клетки реципиента. Затем через определенные рецепторные участки ее стенки при помощи специальных клеточных белков ДНК втягиваются внутрь клетки. Проникающая донорская ДНК должна быть двух-цепочной. В реципиентной клетке она становится одноцепоч-ной. В ДНК реципиента включается одна из цепей трансформирующего фрагмента. Эта цепь вступает в синапсис с гомологичным участком хромосомы реципиента и встраивается в нее посредством кроссинговера. При этом участок ДНК реципиента замещается фрагментом донора. Молекула ДНК со вставкой трансформирующего участка оказывается гибридной. При следующем удвоении возникают одна нормальная дочерняя молекула ДНК, другая — трансформированная. Установлено, что способность бактерий-реципиентов к трансформации определяется их физиологическим состоянием. Такое физиологическое состояние было названо компетентностью. Состояние компетентности краткосрочно и приурочено к определенному времени клеточного цикла. Было обнаружено, что трансформирующей способностью обладают только крупные молекулы ДНК с молекулярной массой не менее 5-Ю5 Д. У бактерий трансформация имеет место чаще в пределах одного вида, но наблюдается и между разными близкими видами. Это указывает на то, что у них сохранилась гомологичность некоторых участков ДНК.
Изучение процессов рекомбинации у бактерий имеет важное значение для ветеринарного врача, так как ведет к пониманию причин высокой изменчивости бактерий, их способности к приобретению свойств патогенное™, устойчивости к лекарственным веществам.
70.Мутационная измечивость.
71.Виды мутации
72. Геномные мутации
73. Хромосомные мутации.
74. Генные мутации
Геномные мутации – изменения числа хромосом. Они могут быть вызваны нерасхождением хромосом при мейозе, что приводит к появлению у гает нового набора хромосом. Геномные мутанты могут быть представлены гаплоидами(в два раза меньше хромосом), анеуплоидами (с лишней или недостабщей хромосомой), полиплоидами (с кратным увелечением числа хромосом)
МУТАЦИОННАЯ ИЗМЕНЧИВОСТЬ.
В предыдущих главах отмечено одно из основных свойств кариотипа, ДНК и ее участков (генов) — сохранять постоянство внешнего и внутреннего строения. Морфофункциональная устойчивость генетического материала обеспечивает передачу всей совокупности наследственных признаков каждой особи последующим поколениям и является основой для сохранения видовых признаков на протяжении многих сотен лет. Однако такая стабильность относительна. В силу действия внутренних и внешних факторов в генетическом материале возникают изменения — мутации, определяющие мутационную изменчивость.
Мутациями называют стойкие изменения в структуре ДНК и кариотипе. Этот термин впервые предложил ботаник Гуго де Фриз для обозначения внезапно возникающих наследуемых изменений у растений. Большой вклад в развитие теории мутаций внесли отечественные ученые С. И. Коржинский, Н. В. Тимофеев-Ресовский, А. С. Серебровский, Н. П. Дубинин, М. Е. Лобашов и др.
Мутации у животных происходят постоянно с определенной частотой и скоростью. Процесс образования их получил название мутагенеза. Мутации, возникающие в естественных условиях, называют спонтанными, искусственно вызванные — индуцированными. Те и другие могут возникать как в генеративных, так и в соматических клетках. Мутации, возникающие в половых клетках, передаются в последующие поколения. Соматические мутации не наследуются. Они влияют только на признаки самого мутантного животного.
КЛАССИФИКАЦИЯ МУТАЦИЙ
Основные типы мутаций — изменения в числе или структуре хромосом — хромосомные мутации, в структуре ДНК —генные (точковые) мутации.
Хромосомные и генные мутации, как правило, вызывают у животных нарушения жизнеспособности, плодовитости, снижение устойчивости к болезням, продуктивности и другие вредные последствия. Это связано с тем, что они приводят к нарушению процессов деления клеток, нормального распределения хромосом между ними, изменяют ход синтеза белков, ферментов и т. д.
ХРОМОСОМНЫЕ МУТАЦИИ
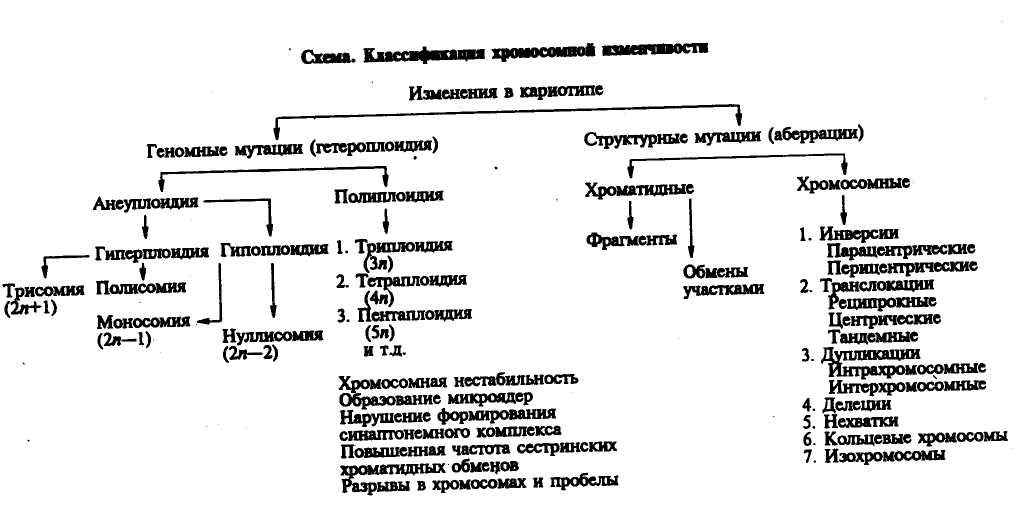
Изменения кариотипа могут быть количественными, структурными и одновременно теми и другими. Рассмотрим отдельные формы изменения хромосом (см. схему).
Числовые мутации кариотипа. Эта группа мутаций связана с изменением числа хромосом в кариотипе. Количественные изменения в хромосомном составе клеток называют геномными мутациями. Они подразделяются на гетерогаюидию, анеуплоидию, полиплоидию.
Гетероплоидия обозначает общее изменение числа хромосом по отношению к диплоидному полному набору.
Об анеуплоидии говорят в тех случаях, когда число хромосом в клетке увеличено на одну (трисомия) или более (полисемия) или уменьшено на одну (моносомия). Употребляют также термины «гиперплоидия» и «гипоплоидия». Первый из них означает увеличенное число хромосом в клетке, а второй — уменьшенное.
Полиплоидией называют увеличение числа полных хромосомных наборов в четное или нечетное число раз. Полиплоидные клетки могут быть тригогоидньщи, тетраплоидными, пентаплоид-ными, гексаплоидными и т. д.
Структурные мутации хромосом. Эта группа мутаций связана с изменением формы, размеров хромосом, порядка расположения генов (изменение групп сцепления), утратой или добавкой отдельных фрагментов и т. д. Изменения структуры одной или нескольких хромосом называют хромосомными мутациями. Установлено несколько типов структурных мутаций хромосом.
Транслокации — перемещения отдельных фрагментов хромосом из одного участка в другой, обмены фрагментами между разными хромосомами, слияния хромосом. При взаимных обменах фрагментами между гомологичными или негомологичными хромосомами возникают транслокации, называемые реципрокными. Если целое плечо одной хромосомы присоединяется к концам другой хромосомы, такой тип транслокаций называют тандемным. Слияние двух акроцентрических хромосом в области центромер формирует транслокацию робертсоновского типа и образование мета-и субметацентрических хромосом. При этом обнаруживается элиминация блоков прицентромерного гетерохроматина.
Инверсии — внутрихромосомные аберрации, при которых фрагменты хромосом разворачиваются на 180°. Различают пери-и парацентрические инверсии. Если перевернутый фрагмент содержит центромеру, инверсия называется перицентрической.
Делеции — потеря срединного фрагмента хромосомы, в результате ^чего она укорачивается.
Нехватки — потеря концевого фрагмента хромосомы.
Дупликация — удвоение фрагмента одной хромосомы (интра-хромосомные дупликации) или разных хромосом- (интерхромосомные дупликации).
Кольцевые хромосомы формируются при наличии двух концевых разрывов (нехваток).
Изохромосомы возникают, если в противоположность нормально-. му делению хроматид в длину происходит горизонтальное (поперечное) деление хромосомы в центромере с последующим слиянием гомолргичных плеч в новую хромосому — изохромосому. Ее проксимальные и дистальные участки идентичны по строению и составу генов. В зависимости от того, сколько хроматид изменено (одна или две), структурные аномалии подразделяются на хромосомные и хро-матидные. На рисунке 34 приведены схемы образования различных типов структурных изменений хромосом или аберраций.
ГЕННЫЕ МУТАЦИИ
По характеру действия генные мутации могут быть доминантными или рецессивными. Чаще мутантный ген обладает рецессивным эффектом. Нормальный аллель подавляет при этом действие измененного гена. По характеру влияния мутантных генов на контроль биосинтеза белков и ферментов выделяют пять типов мутаций: гипоморфные, гиперморфные, антиморфные, неоморф-ные и аморфные.
Если ген мутирует в рецессивное состояние, то для мутантно-го аллеля чаще всего характерно уменьшение количества того же самого биохимического продукта, синтез которого определяется исходным доминантным аллелем данного гена. Такие мутации называют гжоморфными. При гиперморфных генных мутациях в отличие от гипоморфных количество биохимического продукта, синтезируемого под контролем данного гена, не уменьшается, а увеличивается. К антиморфным генным мутациям относятся мутации, при которых мутантный аллель вызывает образование продукта, тормозящего синтез или действие продукта исходного аллеля этого гена. Неоморфные генные мутации характеризуются тем, что мутантный аллель определяет синтез в организме биохимического продукта, отличающегося от продукта, специфичного для исходного немутантного аллеля и не взаимодействующего с этим продуктом. Иногда в организме в результате данной мутации перестает вырабатываться продукт, характерный для данного гена, т. е. ген полностью инактивируется. Такая мутация называется аморфной.
Генные мутации могут представлять дефекты репликации, спирализации, репарации ДНК, посттрансляционные нарушения синтеза структурных белков и т. д.