
Лекция 12. S- и р - элементы таблицы Д.И. Менделеева.
К s-элементам относятся элементы главных подгрупп I и II групп периодической системы. В главную подгруппу I группы входят следующие элементы: литий, натрий, калий, рубидий, цезий и франций. Все эти элементы получили название щелочных металлов, т.к. их гидроксиды – это самые сильные основания, т.е. щелочи. Главная подгруппа II группы состоит из бериллия, магния, кальция, стронция, бария и радия. Последние четыре элемента, из древня, получили название щелочноземельные.
Все эти элементы относятся к активным металлам, т.к. их внешние электронные оболочки содержат по одному (I группа) и по два (II группа) электрона. В этом отношении элементы каждой подгруппы являются электронными аналогами, т.е. обладают близкими свойствами. Однако строение предвнешней электронной оболочки атомов, определяет незначительные различия их свойств.
Все эти осадочные породы интенсивно обогащают природные войдоемы солями магния и кальция, наличие которых в воде определяет ее жесткость. Горные породы разрушаются под действием углекислоты, растворенной в природной воде. Содержание ионов кальция и магния в природных водах зависит от типа окружающих почв, сезона года и площади водосбора.
![]()
Именно катионы кальция и магния придают специфические свойства природным водам. При стирке белья жесткая вода ухудшает качество тканей и требует повышенных затрат мыла, которое расходуется на связывание катионов кальция и магния:
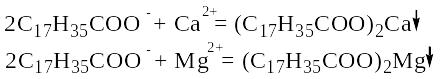
Пена в мыльном растворе образуется только после осаждения этих катионов.
Ионы кальция и магния в природной воде могут быть связаны с различными анионами, поэтому различают:
Временная или карбонатная жесткость воды – обусловлена наличием гидрокарбонатов кальция и магния.
Постоянная или некарбонатная жесткость воды – обусловлена наличием хлоридов, сульфатов, нитратов и фосфатов кальция и магния.
Сумма этих жесткостей называется общей жесткостью воды.
Обозначается жесткость Ж и измеряется в мэкв/л. Рассчитывается жесткость по следующей формуле:
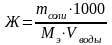
Для определения общей жесткости воды применяют комплексометрический метод с применением трилона Б (двунатриевая соль этилендиаминтетрауксусной кислоты). В зависимости от величины значения общей жесткости воды подразделяют на:
до 4 мэкл/л – мягкая вода;
4 - 8 мэкл/л – умеренно-жесткая вода
8 – 12 мэкл/л – жесткая вода
выше 12 мэкл/л – очень жесткая вода.
Вода, применяемая для производственных целей (в паровых котлах, циркуляционных трубах, в холодильных установках и т.д.), не должна быть жесткой, иначе оборудование очень быстро выйдет из строя из-за образующейся накипи. Для устранения жесткости, т.е. для умягчения воды применяют различны методы – термические, химические и физико-химические.
1) термические методы основаны на нагревании воды, ее дистилляции или вымораживании. Этим методом устраняется только временная жесткость воды.
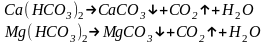
Но свежеобразованный карбонат магния при нагреве подвергается полному гидролизу с образованием гидроксида магния.
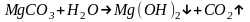
Однако, получаемый углекислый газ является вредным для металлических конструкций и требует своевременного удаления.
2) реагентные методы основаны на связывании находящихся в воде ионов кальция и магния в практически нерастворимые соединения. К наиболее распространенным реагентным методам умягчения воды относятся известкование, известково-содовый метод, содово-натриевый методы, а также фосфатирование.
3) методы ионного обмена основаны на фильтровании воды через специальные материалы, обменивающие входящие в их состав ионы натрия или водорода на ионы кальция или магния, содержащиеся в природной воде. Такие ионообменных материалов, называются ионитами.
К ионообменным материалам (ионитам) относятся различные ионообменные смолы, сульфоуголь и т.д. в зависимости от того, какие ионы обмениваются (катионы или анионы) различают катиониты и аниониты.
Если пропустить жесткую воду последовательно через катионит, а затем через анионит, то можно получить дисциллированную воду.

Использованные катиониты и аниониты регенерируются, после чего их можно применять вновь.
4) комбинированные методы представляют собой сочетания вышеперечисленных методов.
Элемент алюминий был открыт в 1825 году датским ученым Г.К.Эрстедом. Алюминий имеет плотность =2,7 г/см3, температуру плавления tпл =659С, высокую пластичность и высокую электропроводность. Чистый алюминий мало пригоден для использования в конструкциях. На воздухе покрывается плотной и прочной оксидной пленкой Al2O3. Алюминий применяется в сплавах, обладающих повышенной механической прочностью, а также в качестве конструкционного металла в строительстве.
Химические свойства алюминия
1. Оксид алюминия растворяется в щелочах.
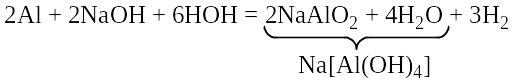
Выделение водорода происходит при взаимодействии порошка алюминия с цементом и известковыми растворами, что используется в производстве газобетонов:
![]()
2. Взаимодействие с кислотами. На технический алюминий не действуют сильно разбавленные азотная, серная, уксусная и фосфорная кислоты. Концентрированные азотная и серная кислоты пассивируют алюминий, а при средней концентрации - растворяют его.
3. Металлический алюминий является очень сильным восстановителем. Его используют для получения хрома, марганца, ванадия из их оксидов (алюминотермия). Порошкообразный алюминий в смеси с порошкообразными оксидами других металлов, при высокой температуре способен восстанавливать их с выделением большого количества тепла. Такие смеси называются термитами.
![]()
Соединения алюминия
Глинозем (Al2O3) – белый порошок, tпл =2042С, в воде не растворяется. Природный минерал корунд (тоже Al2O3) очень твердый, поэтому используется как абразивный и огнеупорный материал.
Глинозем Al2O3 получают термическим разложением гидроксида алюминия:
![]()
В промышленности глинозем получают из бокситов и нефелинов, а также из каолинов. Большая часть глинозема используется для получения алюминия.
Алюминаты
–
соли слабых кислот. Они подвергаются
гидролизу и существуют в растворе только
в избытке щелочи. При этом возможно
образование ортоалюминатов типа
![]() .
.
Распространение кремния и методы его получения
Элемент кремний был открыт Ж. Гей-Люссаком и Л.Тенаром в 1811году и является вторым по распространенности элементом в земной коре (27,6% по массе). Кремний встречается в природе в виде свободного диоксида кремния SiO2 (кремнезема).
Природный SiO2 служит исходным сырьем для получения всех остальных соединений кремния. В элементарном состоянии кремний может быть выделен восстановлением оксида кремния при высокой температуре такими металлами, как магний или алюминий, а также углеродом.
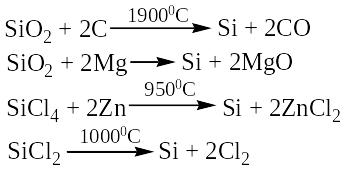
Свойства и применение кремния
Кристаллический кремний представляет собой темно-серое вещество с металлическим блеском, большой твердостью, ρ = 2,33 г/см3, tпл =1415?C; tкип = 2680?C. Кристаллический кремний имеет алмазоподобную структуру (sp3- гибридизация атомов кремния) и образует прочные ковалентные σ-связи. Кристаллический кремний, как типичный неметалл, инертен. Электронная формула кремния имеет вид: Si 1s22s22p63s23p2.
Аморфный кремний представляет собой бурый гигроскопичный порошок с алмазоподобной структурой, ρ = 2 г/см3. Аморфный кремний является более реакционноспособным, по сравнению с кристаллическим.
Соединения кремния
Наиболее стойким соединением кремния является диоксид кремния SiO2 (кремнезем). В природе он встречается как в кристаллическом, так и в аморфном виде.
Кристаллический диоксид кремния (кремнезем) находится в природе главным образом в виде песка и кварца. Он очень тверд, нерастворим в воде и плавится при температуре около 1610?С, превращаясь в бесцветную жидкость. Аморфный диоксид кремния (кремнезем) распространен в природе гораздо меньше, чем кристаллический. На дне морей имеются отложения тонкого пористого аморфного кремнезема.
При сплавлении диоксида кремния с едкими щелочами или карбонатами калия и натрия получаются соли кремниевых кислот:
![]()
Аморфный кремнезем взаимодействует со щелочами и гашеной известью на холоду. На этом свойстве основано применение этих материалов в качестве гидравлических добавок к цементам.
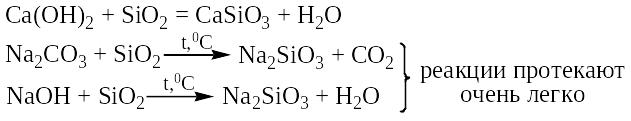
Кремнезем, находящийся в природе в виде песка, широко применяют в строительстве для производства стекла, керамики и цемента.
