Соединения бериллия ядовиты!
Соединения бериллия (II). Большинство неорганических соединений бериллия (II) в обычных условиях полимерны и являются кристаллическими веществами белого цвета. Независимо от типа кристаллических решеток соединений координационное число бериллия 4.
В кислых водных растворах ионы Ве2+ находятся в виде прочных аквокомплексов [Ве(ОН2)4]2+ в сильно щелочных растворах — в виде ионов [Ве(ОН)4]2—.
Оксид ВеО имеет структуру типа вюрцита, отличается высокой энергией кристаллической решетки и высокой энергией Гиббса образования (Gof = —582 кДж/моль). Он тугоплавок (Т пл. 2530 оС), теплопроводен; предварительно прокаленный (при 400 °С) химически неактивен. Применяют ВеО в качестве химически стойкого и огнеупорного материала для изготовления тиглей и специальной керамики, а в атомной энергетике — как замедлитель и отражатель нейтронов. ВеО входит в состав некоторых стеклообразующих смесей.
Будучи амфотерным, ВеО взаимодействует при сплавлении и с основными, и с кислотными оксидами:
BeO + SiO2 = BeSiO3 BeO + Na2O = Na2BeO2
основный кислотный
При нагревании ВеО взаимодействует с кислотами и щелочами:
ВеО + 2ОН3+ + Н2О = [Be(OH2)4]2+ и BeO + H2O + 2OH- = [Be(OH)4]2—
основный кислотный
Г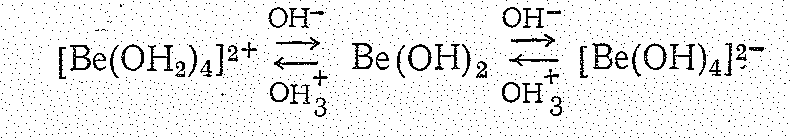 идроксид
Ве(ОН)2
— полимерное соединение, в воде не
растворяется. Получение гидроксида
бериллия и его отношение к кислотам и
щелочам можно выразить следующей
суммарной схемой:
идроксид
Ве(ОН)2
— полимерное соединение, в воде не
растворяется. Получение гидроксида
бериллия и его отношение к кислотам и
щелочам можно выразить следующей
суммарной схемой:
Как показывает схема, в кислых средах (избыток ионов гидроксония - ОН3+) устойчивы аквокомплексы бериллия (II), в щелочных (избыток ионов ОН-) — гидроксобериллат (II)-комплексы. При кристаллизации соединений из кислых водных растворов аквокомплексы переходят в состав кристаллогидратов с четырьмя молекулами воды: ВеSО44Н2О, ВеСl24Н2О, Ве(NО3)24Н2О и др. Выделение кристаллогидратов с меньшим или большим количеством молекул воды свидетельствует об образовании производных многоядерных комплексов.
В следствие
относительно высокого поляризующего
действия иона Ве2+
его соли подвергаются заметному
гидролизу:
следствие
относительно высокого поляризующего
действия иона Ве2+
его соли подвергаются заметному
гидролизу:
В зависимости от концентрации раствора и типа присутствующих в растворе анионов механизм гидролиза может оказаться существенно различным. В частности, образующиеся при гидролизе гидроксоаквокомплексы [Ве(ОН)(ОН2)3]+ затем полимеризуются в многоядерные комплексы, например [Ве3(ОН)3(ОН2)6]3+ вероятно, следующего строения:
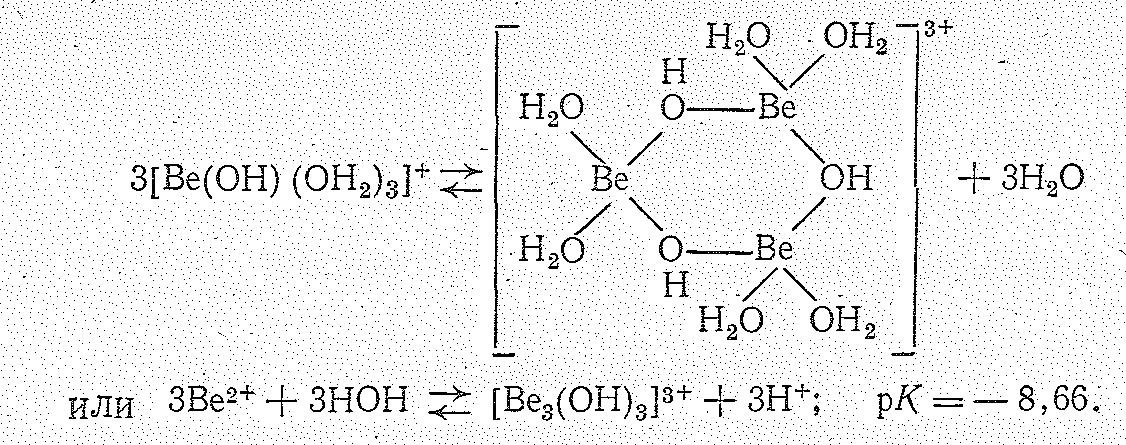
При связывании ионов ОН3+ (например, анионами СО32-, SН-) полимеризация может идти вплоть до образования полимерного гидроксида:
BeS + 2H2O = Be(OH)2 + H2S
Гидроксобериллаты в водных растворах существуют лишь при большом избытке щелочи, в противном случае они полностью гидролизуются. Растворимы только бериллаты s-элементов I группы.
Сульфид бериллия ВеS — кристаллическое вещество со структурой типа сфалерита. Образуется взаимодействием простых веществ (при 1350 °С) или взаимодействием металла с Н2S. В горячей воде ВеS полностью гидролизуется. Амфотерная природа ВеS проявляется при его сплавлении с основными и кислотными сульфидами:
Na2S + BeS = Na2BeS2 BeS + SiS2 = BeSiS3
Сульфидобериллаты (II) водой разрушаются.
Из галогенидов бериллия наибольшее значение имеют фторид и хлорид. Дифторид ВеF2 существует в нескольких модификациях, аналогичных по структуре соответствующим модификациям диоксида кремния SiО2. Как и кремнезем, ВеF2 легко переходит в стеклообразное состояние. Стекловидный ВеF2 получают термическим разложением (NН4)2ВеF4. Другие галогениды Ве(II) также полиморфны. Одна из модификаций ВеСl2 имеет волокнистое строение:
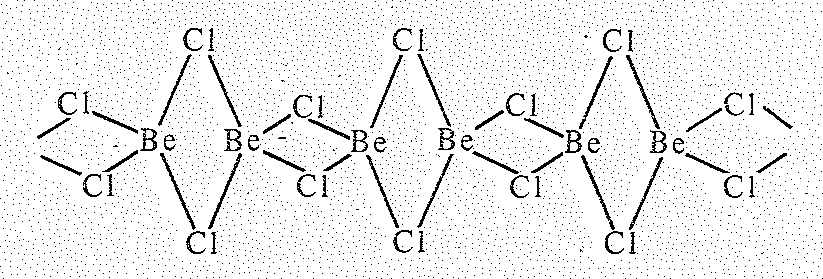
Вследствие координационной структуры температура плавления соответствующих модификаций ВеF2 выше (~ 800 °С), чем остальных галогенидов Ве(II) (~450 оС). Галогениды ВеСl2, ВеВr2, ВеI2 гигроскопичны и на воздухе расплываются; при их растворении в воде выделяется тепло; они растворимы также в органических растворителях.
Амфотерность ВеНаl2 наиболее отчетливо проявляется у фторида. Так, при нагревании BеF2 с основными фторидами образуются фторобериллаты, например:
2КF + ВеF2 = К2[ВеF4]
При взаимодействии BеF2 с кислотными фторидами образуются соли бериллия:
ВеF2 + SiF4 = Ве[SiF6]
Тетрафторобериллаты по кристаллической структуре и растворимости во многом напоминают однотипные тетраоксосулъфаты, что объясняется одинаковой тетраэдрической структурой и близкими размерами ионов ВеF42- и SO42-. Кроме ВеF42- -иона возможны полимерные фторобериллат-ионы, например, типа
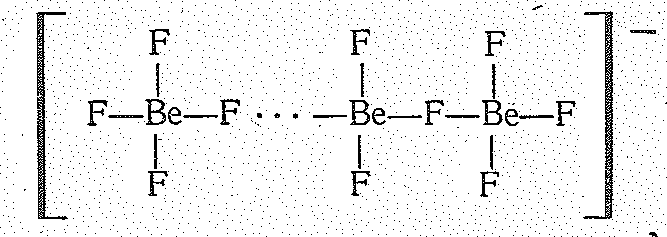
Из подобных цепных анионов построен, например, NаBеF3.
Структурное сходство между BеF2 и SiO2 распространяется и на их производные. Полимерные фторобериллаты по структуре аналогичны оксосиликатам, например NаВеF3 имеет одинаковое строение с СаSiО3; Nа2ВеF4 с Са2SiO4, NаLiВеF4 с СаМgSiO4, Li2BеF4 с Zn2SiO4 и т. д. Сходны также диаграммы плавкости соответствующих систем. Полимерные фторобериллаты могут находиться в стеклообразном со стоянии.
Другие галогенобериллаты не характерны.
Присущая бериллию как амфотерному элементу склонность образовывать катионные и анионные комплексы проявляется и при расплавлении его соединений. Так, расплавленный ВеСl2 состоит из ионов ВеСl+ и ВеСl3-:
ВеСl2 + ВеСl2 ВеСl+ + ВеСl3-
основный кислотный
Так же ведут себя при расплавлении соединения и других амфотерных элементов, напри мер:
2АlСl3 АlСl2+ + АlСl4- 2ТаСl5 ТаСl4+ + ТаСl6-
Таким образом, и в этом случае амфотерные элементы не образуют простых ионов, а лишь комплексные. Однотипные же соединения металлических элементов при этом распадаются на слабо сольватированные простые ноны, например:
СаСl2 Са2+ + 2Сl-
В соответствии со сказанным расплавленные соединения металлических элементов проявляют высокую, а амфотерных элементов – пониженную электрическую проводимость.
Нитрид Ве3N2 кристаллическое вещество, получается при нагревании бериллия в атмосфере азота (выше 1000 °С). Бесцветен, очень тверд, тугоплавок (T пл. 2200 °С). Разлагается водой при нагревании:
Ве3N2 + 6Н2O = 3Ве(ОН)2 + 2Н3N
При действии кислот разложение протекает достаточно активно.
Об амфотерном характере Ве3N2 свидетельствует существование смешанных нитридов, например ВеSiN2 и LiВеN, которые можно рассматривать соответственно как нитридосиликат (IV) бериллия и нитридобериллат (II) лития.
Гидрид ВеН2 — твердое полимерное вещество, по свойствам подобное AlH3. При его разложении водой выделяется водород. Сильный восстановитель. Гидрид бериллия (Gof = 115,7 кДж/моль) из простых веществ не образуется. Его можно получить взаимодействием ВеСl2 с LiН в эфирном растворе:
ВеСl2 + 2LiН = ВеН2 + 2LiСl
Соли бериллия и кислородсодержащих кислот выделяются из растворов обычно в виде кристаллогидратов, которые по структуре и свойствам, естественно, существенно отличаются от безводных производных. Большинство солей бериллия растворимо в воде, нерастворимы ВеСО3, Ве(РО4)2 и некоторые другие. Для бериллия весьма характерны двойные соли — бериллаты со сложными лигандами, например:
Nа2SО4 + ВеSО4 = Nа2[Ве(SО4)2]
(NН4)2СO3 + ВеСО3 = (NН4)2[Ве(СО3)2]
За счет последней реакции нерастворимый в воде BеСО3 растворяется в насыщенных растворах карбонатов s-элементов I группы или аммония. В разбавленных растворах эти бериллаты разлагаются.
Магний
Магний заметно отличается от бериллия размерами атома и иона (радиусы ионов Ве2+ и Mg2+ соответственно равны 0,034 и 0,078 нм). От своего соседа по периоду — алюминия — магний отличается меньшим числом валентных электронов и относительно большим размером атома. Таким образом, у магния металлические признаки проявляются сильнее, чем у бериллия и алюминия. В частности, для магния менее характерно образование ковалентной связи, чем для бериллия и алюминия, и более характерно образование ионной связи. В этом отношении он ближе к типичным металлическим элементам — элементам подгруппы кальция.
Магний — один из наиболее распространенных элементов на Земле (2,0 мол. доли, %). В природе находится в виде трех стабильных изотопов: 24Mg (78,6%), 25Mg (10,11%) и 26Mg (11,29%). Получены искусственные изотопы. Магний входит в состав силикатных минералов (среди них преобладает оливин Мg2SО4, карбонатных минералов — доломита СаMg(CO3)2, магнезита MgСО3. Важное техническое значение имеет минерал карналлит КСlМgСl26H2О. Большое количество магния содержится в морской воде (до 0,38% МgСl2) и в воде некоторых озер (до 30% МgСl2).
Простое вещество. Магний в виде простого вещества — белый металл (пл. 1,74 г/см3, Т пл. 651 °С, Т кип. 1107 °С), на воздухе окисляется и приобретает матовый оттенок. Он мягче и пластичнее бериллия.
Магний активный металл. Легко взаимодействует с галогенами; при нагревании сгорает на воздухе, окисляется серой и азотом, С соответствующими металлами образует эвтектические смеси, твердые растворы и интерметаллические соединения, которые входят в состав его сплавов. Наиболее важный сплав магния — электрон (3—10% Аl, 0,2—3% Zn, остальное Мg), который благодаря его прочности и малой плотности (1,8 г/см3) применяют в ракетной технике и авиастроении.
В ряду напряжений магний расположен перед водородом (Еo298 = —2,36 В). С холодной водой взаимодействует очень медленно, так как образующийся при этом Мg(ОН)2 плохо растворим; при нагревании реакция ускоряется за счет растворения Мg(ОН)2; в кислотах растворяется очень энергично, за исключением кислот (НF, Н3РO4), образующих с ним малорастворимые соединения. Со щелочами магний практически не взаимодействует.
Основную массу производимого магния получают электролизом расплавленного карналлита или дихлорида магния, в который для понижения температуры плавления (до 720—750 °С) добавляют NаСl или другие хлориды. Магний отлагается на катоде, выделяющийся на аноде Сl2 используется для получения МgСl2. Магний получают также металлотермическим и углетермическим методами. При металлотермическом методе восстанавливают в электропечах (при 1200—1300 °С) в вакууме прокаленный доломит СаОМgО ферросилицием или алюмосилицием:
2 (СаОМgО) + Si = Са2SiO4 + 2Мg
При углетермическом методе магний получают восстановлением Мg углем в электропечах (при 2100 °С). Для получения чистого магния (99,999% М) технический магний многократно сублимирую в вакууме.
Магний в основном используется для производства «сверхлегких» сплавов, в металлотермии — для производства Тi, Zr, V, U и др. Смеси его порошка с окислителями применяются для осветительных и зажигательных ракет, снарядов, в фото- и осветительной технике.
Соединения магния (II). Во всех устойчивых соединениях степень окисления магния +2, а координационное число 6. Степень окисления +2 часто проявляется также и в интерметаллических соединениях например Mg3Аl2, Мg3Sb2, Мg2Рb. Бинарные соединения Мg в зависимости от природы более электроотрицательного элемента могут быть соединениями от преимущественно металлических до преимущественно ионных. Так, в ряду соединений магния с р-элементами 3-го периода
п роисходит
постепенное уменьшение доли металлической
и увеличение доли ионной связи. Например.
Мg3Аl2
— типично металлическое соединение, а
МgСl2
—преимущественно ионное. Об этом
свидетельствуют повышение в рассматриваемом
ряду энтальпий образования соединений
и характер изменения координационных
чисел в кристаллах.
роисходит
постепенное уменьшение доли металлической
и увеличение доли ионной связи. Например.
Мg3Аl2
— типично металлическое соединение, а
МgСl2
—преимущественно ионное. Об этом
свидетельствуют повышение в рассматриваемом
ряду энтальпий образования соединений
и характер изменения координационных
чисел в кристаллах.
По химической природе соединения магния (II) — преимущественно основные. Некоторые из них, например МgСl2, МgSО4, Мg(NО3)2, в обычных условиях гидролизу не подвергаются, другие создают слабощелочную среду.
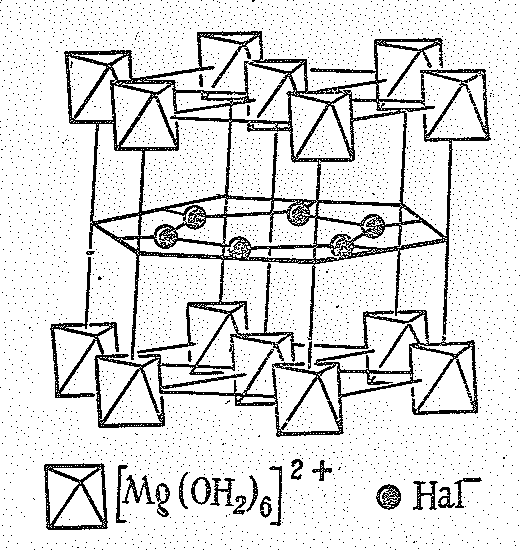
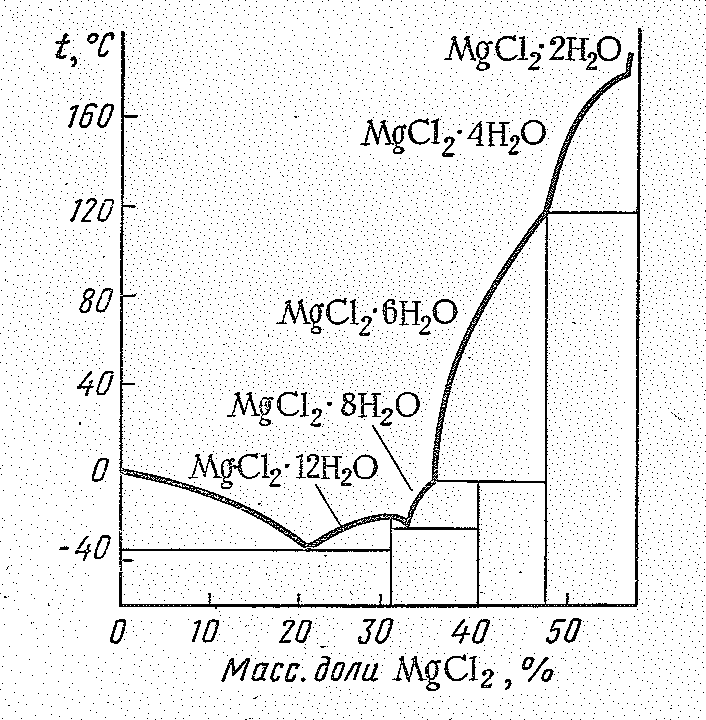
Большинство солей-Мg (II) растворимы в воде. Плохо растворимы соли слабых кислот (Мg3(РО4)2, MgСО3, МgF2). В водных растворах ионы Мg2+ находятся в виде бесцветных гексааквокомплексов [Мg(ОН2)6]2+, которые входят в состав ряда его кристаллогидратов: МgСl26Н2О, Мg(NО3)26Н2О, Мg(СlО4)26Н2O, МgSiF66Н2O и др. Структура гексагидрата дихлорида магния МgСl26H2O (минерал бишофит) показана на рис. 3. Существуют также кристаллогидраты с 1—12 молекулами воды (рис. 4).
|
|
|
Рис. 3 Структура бишофита МgСl26H2O |
Рис. 4. Диаграмма состояния системы H2O – МgСl2 |
|
Безводные соли Mg (II) весьма гигроскопичны, в особенности Мg(СlО4)2, который энергично поглощает влагу (до 60% от своей массы). Вследствие чрезвычайной гигроскопичности Мg(СlО4)2 (под названием ангидрон) широко используется для осушки газов (Н2, СО2, O2, Н2S и др.).
Анионные комплексы для Mg (II) не характерны, но весьма разнообразны двойные соединения типа смешанных карбоната СаСО3МgCO3 (доломит), нитрида Li3NMg3N2 (LiМgN) и др. Весьма характерны также кристаллогидраты типа КСlМСl26Н2O (карналлит).
Оксид МgО (жженая магнезия) — тугоплавкое (T пл. 2800 °С) вещество. В технике его получают термическим разложением карбоната:
MgCO3 MgO + CO2
Мелкокристаллический МgО химически активен, является основным соединением. Он взаимодействует с водой, поглощает CO2, легко растворяется в кислотах. Но сильно прокаленный МgО становится очень твердым, теряет химическую активность.
Жженую магнезию применяют в производстве магния, в качестве наполнителя в производстве резины, для очистки нефтепродуктов, в производстве огнеупоров, строительных материалов и др.
Гидроксид Мg(ОН)2 — кристаллическое вещество со слоистой структурой. В воде растворяется незначительно, является основанием средней силы (К2 = 2,510-3). В частности, из насыщенных растворов соединений NH4+ вытесняет аммиак:
2NН4Сl + Мg(ОН)2 = МgСl2 + 2Н3N + 2Н2O
Кроме оксида, широкое применение находит МgСl2. Его кристаллы образованы октаэдрическими структурными единицами МgСl6 , объединенными в слой. Дихлорид получают хлорированием МgО в присутствии угля:
МgO + Cl2 + C = MgCl2 + CO
или обезвоживанием МgСl26H2О, добываемого из морской воды. Дихлорид в основном применяется для получения магния, в производстве магнезиального цемента. Последний получают смешиванием предварительно прокаленного МgО с 30%-ным водным раствором МgСl2. Вследствие образования полимерных цепей эта смесь постепенно превращается в белую твердую массу, устойчивую по отношению к кислотам и щелочам.
С водородом Мg непосредственно не взаимодействует, но косвенным путем можно получить гидрид состава МgН2. По сравнению с преимущественно ковалентными гидридами ВеН2 и АlН3 в MgН2 более отчетливо проявляется ионная связь. Гидрид магния — нелетучее твердое вещество, более термически устойчивое, чем гидриды бериллия и алюминия. Водой МgН2 разлагается. Известны также гидроборат Мg[ВН4]2 и гидридоалюминат Мg[АlН4]2 магния.