
- •Предисловие
- •Введение
- •Литература
- •Тема: основы химической термодинамики, термохимии. Определение теплоты растворения вещества
- •Учебно-целевые вопросы
- •Краткая теоретическая часть Основные понятия, определения, законы
- •Классификация термодинамических систем
- •I закон термодинамики
- •Стандартные условия (с.У.):
- •Э нтальпия реакции равна разности алгебраической суммы энтальпий сгорания исходных веществ и суммы энтальпий сгорания продуктов реакции с учетом их стехиометрических коэффициентов.
- •Нормальные величины суточной потребности в энергии для городского населения в зависимости от рода деятельности (данные Института питания амн ссср)
- •II закон термодинамики
- •Математическая форма второго начала термодинамики для изолированных систем:
- •Изменение знака g при изменении знаков н и s
- •В заимосвязь термодинамических величин
- •Особенности термодинамики биохимических процессов
- •Принцип энергетического сопряжения биохимических реакций
- •Многостадийность, обратимость
- •Гомеостаз
- •Обучающие тесты с решением
- •Обучающие задачи с решением
- •Учебно-исследовательская лабораторная работа « Определение теплового эффекта процесса растворения безводной соли»
- •Контрольные вопросы для защиты экспериментальной работы
- •Учебно-исследовательская лабораторная работа «Определение энтальпии нейтрализации»
- •Контрольные вопросы для защиты экспериментальной работы.
- •Краткая теоретическая часть Основные понятия, определения, формулы
- •Природа реагирующих веществ
- •Концентрация реагентов
- •Давление
- •Влияние величины поверхности соприкосновения реагирующих веществ
- •Влияние катализатора
- •Общие принципы катализа
- •Механизм действия катализатора
- •Суть механизма гомогенного катализа
- •Особенности механизма гетерогенного катализа
- •Ферментативный катализ
- •Особенности ферментативного катализа
- •Обучающие тесты с решением
- •Обучающие задачи с решением
- •« Химическая кинетика. Катализ»
- •Контрольные вопросы для защиты экспериментальной работы
- •Тема: химическое равновесие
- •Учебно-целевые вопросы
- •Краткая теоретическая часть
- •Смещение химического равновесия
- •Способы смещения равновесия
- •Обучающие тесты с решением
- •Обучающие задачи с решением
- •« Химическое равновесие»
- •Контрольные вопросы для защиты экспериментальной работы
- •Задачи для самостоятельного решения
- •Тематика рефератов
- •Приложение
- •Основные термодинамические и кинетические величины
- •Термодинамические свойства некоторых веществ, применяемых в медицине
- •3. Теплоты сгорания (н , кДж/моль) некоторых веществ
- •4. Средняя удельная теплота полного окисления основных компонентов пищевых продуктов
- •5. Периоды полураспада некоторых радионуклидов, применяемых в медицине
- •Калорийность продуктов питания
- •Содержание
Стандартные условия (с.У.):
количество вещества – 1 моль;
давление – 760 мм. рт. ст. = 101 325 Па;
температура – 298 K.
Термодинамические величины в с.у. обозначаются соответствующим символом этой величины с верхним индексом о и температурой 298, указанной справа внизу.
 Но298
– стандартная энтальпия процесса или
реакции – энергетическая характеристика
физико-химического процесса или
химической реакции, проводимых при с.у.
Но298
– стандартная энтальпия процесса или
реакции – энергетическая характеристика
физико-химического процесса или
химической реакции, проводимых при с.у.
Для оценки энергетического состояния веществ в термодинамике используются значения стандартных энтальпий образования этих веществ, обозначаемых:
Но298 (вещество, агрегатное состояние), кДж/моль.
С тандартная
энтальпия образования простых веществ
в их наиболее термодинамически устойчивом
агрегатном и аллотропном состоянии при
с.у. условно принимается равной нулю.
тандартная
энтальпия образования простых веществ
в их наиболее термодинамически устойчивом
агрегатном и аллотропном состоянии при
с.у. условно принимается равной нулю.
Например, для кислорода Но298 (О2, г) = 0,
а для озона Но298 (О3, г) = 142 кДж/моль,
для графита Но298 (С, графит) = 0,
а для алмаза Но298 (С, алмаз) = 1,88 кДж/моль.
С тандартная энтальпия образования сложного вещества равна энтальпии реакции получения 1 моль этого вещества из простых веществ при с.у.
Например, стандартная энтальпия образования этанола равна стандартной энтальпии реакции:
2С(графит) + 3Н2(г) + 1/2О2(г) = С2Н5ОН(ж);
Но298 (С2Н5ОН, ж) = 278 кДж/моль.
Значение стандартной энтальпии образования сложного вещества зависит от природы вещества и его агрегатного состояния. Числовые значения стандартных энтальпий образования веществ являются справочными данными и для некоторых веществ приведены в табл. 2 приложения.
Используя стандартные энтальпии образования веществ, участвующих в химической реакции, можно, не прибегая к эксперименту, рассчитать энтальпию реакции на основе закона Г.И. Гесса (1840 г.):
З начение
теплового эффекта процесса, протекающего
в изобарных (Нр-ции)
или изохорных (Uр-ции)
условиях, зависит только от начального
и конечного состояния данной системы
и не зависит от пути процесса.
начение
теплового эффекта процесса, протекающего
в изобарных (Нр-ции)
или изохорных (Uр-ции)
условиях, зависит только от начального
и конечного состояния данной системы
и не зависит от пути процесса.
Например: С(тв) + О2(г) СО2(г) Н1
С(тв) + 1/2О2(г) СО(г) Н2
СО(г) +1/2О2(г) СО2(г) Н3
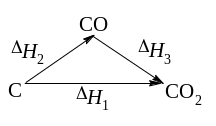 Н1
= Н2
+ Н3
Н1
= Н2
+ Н3
Русский химик Герман Иванович (Герман Генрих) Гесс (1802-1850) родился в Женеве в семье художника, который вскоре переехал в Россию. В 15-летнем возрасте Геcc уезжает в Дерпт (ныне Тарту, Эстония), где учится сначала в частной школе, а затем в гимназии, которую с блеском заканчивает в 1822 г. После гимназии он поступил в Дерптский университет на медицинский факультет, где изучал химию у профессора Готфрида Озанна, специалиста в области неорганической и аналитической химии. В 1825 г. Гесс защитил диссертацию на степень доктора медицины: «Изучение химического состава и целебного действия минеральных вод России».
Как и многие учёные того времени, Гесс проводил исследования в самых разных областях: разработал способ извлечения теллура из его соединения с серебром (теллурида серебра – минерала, названного в честь учёного гесситом); открыл поглощение платиной газов; впервые обнаружил, что измельченная платина ускоряет соединение кислорода с водородом; описал многие минералы; предложил новый способ вдувания воздуха в доменные печи; сконструировал аппарат для разложения органических соединений, устраняющий погрешности в определении количества водорода и т.д.
Мировую известность Герман Гесс получил как основатель термохимии. Учёный сформулировал основной закон термохимии – «закон постоянства сумм теплот», являющийся приложением закона сохранения энергии к химическим процессам. Гессу принадлежит также открытие второго закона термохимии – закона термонейтральности, согласно которому при смешивании нейтральных солевых растворов тепловой эффект отсутствует. Гесс впервые высказал мысль о возможности измерения химического сродства исходя из теплового эффекта реакции, предвосхитив сформулированный позднее Марселеном Бертло и Юлиусом Томсеном принцип максимальной работы.
Гесс занимался также вопросами методики преподавания химии. Его учебник «Основания чистой химии» (1831) выдержал семь изданий (последнее – в 1849 г.). В своём учебнике Гесс использовал разработанную им русскую химическую номенклатуру. Под названием «Краткий обзор химического именословия» она вышла отдельным изданием в 1835 г. (в работе принимали также участие С.А.Нечаев из Медико-хирургической академии, М.Ф.Соловьев из Петербургского университета и П.Г.Соболевский из Горного института). Эта номенклатура была позже дополнена Д.И.Менделеевым и во многом сохранилась до настоящего времени.
Закон Гесса широко используется для расчета тепловых эффектов химических реакций, которые экспериментально определить невозможно.
Из закона Гесса вытекают следующие следствия.
1-е следствие используют для расчета энтальпии реакции по стандартным энтальпиям образования веществ.
Hoр-ции
=
![]() Hoобр.(прод.
р-ции)
Hoобр.(исх.
в-в) ,
Hoобр.(прод.
р-ции)
Hoобр.(исх.
в-в) ,
где ni – стехиометрические коэффициенты химической реакции.
Э нтальпия
химической реакции при с.у. равна разности
алгебраической суммы энтальпий
образования продуктов реакции и
алгебраической суммы энтальпий
образования исходных веществ с учетом
их стехиометрических коэффициентов:
нтальпия
химической реакции при с.у. равна разности
алгебраической суммы энтальпий
образования продуктов реакции и
алгебраической суммы энтальпий
образования исходных веществ с учетом
их стехиометрических коэффициентов:
2-е следствие используют для расчета теплового эффекта реакции по стандартным теплотам сгорания веществ.
С тандартная
теплота сгорания вещества –
это теплота, выделяющаяся при сгорании
1 моль вещества в кислороде до высших
оксидов при стандартных условиях.
тандартная
теплота сгорания вещества –
это теплота, выделяющаяся при сгорании
1 моль вещества в кислороде до высших
оксидов при стандартных условиях.
Стандартные теплоты сгорания являются справочными величинами и для некоторых веществ приведены в табл. 3 приложения.
