
- •4.3 Окислительно-восстановительные реакции
- •4.3.1 Общие сведения об окислительно-восстановительных реакциях
- •Если в формуле (6.1 а) не использовать множитель 100%, то массовая доля будет выражена не в процентах, а в долях единицы.
- •2.1 Зависимость скорости реакции от природы реагирующих веществ
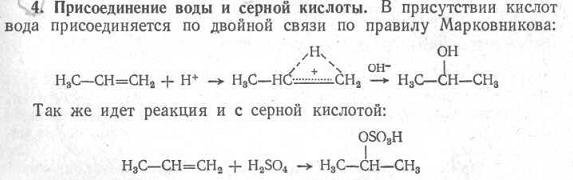
- •2.2 Зависимость скорости реакции от концентрации реагирующих веществ
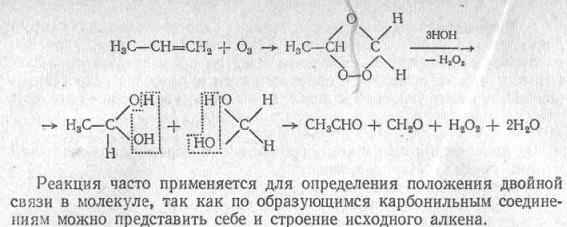
- •2.3 Зависимостьскорости реакции от температуры
- •2.4 Зависимость скорости реакции от присутствия катализаторов.
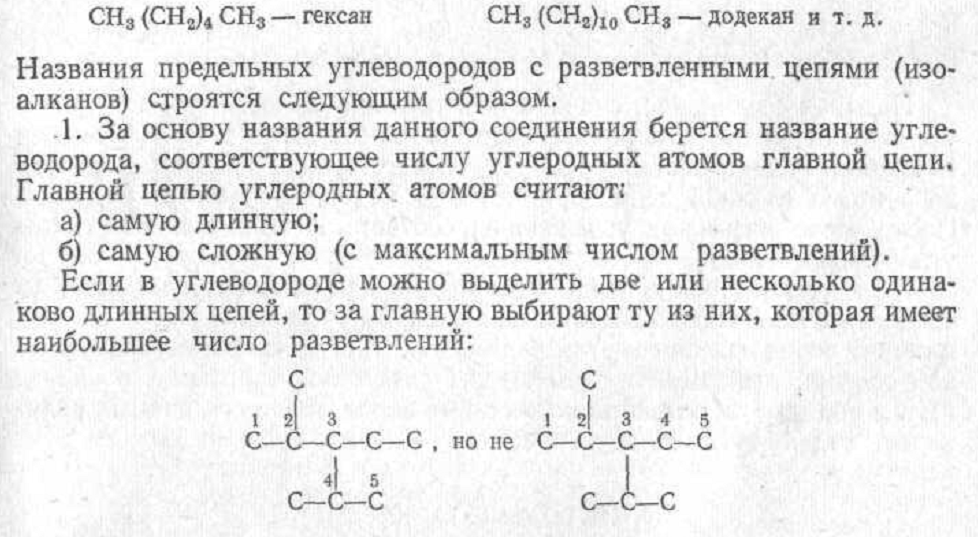
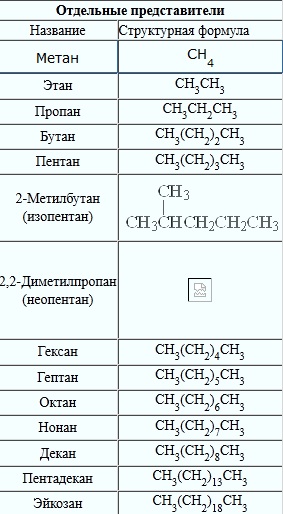
- •1. Тривиальная номенклатура
- •4. Радикало-функциональная номенклатура
- •2. Физические свойства спиртов
- •3. Одноатомные предельные спирты.
- •3.1 Методы получения
- •3.2 Химические свойства предельных спиртов
- •4. Двухатомные и трехатомные спирты. Методы получения и химические свойства.
- •5. Фенолы. Общая характеристика. Методы получения и химические свойства.
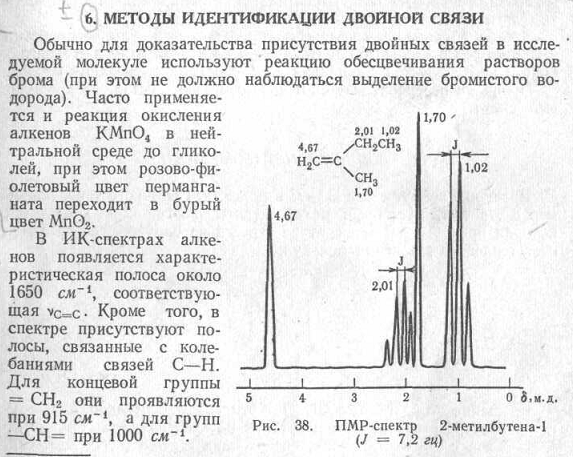
- •6. Отдельные представители. Методы идентификации.
- •Общая характеристика: строение, классификация, номенклатура
- •2. Способы получения аминов
- •3. Физические свойства аминов
- •4. Химические свойства аминов
- •2. Физические свойства альдегидов и кетонов
- •3. Способы получения
- •4. Химические свойства
- •1 Общая характеристика (строение, классификация, номенклатура, изомерия).
- •Классификация и номенклатура аминокислот.
- •5. С анионобразующими группами в боковых цепях-аспарагиновая и глутаминовая кислоты:
- •Физико-химические свойства аминокислот.
- •Химические реакции аминокислот.
- •Общая характеристика: строение, и свойства белков
- •1.1 Строение белковой молекулы
- •Физико-химические свойства белков.
- •Классификация белков
- •Мальтоза
- •Целлобиоза
- •Лактоза
- •Сахароза
- •Ферментативный гидролиз крахмала и гликогена
- •2. Физические свойства карбоновых кислот
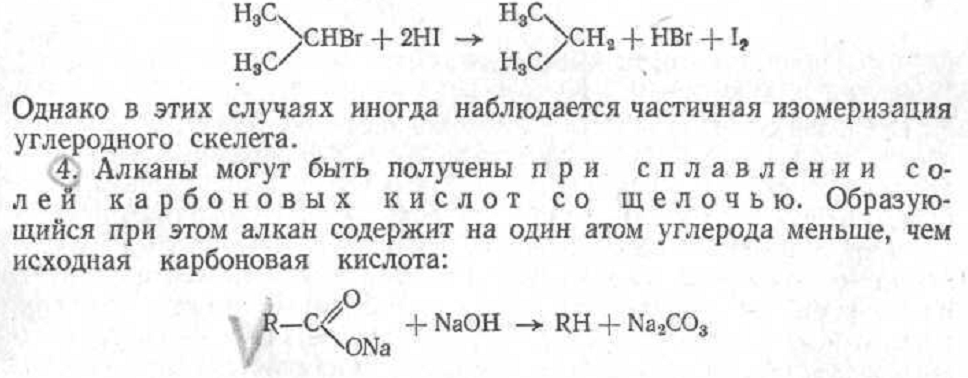
- •3. Способы получения
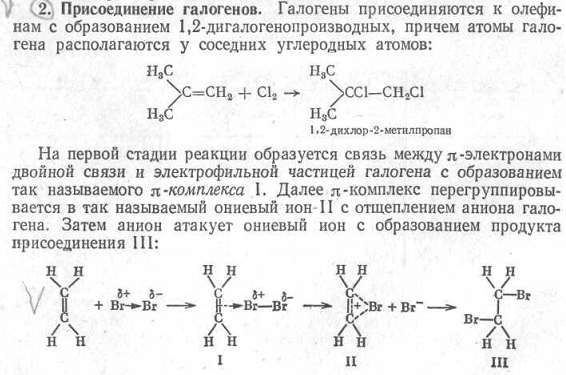
- •4. Химические свойства
- •Общие признаки, функции, классификация
- •Жирные кислоты
- •Омыляемые липиды
- •Простые липиды
- •Прогоркание жира
- •Сложные липиды Фосфолипиды
- •Гликолипиды
- •Неомыляемые липиды
- •Стероиды
- •Терпены
4. Радикало-функциональная номенклатура
Э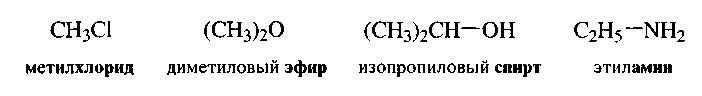 та
система использует те же приемы, что и
рациональная, но не содержит суффиксов.
По этой номенклатуре роль суффикса
играет название класса соединения.
та
система использует те же приемы, что и
рациональная, но не содержит суффиксов.
По этой номенклатуре роль суффикса
играет название класса соединения.
Классификация органических соединений
Атом или группу атомов, связанных определенным образом, наличие которых в молекуле органического вещества придает ему характерные свойства, называют функциональной группой.
Понимание термина «функциональная группа», лежит в основе современной классификации органических соединений.
В структурной формуле каждого соединения можно выделить фрагмент углеводорода или гетероциклического соединения. Этот фрагмент принято рассматривать в качестве остова молекулы. Как правило, остов реже трансформируется в ходе реакции, нежели функциональная группа. Характер остова молекулы определяет ряд, к которому принадлежит данное соединение. Выделяют следующие ряды:
1. Ациклический (алифатический, жирный) ряд включает соединения с открытой цепью углеродных атомов; эти соединения могут быть насыщенными (предельными), например:
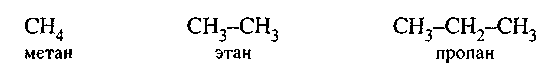
или ненасыщенными (непредельными), например:
![]()
2. Циклический ряд включает:
карбоциклические соединения, содержащие углеродный скелет, замкнутый в цикл
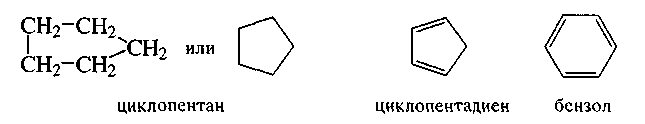
г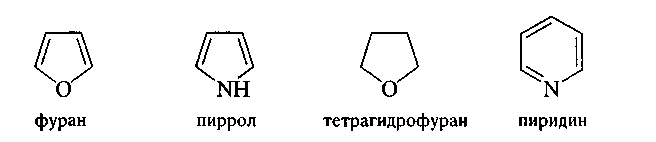 етероциклические
соединения, содержащие
гетероатомы (иные, нежели углерод) в
составе циклов
етероциклические
соединения, содержащие
гетероатомы (иные, нежели углерод) в
составе циклов
В свою очередь, карбоциклические соединения подразделяются на: ароматический ряд, который включает углеводороды и их производные, содержащие шестичленные циклы с чередующимися простыми и двойными связями (ароматические ядра)

а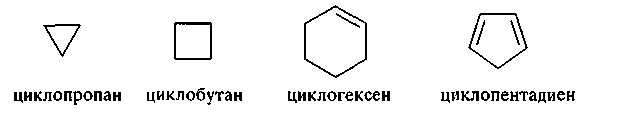 лициклический
ряд, который
объединяет все остальные карбоциклические
соединения, как насыщенные, так и
ненасыщенные
лициклический
ряд, который
объединяет все остальные карбоциклические
соединения, как насыщенные, так и
ненасыщенные
Наличие тех или иных функциональных групп в молекуле органического соединения определяет принадлежность этого соединения к тому.
Р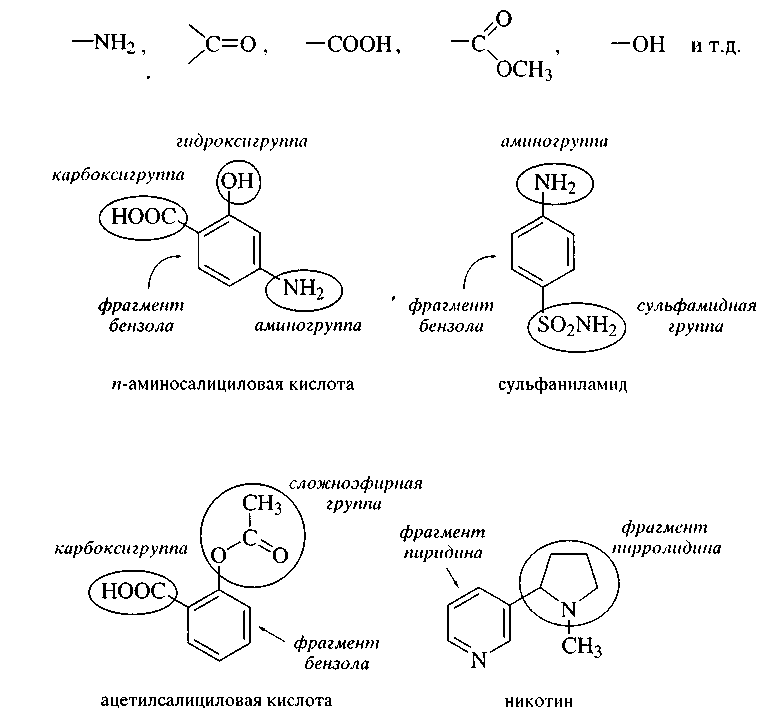 ассмотрим
структуры некоторых органических
соединений. Внимательный анализ каждой
из них позволяет выделить в них фрагмент
соответствующего углеводорода или
гетероциклического соединения и
связанные с этим фрагментом
функциональные группы:
ассмотрим
структуры некоторых органических
соединений. Внимательный анализ каждой
из них позволяет выделить в них фрагмент
соответствующего углеводорода или
гетероциклического соединения и
связанные с этим фрагментом
функциональные группы:
№17




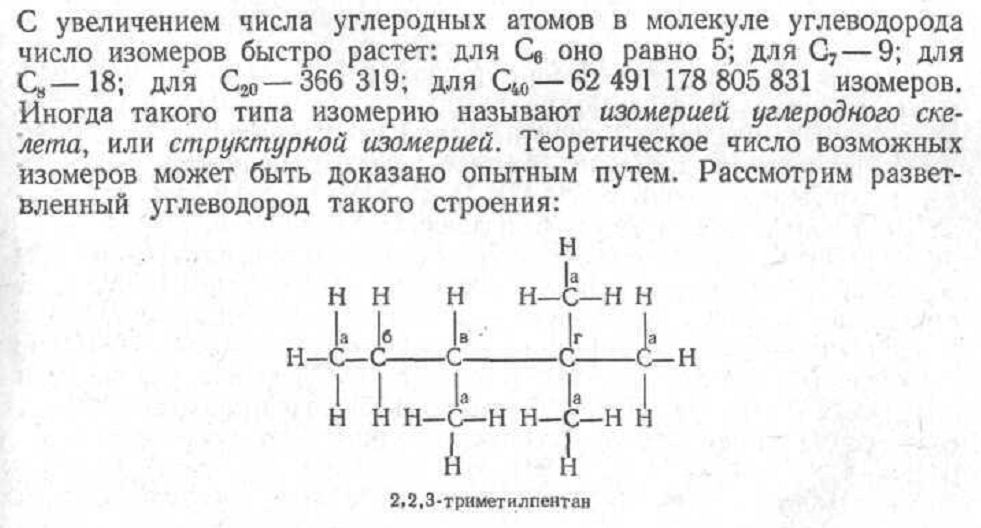





















№18












№19








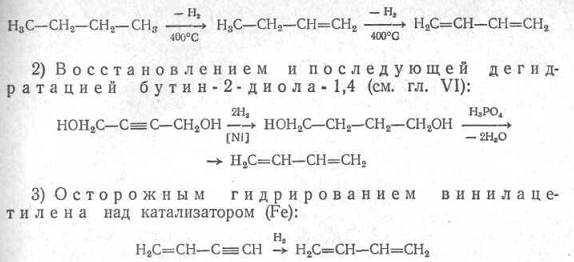



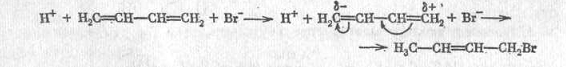



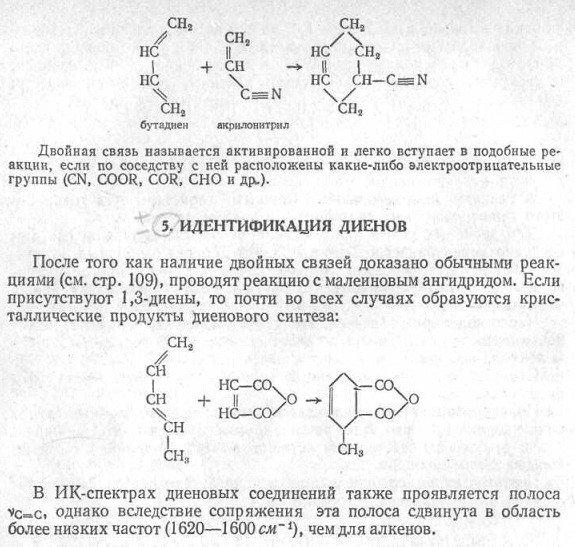
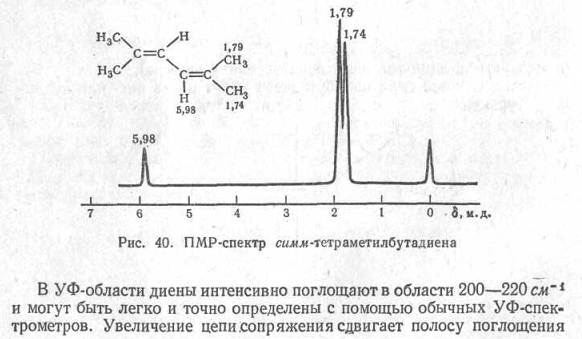

Отдельные представители. Каучуки
Дивинил (бутадиен - 1,3)
![]()
Бесцветный газ с характерным неприятным запахом, сжигающийся при температуре - 50С. Является одним из важнейших мономеров для производства синтетических каучуков и латексов, пластмасс и других органических соединений.
Изопрен (2-метилбутадиен-1,3)
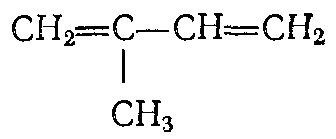
Бесцветная жидкость с температурой кипения =340С. Является основной структурной единицей природного (натурального) каучука и других соединений. Служит мономером для получения синтетического каучука.
Хлоропрен (2-хлорбутадиен-1,3)
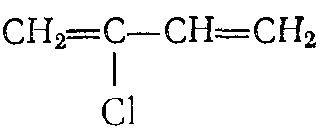
Бесцветная токсичная жидкость, кипящая при температуре 59,40С. Применяют в производстве хлоропренового каучука, клеев.
2,3-диметилбутадиен-1,3

Жидкость, кипящая при температуре 69,60С. Легко полимеризуется с образованием так называемого метилкаучука. При полимеризации этих диенов образуются различные каучуки.
№20
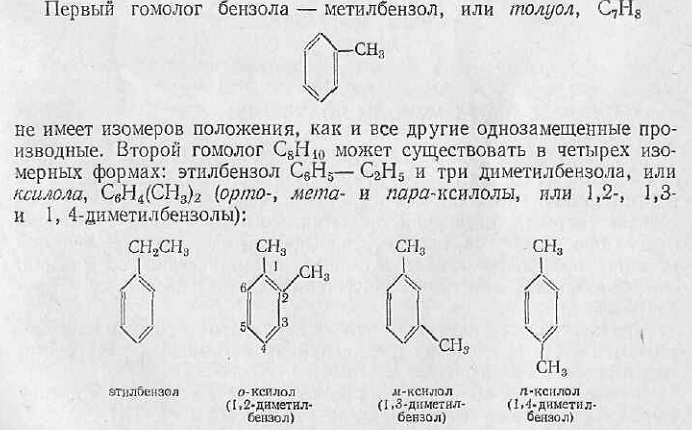


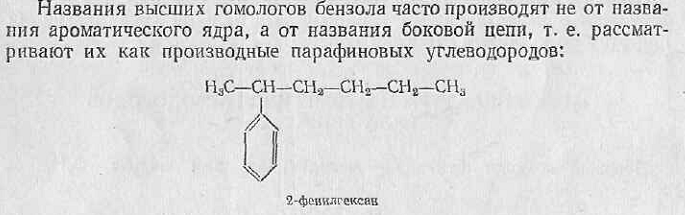




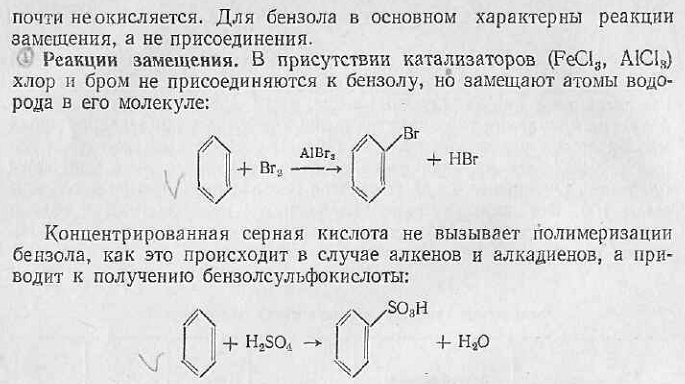




Отдельные представители ароматических углеводородов ряда бензола
Бензол C6H6: бесцветная легковоспламеняющаяся жидкость с характерным запахом. Ткип. 80,1 оС, Тпл. 5,53 оС; d204 =0,8790. Очень мало растворим в воде. Пары бензола при вдыхании оказывают вредное действие на организм. Бензол – один из наиболее ценных в промышленном отношении продуктов сухой перегонки каменного угля. Служат исходным продуктом в промышленности красящих и лекарственных веществ, в производстве синтетического волокна, многих пластмасс. Из бензола получают фенол, нитробензол, анилин и многие другие ароматические соединения. Бензол один из лучших растворителей органических веществ.
Твсп. –11 оС; минимальная температура самовоспламенения 534 оС; стандартная темп. самовоспл. 562 оС; область воспл. 1,4-7,1 % объемн.; температурные пределы воспл.: нижн. - 1,4 оС , верх. – 13 оС; скорость выгорания 30 см/ч; макс. нормальная скорость горения 0,478 м/сек; температура горения 2100 оС.
Толуол (метилбензол) C6H5—CH3. Бесцветная легковоспламеняющаяся жидкость, несколько отличающаяся по запаху от бензола. Ткип. 110,6 оС, Тпл. –95 оС; d204 =0,8669. Применяется главным образом для получения взрывчатого вещества тротила CH3C6H2(NO2)3, а также в производстве красителей, бензойного альдегида, сахарина.
Твсп. 4 оС; станд. темп. самовоспл. 536 оС; область воспл. 1,3-6,7 % объемн., макс. норм. скорость горения 0,388 м/сек; скорость выгорания 20 см/ч, темп. пределн. воспл.: нижн. 0 оС, верхн. 30 оС. Тушить тонкораспыленной водой, пеной.
СН3 Нитрование тротила проводят

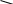
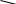

при
комнатной температуре
при
комнатной температуре
О2N NO2 (около 20 оС) – первая нитро-
группа, вторая - при 60 оС,
третья - при 110 оС.
NO2 тринитротолуол
(тротил)
Ксилолы (диметилбензолы) C6H4(CH3)2. Как известно, ксилолы существуют в виде орто-, мета- и пара- изомера. Это бесцветные жидкости, близкие по температурам кипения и более отличающиеся по температурам плавления
о-ксилол м-ксилол п-ксилол
Ткип., оС 144,4 139,1 138,4
Тпл., оС -25,2 -47,9 +13,3
d204 0,8802 0,8642 0,8611
Технический ксилол – смесь всех трех изомеров. Твсп. 29 оС; темп. самовоспл. 590 оС; темп. пределн. воспл.: нижний 24 оС, верх. 50 оС. Тушить распыленной водой, химической пеной.
Кумол С2Н5-СН-(СН3)2 – легковоспламеняющаяся бесцветная жидкость; в воде нерастворим. Твсп. 34 оС; станд. темп. самовоспл. 424 оС; область воспламенения 0,88-6,5 % объем. при 100 оС; темп. пределы воспл.: нижн. 31 оС, верх. 71 оС; скорость выгорания 3,6-4,4 мм/мин.
Фенол (карболовая кислота) – твердое кристаллическое вещество, с
ОН характерным запахом, трудно растворяется в воде, Тпл. 42 оС,

Ткип.
181,1 оС.
Применяется в огромных количествах
для
Ткип.
181,1 оС.
Применяется в огромных количествах
для
 производства
синтетических фенолформальдегидных
смол,
производства
синтетических фенолформальдегидных
смол,
красителей, синтетического волокна, (капрона и анида), а
также для синтеза лекарственных веществ. Сильный анти-
септик. Ядовит, при попадании на кожу вызывает ожоги.
Большинство фенолов дает синюю или фиолетовую окраску с раствором FeCl3. У более сложных молекул производных фенола она бывает зеленой или красной.
№21
Спирты (оксисоединения, алкоголи) – производные углеводородов, в которых один или несколько атомов водорода замещены на гидроксильную группу (оксигруппу).
Общая формула спиртов: R–OH, R –углеводородный радикал
Номенклатура спиртов
Для спиртов существует несколько способов их названия. При названии отдельных спиртов широко применяются исторические названия (тривиальные): древесный спирт СН3ОН, С2Н5ОН – винный спирт.
По радикально-функциональной номенклатуре алифатические спирты с прямой углеродной цепью называют по наименованию радикала, например С2Н5ОН этиловый спирт.
СН3 –СН2 – ОН – этиловый спирт,
СН3 – СН2 –СН2 – ОН – пропиловый спирт
По систематической номенклатуре ИЮПАК:
– выбирают самую длинную цепь, содержащую функциональную ОН-группу;
– названия спиртов образуются от названий соответствующих углеводородов с добавлением суффикса – ол (для одноатомных), -диол (для 2-х атомных), -триол (3-х атомных), в необходимых случаях положение гидроксильной группы обозначается номером.
2 1
СН3 – СН2 – СН2 – СН2 – ОН – 4-хлор-2-этилбутанол-1
3 4
СН2 –СН2–Сl
СН2 –СН2 – СН2 – СН2 – СН3 пентандиол-1,2 (гликоль)
ОН ОН
1 2 3
СН2 – СН –СН2 – прапантриол-1,2,3, (Глицерин)
ОН ОН ОН
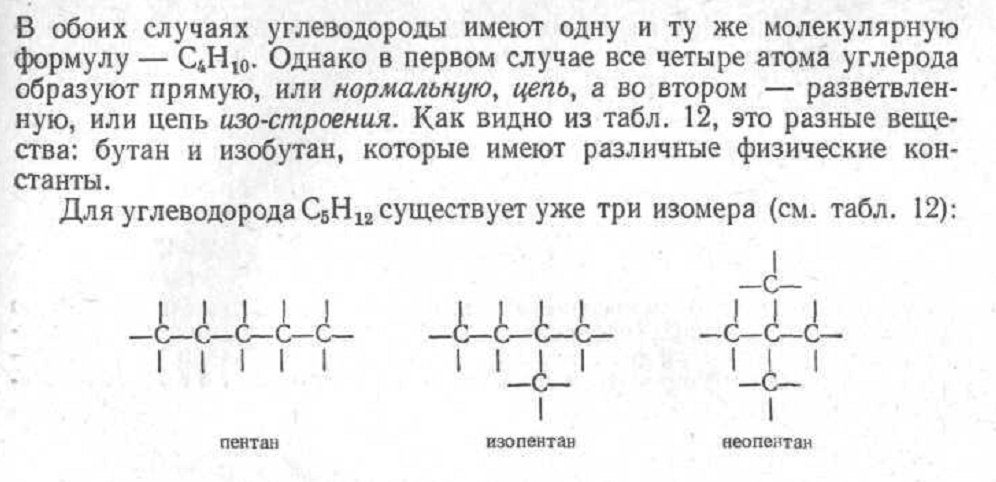
Изомерия
Изомерия спиртов обусловлена строением углеводородного радикала и положением функциональной (гидроксильной) группы. Например, молекулярной формуле С4Н10ОН соответствуют четыре спирта:
СН3 – СН 2 – СН 2 – СН 2 –ОН 1-бутанол, (н-бутанол)
|
СН3 – СН – СН2 – СН3 2-бутанол, ОН (втор-бутиловый спирт) |
СН3 СН3 – СН –СН2 –ОН 2-метил-1-пропанол, (изо-бутиловый спирт) |
СН3 СН3 – СН –СН3 2-метил-2-пропанол, ОН (трет-бутиловый спирт) |
