- •Стереохимия аминокислот.
- •Биосинтез жирных кислот
- •3.Ферменты
- •Образование аммиака, роль глутамина и аспарагина
- •Рацематы
- •Бэта-окисление жирных кислот
- •Общ хар. Сахаров, тригалозный сахар
- •Мажорные-минорные осн, пуриновые-пиримидиновые
- •Оксидоредуктазы
- •Таутомерные превращения азотистых оснований
- •Гликозиды. Написать формулу метил-альфа-d-глюкозогликозид
- •Кардиолипин; хар-ка
- •Кинетика ферментативных процессов;уравнение михаэлис-Мэнтен
- •Цикл глюкоза в лактат и сколько нужно и затратить атф
- •МРнк, строение и роль
- •Арахидоновая к-та и ее производные
- •Изомеразы; общая хар-ка,примеры реакций
- •Как влияет концентрац... Уравнение Михаэлиса–Ментен
- •Дыхательная цепь
- •Сахароза, как влияет её строение на хим св-ва; может ли она восстонавливать аммиачный р-р Ag
- •Высшие Жирные кислоты ; числа омыления,йодное число и кислотное тное число.
- •Важнейшие коферменты над и надф.
- •Биосинтез белка
- •Мутаротация
- •Желчные кислоты
- •Трансферазы
- •Коферменты фмн и фад
- •Цикл трикарбоновых кислот (Цикл Кребса)
- •Коферменты
- •Биосинтез рнк
- •Жирные кислоты: структура и свойства, связи
- •Гликоген,целлюлоза, амилопектин.
- •Пируват, аспартат- фермент
- •ТРнк, биороль
- •Механизм действия стероидных гормонов.
- •Изоферменты
- •Цикл пировиноградной кислоты.
- •Основные свойства генетического кода
- •Таутомерия глюкозы и что такоемутаротация
- •3.Специфические ферменты
- •5.Гликолиз
- •6. Рилизинг-факторы (либерины)
- •Факторы, влияющие на скорость ферм.Реакции
- •Биосинтез триглицерина и глицеролфосфолипидов
- •3.Нуклеотиды.
- •4. Горм.Гипофиза
- •1. Отличия и сходста днк и рнк
- •3 Роль тиреоидных гормонов
- •Цикл мочевины.
- •Гормоны поджелудочной железы
- •Гетерогликаны
- •4) Классы ферментов
- •5) Аллостерическая активность ферментов
- •Гормоны гипоталамуса
- •Кортикотропин-рилизинг-гормон
- •Специфичность ферментов
- •5.Жирные кислоты (алифатические кислоты)
- •Фолдинг белка
- •1.Стерины и стериды
- •2. Нуклеозиды и нуклеотиды
- •Метаболизим белков, липидов и углеводов.
- •Адреналин и норадреналин
- •1. Днк: типы, характеристика
- •2. Воски
- •3.Распад гликогена. Гликоген
- •Роль в организме
- •2.Аминосахара и их значение
- •5)Трансаминирование аминокислот
- •6.Отличие спиртового от молочно-кислого брожения
- •1.Методы очисткии разделения белков и пептидов,
- •2) Сахароза и её инверсия.
- •3) Глицерофосфолипиды.
- •4)Первичная структура нуклеиновых кислот
- •Пуриновые основания
- •2)Цереброзиды
- •3.Первичная и вторичная структура белков (связи)
- •4. Гомогликаны (строение, функции)
- •5) Пиридоксин, его роль в регуляции белкового обмена, переаминирование(механизм р-ии и роль в метаболизме)
- •1.Пиримидиновые азотистые основания
- •2.Плазмалогены.
- •3. Способы образования аминокислот
- •4. Пути метаболизма
- •1)Строение матричной рнк.
- •2. Гормоны,как производныеАмк,гормональный цикл
- •3.Кислотно-основные свойства Аминокислот.
- •5) Регуляция активности ферментов
- •6.Пентозофосфатный путь окисления
- •1.Моносахариды.
- •2) Пептиды
- •3)Сфинголипиды.
- •4.Гликолиз и гликогенолиз.
- •1. Общие пути обмена аминокислот.
- •2. Транскри́пция
- •3.Альфа – Аминокислоты.
- •Связь между окислением жиров и циклом Кребса.
- •1. Структурная организация фермента
- •2. Регуляторные центры
- •Гормоны пептидной природы
- •Гликогенез и его рольСинтез гликогена (гликогенез)
- •Жирные кислоты
- •1.Гликофосфолипиды.
- •Гликозиды,кислоты, аминосахара как производные монасахаридов.
- •Мембранно-опосредованное взаимодействие гормонов.
- •Катаболизм аминокислот.
- •Распад стеариновой кислоты.
- •138 Молекул атф
- •Стеролы и стероиды.
- •Биосинтез пуриновых нуклеотидов.
- •ЦАмф, свойства.
- •Гидролазы.
- •Типы ингибирования. Константа Михаэлиса.
- •Свободное окисление.
- •Качественные реакции на гомо- и гетероциклические аминокислоты.
- •3) Физические и химические свойства крахмала, целлюлозы,гликогена
Свободное окисление.
Одна из задач – превращения природных или неприродных субстратов, называемых в этом случае ксенобиотиками. Они осуществляются ферментамидиоксигеназами и монооксигеназами. Окисление протекает при участии специализированныхцитохромов, локализованных чаще всего в эндоплазматическом ретикулуме, поэтому иногда этот процесс называют микросомальным окислением.
В реакциях свободного окисления участвуют также кислород и восстановленные дыхательные переносчики (чаще всего НАДФН). Акцептором электронов является цитохром Р-450 (иногда цитохром b5). Окислениесубстрата протекает по следующей схеме:
SH + O2–> SOH.
Механизм действия оксигеназ включает изменение валентности входящих в их состав ионов двухвалентных металлов (железа или меди). Диоксигеназы присоединяют к субстрату молекулярный кислород, активируя его за счет электронаатомажелеза в активном центре (железо при этом становится трехвалентным). Оксигена-ция протекает как атака субстрата образующимся супероксид-анионом кислорода. Одной из биологически важных реакций такого типа является превращение β-каротина в витамин А. Монооксигеназы требуют участия в реакции НАДФН, атомыводорода которого взаимодействуют с одним из атомовкислорода, поскольку только один электрон связывается с субстратом.
В процессе свободного окисления вследствие особенностей используемых цепей передачи электронов не происходит образования АТФ; биологическая роль этих процессов заключается в метаболизме ряда природных и ксенобиотических субстратов. В последнем случае свободное окисление выполняет важную функцию модификации чужеродных соединений. К последним относятся лекарственные средства, гербициды, продукты загрязнения окружающей среды, в возрастающем количестве попадающие в организм с водой, пищей и атмосферным воздухом. Как правило, они имеют гидрофобные свойства. Многие из них являются канцерогенными. Их гидроксилирование в ходе свободного окисления облегчает последующую деструкцию и выведение из организма.
Билет 30
Качественные реакции на гомо- и гетероциклические аминокислоты.
Гомоциклические кислоты: Фенилаланин C6H5CH2CH(NH2)COOH ;Тирозин
n-HOC6H4CH2CHX(NH2)COOH
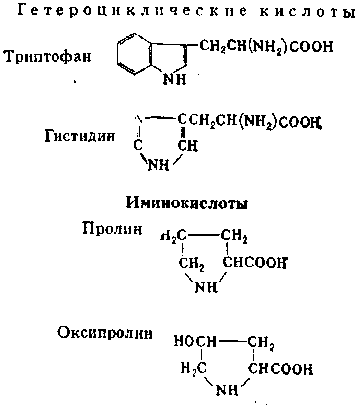
Ксантопротеиновая реакция — метод определения циклических аминокислот, основанный на способности тирозина, триптофана и фенилаланина давать желтое окрашивание при нагревании с концентрированной азотной кислотой; используется также для обнаружения белка.
3) Физические и химические свойства крахмала, целлюлозы,гликогена
Крахмал Безвкусный, аморфный порошок белого цвета, нерастворимый в холодной воде. Под микроскопом видно, что это зернистый порошок; при сжатии порошка крахмала в руке он издаёт характерный «скрип», вызванный трением частиц.
В горячей воде набухает (растворяется), образуя коллоидный раствор — клейстер; с раствором йода образует соединение-включение, которое имеет синюю окраску. В воде, при добавлении кислот (разбавленная H2SO4 и др.) как катализатора, постепенно гидролизуется с уменьшением молекулярной массы, с образованием т. н. «растворимого крахмала», декстринов, вплоть до глюкозы.Молекулы крахмала неоднородны по размерам. Крахмал представляет собой смесь линейных и разветвлённых макромолекул.При действии ферментов или нагревании с кислотами подвергается гидролизу. Уравнение:(C6H10O5)n + nH2O—H2SO4→ nC6H12O6.
Качественные реакции:
Крахмал, в отличие от глюкозы, не даёт реакции серебряного зеркала.
Подобно сахарозе, не восстанавливает гидроксид меди (II).
Взаимодействие с йодом (окрашивание в синий цвет) — качественная реакция;
Физические свойства целлюлозы.Чистая целлюлоза — белое твердое вещество, нерастворимое в воде и в обычных органических растворителях, хорошо растворимо в концентрированном аммиачном растворе гидроксида меди (II) (реактив Швейцера). Из этого раствора кислоты осаждают целлюлозу в виде волокон (гидратцеллюлоза). Клетчатка обладает довольно большой механической прочностью.
Химические свойства. Применение целлюлозы
Небольшие различия в строении молекул обуславливают значительные различия в свойствах полимеров: крахмал — продукт питания, целлюлоза для этой цели непригодна.
1) Целлюлоза не дает реакции «серебряного зеркала» (нет альдегидной группы).
2)За счет гидроксильных групп целлюлоза может образовывать простые и сложные эфиры.Например, реакция образования сложного эфира с уксусной кислотой имеет вид:
[С6Н7O2(ОСОСН3)3]n+3nН2O[С6Н7O2(ОН)3]n+3nСН3СООН
3)При взаимодействии целлюлозы с концентрированной азотной кислотой в присутствии концентрированной серной кислоты в качестве водоотнимающего средства образуется сложный эфир — тринитрат целлюлозы:

4)Подобно крахмалу, при нагревании с разбавленными кислотами целлюлоза подвергается гидролизу с образованием глюкозы: nСбН12O6(С6Н1006)n+nН2O
Гидролиз целлюлозы, иначе называемый осахариванием, — очень важное свойство целлюлозы, он позволяет получить из древесных опилок и стружек целлюлозу, а сбраживанием последней — этиловый спирт. Этиловый спирт, полученный из древесины, называется гидролизным.
Гликоген (С6Н10О5)n – резервный полисахарид, который содержится в животных организмах, а также в клетках грибов, дрожжей и некоторых растений (кукурзы). В животных организмах гликоген локализируется в печени (20%) и мышцах (4%).
Строение и свойства гликогена. Молекулы гликогена имеют разветвленную структуру и состоят из остатков альфа-D-глюкозы, соединенных 1,4- и 1,6-гликозидными связями.1)Гликоген растворяется в горячей воде, с растворов осаждается этиловым спиртом. 2)Гликоген устойчив в щелочной среде, а в кислой среде при нагревании гидролизируется с образованием сначала декстринов, а потом глюкозы. 3)С йодом гликоген дает красно-фиолетовую или красно-коричневую окраску, что свидетельствует оего сходстве с амилопектином.оптически активен.
Гликоген в организме. Ферментативное расщепление гликогена осуществляется двумя путями: гидролизом и фосфоролизом. Гидролитическое расщепление гликогена осуществляется альфа-амилазой, вследствие чего образуется мальтоза. При фосфорилировании гликогена при участии фосфорилазы (в печени) образуется глюкозо-1-фосфат.
(C6H10O5)n+ H3PO4–> (C6H10O5)n–1+ Глюкозо-1-фосфат,
Аденозинтрифосфат(АТФ)ФОРМУЛА.

Аденозинмонофосфат(AMФ, 5'-аденилат, это эфир фосфорной кислоты и аденозинового нуклеозида. Молекула АМФ содержит фосфатную группу, сахар рибозу и азотистое основание аденин.
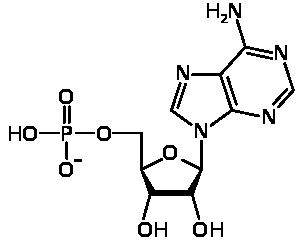
Превращения в клетке
АМФ может образовываться из АТФ в результате:
1)аденилаткиназной реакции;
2 АДФ → АТФ + АМФ
2)при гидролизе АДФ или АТФ;
АДФ → АМФ + Pi
АТФ → АМФ + PPi
3)в результате гидролиза РНК.
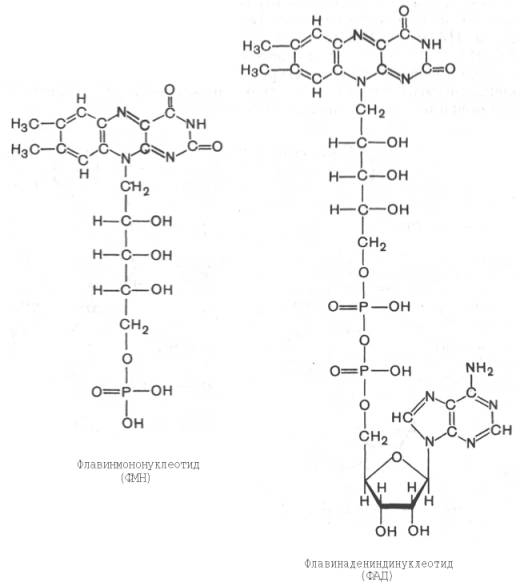
Формулы ФМН и ФАД
Типы азотистого обмена
1. Аммониотелический тип , при котором главным конечным продуктом азотистого обмена является аммиак, свойствен рыбам.
2. Уреотелический тип обмена – основным конечным продуктом обмена белков является мочевина, характерен для человека и животных.
3. Урикотелический тип - главным конечным продуктом обмена является мочевая кислота, характерен для птиц и рептилий.
Азотистый обмен почвы — это круговорот в почве азота, который присутствует там не только в виде простого вещества (газа — N2), но и в виде ионов: нитритов (NO2-), нитратов (NO3-) и аммония (NH4+).Концентрации этих ионов отражают состояние почвенных сообществ, поскольку на эти показатели влияет состояние биоты (растений, микрофлоры), состояние атмосферы, вымывание из почвы различных веществ. Очень большую роль в круговороте азота играют почвенные микроорганизмы.
Биосинтез пиримидиновых и пуриновых нуклеотидов
Центральными промежуточными продуктами биосинтеза предшественников нуклеиновых кислот являются мононуклеотид уридинмонофосат [УМФ (UMP)] для пиримидинового ряда и инозинмонофосфат [ИМФ (IMP), основание: гипоксантин) для пуринов. Путь синтеза различен для пиримидиновых и пуриновых оснований. В первом случае строится прежде всего пиримидиновое кольцо и затем к нуклеотиду присоединяется рибозо-5'-фосфат. Синтез пуриновых нуклеотидов, напротив, начинается с рибозо-5'-фосфата и исходя из него шаг за шагом формируется кольцо.
Непосредственными предшественниками в синтезе пиримидинового кольца являются карбамоилфосфат, который образуется из глутамина и НСО3- (1а), и аспартат. После образования N-карбамоиласпартата (1б) происходит замыкание кольца с образованием дигидрооротата (1в). У млекопитающих стадии от 1а до 1в проходят в цитоплазме и катализируются одним полифункциональным ферментом. На следующей стадии (1г) дигидрооротат окисляется флавинмо-нонуклеотидзависимой дегидрогеназой в оротат, который связывается с фосфорибозилдифосфатом (PRPP) с образованием нуклеотида оротидин-5'-монофосфата [ОМФ (ОМР)], декарбоксилирование которого приводит к уридин-5'-монофосфату [УМФ (UMP)].
Пуриновый биосинтез начинается с фосфорибозилдифосфата (названия отдельных промежуточных продуктов перечислены на с. 406). Сначала присоединяется аминогруппа, которая впоследствии в кольце становится N-9 (2а). Глицин и формильная группа N10-формилтетрагидрофолата поставляют недостающие атомы пятичленного кольца (2б, 2в). Прежде чем это кольцо замкнется (2е), присоединяются атомы N-3 и N-6 шестичленного кольца (2г, 2д). Затем построение кольца продолжается путем присоединения N-1 и С-2. На последней стадии шестичленное кольцо замыкается с образованием инозин-5'-монофосфата [ИМФ (IMP)], который, однако, не накапливается, а быстро превращается в АМФ и ГМФ. Эти реакции и синтез других нуклеотидов рассмотрены на с. 192
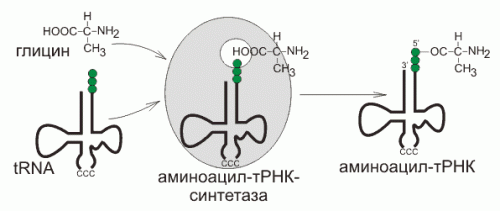
тРНК
тРНК является одноцепочечной РНК, однако в функциональной форме имеет конформацию «клеверного листа». Аминокислота ковалентно присоединяется к 3'-концу молекулы с помощью специфичного для каждого типа тРНК фермента аминоацил-тРНК-синтетазы. На участке C находится антикодон, соответствующий аминокислоте.