
- •2. Стереохимия амк
- •4. Синтез жк
- •5. Ферм-ты,их отличие от химических катализаторов
- •6. Какими путями при обмене амк обр-ется аммиак, роль глутамина и аспарагина в обмене в-в. Дезаминирование амк
- •2. Мажорные-минорные осн, пуриновые-пиримидиновые
- •3. Общ хар. Сахаров, тригалозный сахар
- •Трегалоза (-d-глюкопиранозил-(11)--d-глюкопиранозид) – невосстанавливающий резервный дисахарид грибов и насекомых.
- •5. Оксидоредуктазы
- •6. Бэта окисление жирн кислот.
- •1 Таутомерные превращения азот.Оснований
- •2 Гликозиды написать формулу метил-альфа-d-глюкозогликозид
- •3 Написать формулу кардиолипина и написать их хар-ку
- •4 Кинетика фер-тативных процессов ур-ние михаэлис-Мэнтен
- •6 Цикл глюкоза в лактат и сколько нужно и затрачено атф
- •1.МРнк строение и роль
- •3.Арахидоновая кисл и её произв(пг)
- •4.Изомеразы.Общая хар-ка,примеры реакций
- •5.Как влияет концентрац......(константа мих-мэнтоса)
- •6.Дых цепь
- •6 Биосинтез белка
- •2. Общая хар-ристика лигаз
- •3. Биосинтез рнк
- •5. Изоф-ты, функции
- •6. Цикл пировиноградной к-ты
- •3. Таутомерия глюкозы и что такое мутаротация
- •6. Рилизинг-факторы (либерины)
- •1. Факторы, влияющие на скорость ферм. Реакции
- •2. Биосинтез триглицерина и глицеролфосфолипидов биосинтез триглицеридов
- •3. Стр. Нуклеотида
- •5. Горм. Гипофиза
- •Вазопрессин и окситоцин
- •Меланоцитстимулирующие гормоны (мсг, меланотропины)
- •Адренокортикотропный гормон (актг, кортикотропин)
- •Соматотропный гормон (стг, гормон роста, соматотропин)
- •Лактотропный гормон (пролактин, лютеотропный гормон)
- •Тиреотропный гормон (ттг, тиротропин)
- •Гонадотропные гормоны (гонадотррпины)
- •Липотропные гормоны (лтг, липотропины)
- •1 Отличия и сходста днк и рнк
- •2 Произв. Моносахаридов: кислоты, гликозиды, аминосахара
- •3 Роль тиреоидных гормонов
- •4 Оксиредуктазы
- •2 Гормоны поджелудочной железы...Функции ....Строение...
- •Глюкагон
- •3 Гетерогликаны
- •4 Классы ф-тов
- •5 Аллостерическая активность ф-тов.
- •14 Билет
- •3 Горомны гипоталамусса, их природа и ролль...
- •4 Специфичность ф-тов
- •3) Хим. Природа связей, стабилизирующих первичную и вторичную стр-ру белков и нуклеиновых к-т
- •4) Гомогликаны (строение, функции)
- •5) Пиридоксин, его роль в регуляции белкового обмена, переаминирование(механизм р-ии и роль в метаболизме)
- •2. Гормоны,как производные амк, гормональный цикл
- •4. Лигазы(ферм-ты),их функции.
- •5. Гормональная регуляция акт-сти ф-та с пом вторичных посредников.
- •6. Пентозофосфатный путь(пфп) окисления ув
- •Основные р-ции моносахаридов, продукты р-ций и их св-ва
- •2. Пептиды
- •1. Структурная организация фермента
- •Активный центр ферментов.
- •2. Регуляторные центры
- •4. Общая классификация витаминов
- •5. Гликогенез и его роль Синтез гликогена (гликогенез)
- •1)Гликофосфолипиды
- •2) Однокомпонентные и двухкомпонентные ф-ты
- •4)Гликозиды, к-ты,моносахара,как производные монасахаридов
- •5)Мембрано-опосредованное вз-действие гормонов
- •6)Катаболизм амк
- •1. Стеролы и стероиды
- •2. Лактоза и ее св-ва
- •Роль тРнк
- •1.Макроэргические соединения
- •2.Гидролазы, роль
- •3.Арахидоновая кислота и ее роль в метаболизме и произв
- •5.Ингибирование, виды. Константа Михаэлиса и зависимость
- •6.Свободное окисление, его роль в антиоксидантном механизме
4.Изомеразы.Общая хар-ка,примеры реакций
ИЗОМЕРАЗЫ,
класс ферментов,
катализирующих р-ции изомеризации.
П/клсы изомераз (их 5) сформ-ваны по типам
р-ций, а подп/клсы по типам субстратов.
Рацемазы и эпимеразы кат-ют соотв.
рацемизацию
и эпимеризацию
в-в. Субстраты
рацемаз содержат один хиральный центр,
эпимераз несколько. У исследованных
рацемаз -АМК кофермент
пиридоксальфосфат.
Рацемизация
-АМК обусловлена обратной р-цией
нестереоспецифич. присоединения Н+
к атому
С, связанному с R. Рацемазы АМК
играют существенную роль у бактерий,
синтезирующих из L-изомеров D-аланин и
D-глутаминовую к-ту, необходимые для
синтеза пептидогликанов.
Среди др. изомераз, катализирующих
превращения АМК,
хорошо изучена диаминопимелинатэпимераза,
катализирующая превращение
2,6-L,L-диаминопимелиновой к-ты в мезо-форму.
В группе эпимераз, кат-ющих превращ
углеводов,
наиб. изучена альдоза-1-эпимераза, уч-ющая
во взаимопревращении - и -моносахаридов,
а также уридиндифосфатглюкоза-4-эпимераза,
катализирующая эпимеризацию
углевода
в положении 4 с образованием
уридиндифосфатгалактозы. Одна из важных
р-ций эпимеризации
- мутаротация
глюкозы,
кат-емая мутаротазой животных.
цис-транс-Изомеразы кат-руют изомеризацию
при дв
связях.
Так, малеинатизомераза катализирует
превращ. малеиновой к-ты в фумаровую.
Нек-рые из этих изомераз используют в
качестве кофермента
НАДФН. Поскольку в результ р-ции не
обр-ся окисленные продукты, эти ферменты
не причисляются к классу оксидоредуктаз.
К изомеразам этой группы относятся
ферменты,
катализирующие взаимопревращения
альдоз
и кетоз.
Так, триозофосфат-изомераза катализирует
превращение D-глицеральдегид-3-фосфата
в дигидроксиацетонфосфат;
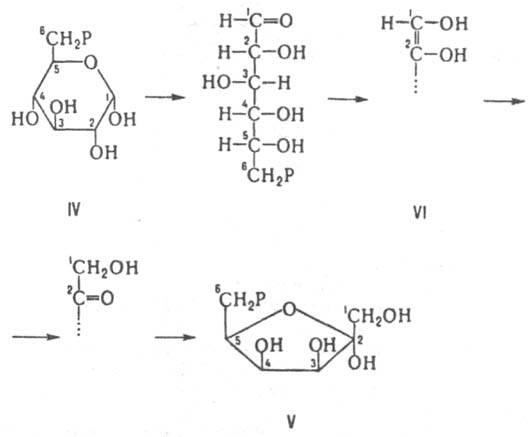
глюкозо-6-фосфатизомераза катализирует
взаимопревращение между глюкозо-6-фосфатом
(IV) и фруктозо-6-фосфатом (V), к-рое,
предположительно, осуществляется через
промежут. ендиол (VI):
 К
этой же группе относятся ферменты,
катализирующие кетоенольные превращ.
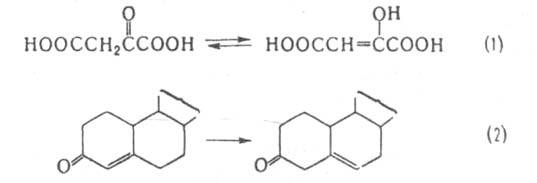
(напр., оксалоацетат-таутомераза,
участвующая в р-ции 1), а также перемещение
двойной
связи
(напр., стероид--изомераза, катализирующая
р-цию 2) и связи SS в белках
(белок
дисульфид-изомеразы):
К
этой же группе относятся ферменты,
катализирующие кетоенольные превращ.
(напр., оксалоацетат-таутомераза,
участвующая в р-ции 1), а также перемещение
двойной
связи
(напр., стероид--изомераза, катализирующая
р-цию 2) и связи SS в белках
(белок
дисульфид-изомеразы):
 Внутримол.
трансферазы
катализируют перемещение групп из
одного положения молекулы
в другое. Ряд ферментов
этой группы катализирует перемещение
аминогрупп.
Мн. из них в качестве кофактора используют
коферментные формы витамина
В12.
К этой же группе относятся ферменты,
кат-ющие перемещ ацильной и др. групп.
Все изомеразы играют важную роль в
обмене в-в.
Внутримол.
трансферазы
катализируют перемещение групп из
одного положения молекулы
в другое. Ряд ферментов
этой группы катализирует перемещение
аминогрупп.
Мн. из них в качестве кофактора используют
коферментные формы витамина
В12.
К этой же группе относятся ферменты,
кат-ющие перемещ ацильной и др. групп.
Все изомеразы играют важную роль в
обмене в-в.
5.Как влияет концентрац......(константа мих-мэнтоса)
Одним из наиболее сущ-нных факторов, определяющих скорость фер-вной р-ции, явл конц-ция субстрата (или субстратов) и продукта (продуктов). При пост конц-ции фермента скор реакции постепенно увелич, достигая определ максимума, когда дальнейшее увеличение кол-ва субстрата практически не оказывает влияния на скор ферм-вной р-ции. В таких случ принято считать, что субстрат находится в избытке, а фермент полностью насыщен, т.е. все молекулы фермента связаны с субстратом. Ограничивающим скорость реакции фактором в последнем случае становится концентрация фермента. Именно при этих условиях определяют величину максимальной скорости (Vmax) и значения константы Михаэлиса (Km).
Скорость любой ферментативной реакции непосредственно зависит от концентрации фермента. Существующая линейная зависимость между этими величинами, когда скорость реакции прямо пропорциональна количеству присутствующего фермента, справедлива только в определенных условиях, например в начальный период ферментативной реакции, так как в этот период практически не происходит обратной реакции, а концентрация продукта оказывается недостаточной для обратимости реакции. Именно в этом случае скорость реакции (точнее, начальная скорость реакции v) будет пропорциональна концентрации фермента. Как было отмечено, фермент является одной из реагирующих молекул в химической реакции и при взаимодействии с субстратом образует промежуточный фермент-субстратный комплекс, который далее подвергается распаду на продукт и свободный фермент:
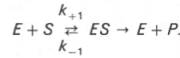 Если
упростить это уравнение:
Если
упростить это уравнение:
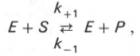
то в уравнениях для скоростей прямой и обратной реакций обязательным компонентом является концентрация фермента:
![]()
