
- •1.Основные законы химии. Закон эквивалентов закон Авагадро. Закон дальтона.
- •1)Закон кратных отношений.
- •Закон эквивалентов
- •Для расчета эквивалента кислоты надо молярную массу разделить на основность.
- •2.Химическая кинетика. Состояние систем. Основные понятия. Функция состояния первый закон термодинамики.
- •3.Термодинамика. Закон Гесса. Следствия закона Гесса. Водородный показатель. Ионное произведение воды.
- •4.Зависимость теплового эффекта реакции от температуры. Уравнение Кирхгофа. Расчет h при различных температурах.
- •5.Второе начало термодинамики. Статическая интерпретация энтропии. Уравнение Больцмана
- •6. Расчет изменения энтропии при нагревании. Расчет константы равновесия по закону действующих масс.
- •7. Изменение энергии Гиббса как критерий самопроизвольного течения процесса
- •9,10. Расчет константы равновесия по закону действующих масс. Химическое равновесие….
- •9. Химическое равновесие. Расчет константы равновесия по термодинамическим данным : ∆h, ∆s, ∆g
- •17. Реакция второго порядка
- •18.Влияние температуры на равновесие. Изобара Ван Гоффа.
- •Разделим переменные и проинтегрируем уравнения изобары Ван Гоффа
- •19. Теория переходного состояния. Энергия активации реакции.
- •20. Расчет эдс гальванических элементов, оставленных из электродов 1 и 2 рода.
- •21.Расчет ph растворов кислот и оснований
- •22.Условие смещение химического равновесия. Принцип Ле-Шателье
- •23.Образование растворов. Способы выражения концентрации растворов
- •24.Коррозия. Протекторная защита металлов от коррозии.
- •25.Электрохимия. Электродов 1 рода. Уравнения Нернста для электродов 1 рода.
- •26.Образование растворов. Способы выражения концентрации растворов
- •27.Растворы электролитов. Теория электролитической диссоциации Аррениуса. Равновесие в растворах электролитов. Сильные и слабые электролиты.
- •28.Электролиз. Правила разряда ионов при электролизе. Процессы, протекающие на катоде и аноде при электролизе.
- •29.Растворы неэлектролитов. Закон Генри. Закон Рауля
- •30.Химическая кинетика. Молекулярность и порядок реакции. Графическое определение порядка реакции.
- •31. Коррозия. Виды коррозии. Механизм электрохимической коррозии.
- •34.Электролиз. Законы Фарадея. Катодное нанесение покрытий и анодное растворение металла
- •35.Гальванический элемент Якоби-Даниэля. Расчет эдс гальванических элементов, составленных из электродов 1 рода
- •36.Газовые электроды. Расчет эдс водородного электрода
9. Химическое равновесие. Расчет константы равновесия по термодинамическим данным : ∆h, ∆s, ∆g
11. Химическая кинетика. Раздел физической химии, изучающий протекание процесса во времени.
Скорость – величина всегда положительная.
Vмгн.скор = +-dC/d
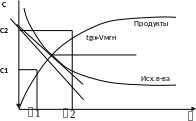
По изменению концентрации за определенный интервал времени:
Vср = (C2-C1)/(2-1)
V=n/(S*) – n-изменение числа молей; S-поверхность раздела масс.
Основным постулатом в формальной кинетике является закон действующих масс.
aA+bB dD+eE
Скорость реакции прямо пропорциональна концентрации реагирующих веществ в степенях, равных стехиометрическим коэффициентам.
V=K*CAa*CBb
V=K*CDd*CEe
Физический смысл константы скорости – скорость реакции, если концентрация равна 1.
Различают: моно; би; три; - по числу молекул, участвующих в элементарном акте химического взаимодейтсвия.
H2O2=H2O+1/2O2
H2+Cl2=2HCl
2NO+O2=2NO2
Порядок реакции обозначается n, определяется суммой показателей степеней в законе действующих масс.
n=a+b
aA+bB dD+eE
V=K*CAa*CBb
V=K*CDd*CEe
Для элементарных реакций, которые протекают в одну стадию, порядок и молекулярность совпадают.
Изучение порядка реакции позволяет определить механизм реакции (в 1 стадию или несколько).
Правило Вант-Гоффа
Правило Вант-Гоффа — эмпирическое правило, позволяющее в первом приближении оценить влияние температуры на скорость химической реакции в небольшом температурном интервале (обычно от 0 °C до 100 °C).Я. Х. Вант-Гофф на основании множества экспериментов сформулировал следующее правило:
-
При повышении температуры на каждые 10 градусов константа скорости гомогенной элементарной реакции увеличивается в два — четыре раза.
Уравнение, которое описывает это правило следующее:
![]()
где ![]() —
скорость реакции при температуре
—
скорость реакции при температуре ![]() ,
, ![]() —
скорость реакции при температуре
—
скорость реакции при температуре ![]() ,
, ![]() —
температурный коэффициент реакции
(если он равен 2, например, то скорость
реакции будет увеличиваться в 2 раза
при повышении температуры на 10 градусов).
—
температурный коэффициент реакции
(если он равен 2, например, то скорость
реакции будет увеличиваться в 2 раза
при повышении температуры на 10 градусов).
Следует помнить, что правило Вант-Гоффа применимо только для реакций с энергией активации 60-120 кДж/моль в температурном диапазоне 10-400oC. Правилу Вант-Гоффа также не подчиняются реакции, в которых принимают участие громоздкие молекулы, например белки в биологических системах. Температурную зависимость скорости реакции более корректно описывает уравнение Аррениуса.
Из уравнения Вант-Гоффа температурный коэффициент вычисляется по формуле:
![]()
Энергия Активации
В ходе химической реакции взаимодействия продукты образуются не сразу после столкновения исходных веществ, а сначала образуется промежуточный комплекс. Это реальная молекула, в которой старые связи ещё не совсем разорвались, а новые связи не совсем образованы.
При распаде активированного комплекса образуются продукты реакции. Т.о. энергия активации – это энергия, которая затрачивается на образование активного комплекса.
Уравнение Аррениуса
Уравне́ние
Арре́ниуса устанавливает
зависимость константы скорости химической
реакции ![]() от температуры
от температуры ![]() .
.
Согласно
простой модели столкновений химическая
реакция между двумя исходными веществами
может происходить только в результате
столкновения молекул этих
веществ. Но не каждое столкновение ведёт
к химической реакции. Необходимо
преодолеть определённый энергетический
барьер, чтобы молекулы начали друг с
другом реагировать. То есть молекулы
должны обладать некой минимальной
энергией (энергия
активации![]() ),
чтобы этот барьер преодолеть.
Из распределения
Больцмана для
кинетической энергии молекул известно,
что число молекул, обладающих энергией
),
чтобы этот барьер преодолеть.
Из распределения
Больцмана для
кинетической энергии молекул известно,
что число молекул, обладающих энергией ![]() ,
пропорционально
,
пропорционально ![]() .
В результате скорость химической реакции
представляется уравнением, которое
было получено шведским химиком Сванте
Аррениусом из
термодинамических соображений:
.
В результате скорость химической реакции
представляется уравнением, которое
было получено шведским химиком Сванте
Аррениусом из
термодинамических соображений:
![]()
Здесь ![]() характеризует
частоту столкновений реагирующих
молекул,
характеризует
частоту столкновений реагирующих
молекул, ![]() — универсальная
газовая постоянная.
— универсальная
газовая постоянная.
В рамках теории активных соударений зависит от температуры, но эта зависимость достаточно медленная:
![]()
Оценки этого параметра показывают, что изменение температуры в диапазоне от 200 °C до 300 °C приводит к изменению частоты столкновений на 10 %.
В рамках теории активированного комплекса получаются другие зависимости от температуры, но во всех случаях более слабые, чем экспонента.
Уравнение Аррениуса стало одним из основных уравнений химической кинетики, а энергия активации — важной количественной характеристикой реакционной способности веществ.
12. Растворы электролитов
Электролиты – вещества, растворы и расплавы которых проводят электрический ток.
Закон Рауля можно использовать и для электролитов, если ввести поправочный коэффициент:
i – изотермический
Коэффициент показывает во сколько раз температура кипения раствора электролита выше, чем температура кипения, рассчитанная по закону Рауля.
i = Tкип.электр/Tкип.теор. = Tзамерз.электр/Tзамерз.теор
NaCl – i=2
Tкип=i*E*m
Tзамерз=i*K*m
Для электролитов этот коэффициент связан со степенью диссоциации . – это отношение числа молекул распавшихся на ионы, к первоначальному числу молекул.
in n – число частиц, на которое распался электролит.
Закон разведения Освальда.
Если первоначальная концентрация электролита C0, а степень диссоциации то
Kд= C02/1-
Для слабых электролитов: 1-
Kд C02
Kд/ C0)
Закон Рауля: относительное понижение P01 (давление насыщенного пара раствора над читсым растворителем) прямо пропорционально мольной доле растворенного вещества.
13.Аналитический и графический расчет энергии активации.
Энергия, необходимая для перехода вещества в состояние активированного комплекса, называется энергией активации.
Графический
метод: по опытным данным строят график
зависимости ![]() от
от ![]() ,
если всё верно, получается прямая
(типа\), тангенс угла наклона
,
если всё верно, получается прямая
(типа\), тангенс угла наклона ![]()
Аналитический метод: положим, что в небольшом интервале Т энергия активации постоянна.

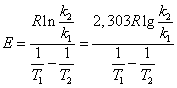
14. Свободная энергия Гиббса.
Энтрапия является критерием самопроизвольного течения процесса только в изолированных системах. На практике надо знать критерии, описывающие реальные процессы.
Рассмотрим изотермический процесс в закрытой системе.
-
Обратимый процесс
Необратимый процесс
SQобр./T
p=const
Qp=H
H-TS=0
G=0
G=H-TS
SQнеобр./T
p=const
H-TS<0
G<0
Таким образом в закрытой системе все самопроизвольно протекающие процессы идут с уменьшением энергии Гиббса.
Условия равновесия G=0
Условия самопроизвольного течения реакции G<0
Все системы самопроизвольно стремятся к равновесию.
Изменение энергии Гиббса – движущая сила процесса.
HF*
Физический смысл изменения энергии Гиббса: -G=Amax, максимально полезная работа, которая совершает система.
Все самопроизвольно протекающие процессы стремятся понизить запас своей энергии, то есть интальпия характеризует стремление к укрупнению частиц, образованию более крупных молекул.
Энтрапия – стремление системы к образованию более мелких частиц.
G – равнодействующая двух противоположных процессов. Для химической реакции:
G0=njG0обр.прод.-niG0обр.исх.в-в
15.Электрохимия
Уравнение Нернста.
Если любой металл (Al, Fe) опустить в воду, то часть ионов металла с поверхности перейдет в воду.
Me0-2e=Me4+
На поверхности раздела фаз возникает двойной электрический слой, обладающий определенным значением электронного потенциала.
Скорость растворения у разных металлов разная.
Если металл опускать раствор своей соли, то получится следующее:
д
 ля
активных металлов (стоящие до водорода)
наблюдается та же картина: пластина
заряжена отрицательно, часть ионов
переходит в воду.
ля
активных металлов (стоящие до водорода)
наблюдается та же картина: пластина
заряжена отрицательно, часть ионов
переходит в воду.
Gраств<0
Энергия гидротации больше, чем работа выхода ионов на поверхности металла.
Zn0-2e=Zn2+
восст. окисл.
для металлов за водородом, энергетически более выгоден следующий процесс: ионы металла из раствора внедряются в кристаллическую структуру металла, заряжая его положительно.

Cu2++2e=Cu0
В обоих случаях на границах раздела фаз возникает электронный потенциал. Его величина зависит от:
природы металла
концентрации раствора
температуры
Влияние этих факторов описывается уравнением Нернста:
восстановительную форму одного и того же элемента.
– статический электронный потенциал
=+(RT/nF)*ln
F – число фарадея; n – число электронов, участвующих в токообразующем процессе
[окисл] – концентрация окислительной формы
[окисл]
[восст]
16. Кинетическое уравнение реакции первого порядка.
A продукты
Пусть в момент времени = 0
CА=a
Если в момент времени прореагировало х моль вещества А, то
C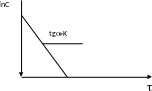 А=(a-х)
А=(a-х)
V=-dCА/d
V=K*CА
-d(a-x)/d=K(a-x)
dx/d=K(a-x)
dx/a-x=Kd
Проинтегрируем:
aa-x dx/a-x=0Kd
ln(a/a-x)=K
Для реакции I порядка в координатной плоскости получается прямая, tg угла которой позволяет рассчитать константы скорости.
H2O H2O+1/2O2
Второй характеристикой реакции I порядка является период полураспада. Это время, через которое распалось половина первоначального количества вещества.
(a-x)=a/2
ln(a/(a/2))=K1/2
ln2= K1/2
