
- •Ионное произведение воды. Водородный показатель. Индикаторы. Буферные растворы.
- •Индикаторы:
- •Оксиды и гидроксиды мышьяка, сурьмы, висмута. Методы получения. Кислотно-основные и ок-вост св-ва.
- •Платиновые металлы. Методы получения на примере платины. Химические свойства металлов.
- •Соединения s-, p- и d-элементов с серой. Классификация сульфидов. Общие свойства.
- •Общая характеристика d-элементов группы II (цинк, кадмий, ртуть). Степени окисления. Особенности соединений ртути. Химические свойства цинка.
- •Химическая связь в комплексных соединениях. Понятие о теории кристаллического поля. Параметр расщипления. Спектрохимическйи ряд лигандов.
- •Сероводород. Сульфиды. Методы получения, химические свойства. Сульфаны. Методы получения, свойства.
- •Методы получения d-металлов групп I и II.
- •Оксиды, гидроксиды железа, кобальта, никеля (методы получения, кислотно-основные, окислительно-восстановительные свойства). Изменение свойств в зависимости от природы элемента.
- •Современная формулировка периодического закона. Периоды, группы, семейства. Строение атомов, валентные электроны.
- •Общая характеристика d-металлов группы VII (степени окисления, химическая активность).
- •Галогениды азота, фосфора, мышьяка, сурьмы, висмута. Получение. Характер связи элемент-галоген. Гидролиз галогенидов.
- •Оксиды, гидроксиды железа, кобальта, никеля (методы получения, кислотно-основные, окислительно-восстановительные свойства). Изменение свойств в зависимости от природы элемента.
- •Углерод, аллотропные модификации углерода. Химические свойства углерода. Карбиды, методы получения, свойства.
- •Аммиак. Методы получения. Химические свойства. Гидразин, гидроксиламин. Их кислотно-основные и окислительно-восстановительные свойства. Азотоводородная кислота.
- •Комплексные соединения железа, кобальта, никеля (получение, устойчивость). Берлинская лазурь, турнбуллева синь.
- •Кислоты р-элементов группы V. Изменение кислотно-основных и окислительно-восстановительных свойств кислот в зависимости от природы элемента и степени его окисления.
- •Общая характеристика соединений платины (оксиды, гидроксиды, соли, комплексные соединения). Биологическая активность соединений платины (II).
- •Расположение металлов в периодической системе. Изменение химических свойств в группах и периодах (на примере 3 периода и группы II).
- •Соединения р-элементов группы V с водородом (эн3). Методы получения. Устойчивость. Особенности кислотно-основных и окислительно-восстановительных свойств соединений.
- •Оксиды азота (I, II, V). Методы получения. Кислотно-основные и окислительно-восстановительные свойства.
- •Общая характеристика d-элементов (особенности электронного строения, проявляемые степени окисления, способность к комплексообразованию).
- •Ионное произведение воды. Водородный показатель. Индикаторы. Буферные растворы.
- •Индикаторы:
- •Галогены. Методы получения. Химические свойства.
- •Соединения d-элементов группы VI (соли, комплексные соединения). Методы получения, ок-восст св-ва. Зависимость св-в от природы элемента. Кластерные соединения молибдена и вольфрама.
- •Кислород. Методы получения, физические свойства. Химические свойства кислорода. Соединения (оксиды, пероксиды, надпероксиды). Получение, свойства.
- •Общая характеристика d-элементов группы I (медь, серебро, золото). Степени окисления. Методы получения металлов. Химические свойства металлов.
- •Оксиды, гидроксиды металлов группы I (s- и d-элементов). Зависимость кислотно-основных свойств от природы металла.
- •Галогены. Кислородосодержащие кислоты хлора. Методы получения. Закономерности в изменении кислотно-основных и окислительно-восстановительных свойств кислот.
- •Соединения d-элементов группы VI (оксиды, гидроксиды). Методы получения, кислотно-основные и окислительно-восстановительные свойства. Изменение свойств в зависимости от природы элемента.
- •Серная кислота. Методы получения. Химические свойства.
- •Оксиды, гидроксиды цинка, кадмия, ртути (получение, устойчивость, кислотно-основные свойства). Изменение свойств в зависимости от природы элемента.
- •Взаимосвязь окислительно-восстановительных свойств веществ, положения их центрального элемента в периодической системе и его степени окисления (на примере кислородосодержащих соединений группы VII).
- •Оксиды р-элементов группы IV. Изменения кислотно-основных и окислительно-восстановительных свойств в зависимости от природы элемента.
- •Общая характеристика d-элементов (особенности электронного строения, проявляемые степени окисления, способность к комплексообразованию).
Кислород. Методы получения, физические свойства. Химические свойства кислорода. Соединения (оксиды, пероксиды, надпероксиды). Получение, свойства.
В промышленности кислород получают фракционной перегонкой жидкокго воздуха. Особо чистый кислород получают электролизом воды, в которую для увеличения электропроводности добавляют сульфат натрия, щелочь или серную кислоту. В лабораторной практике кислород получают термическим разложением солей или оксидов: 2KMnO4=K2MnO4+MnO2+O2; 2HgO=2Hg+O2. Молекула О2 парамагнитна, кратность связи равна двум. Оксидами называются бинарные соединения кислорода, в которых кислород имеет степень окисления -2. Оксиды по химическим свойствам разделяются на солеобразующие и несолеобразующие. Солеобразующие оксиды в зависимости от характера связи делятся на основные, амфотерные и кислотные. В основных оксидах связь преимущественно ионная, в кислотных – ковалентная. В подгруппах s- и p-элементов с возрастванием порядкового номера элемента увеличивается ионность связи, что приводит к усилению основных свойств оксидов. В периоде с возрастанием порядкового номера элемента увеличивается степень ковалентности связи в оксидах и усиливаются их кислотные свойства. С возрастанием степени окисления элемента связь в оксиде становится более ковалентной и, следовательно, должны усиливаться кислотные свойства. d-Элементы в низших степенях окисления образуют основные оксиды, а в высших – кислотные. Пероксиды и надпероксиды получают при сгорании щелочных и щелочноземельных металлов на воздухе:
2Na+O2=Na2O2
K+O2=KO2.
Водой эти соединения легко разлагаются: Na2O2+2H2O=2NaOH+H2O2; 2KO2+2H2O=2KOH+H2O2+O2. Пероксиды и надпероксиды проявляют окислительные свойства: KO2+CrCl3+4KOH=K2CrO4+3KCl+2H2O, а с сильными окислителями – восстановительные: 5BaO2+2KMnO4+8H2SO4=2MnSO4+5O2+5BaSO4+K2SO4+8H2O.
Общая характеристика d-элементов группы I (медь, серебро, золото). Степени окисления. Методы получения металлов. Химические свойства металлов.
Атомы d-элементов I группы так же, как и атомы щелочных металлов, имеют один s-электрон на внешнем уровне, но валентными являются и электроны на предвнешнем d-подуровне. Завершение (n-1)d-подуровня происходит за счет проскока внешнего s-электрона на d-подуровень. Но при этом полной стабильности не достигается и при образовании химической связи, участвуют в образовании и 1 или 2 электрона с предвнешнего подуровня. Наиболее устойчивыми степенями окислениями являются: для меди - +2, Для золота +3, для серебра +1.
Химическая активность d-элементов сравнительно невелика и уменьшается с возрастанием порядкого номера элемента. В ряду Cu-Ag-Au химическая активность следовательно уменьшается.
Получение МЕДИ: Основными примесями медных руд являются кварц SiO2 и силикаты, а также соединения железа, главным образом FeS2 .
2FeS+3O2=2FeO+2SO2
2FeO+ SiO2 =Fe2SiO4
2Cu2S+3O2=2Cu2O+ 2SO2
2Cu2O+ Cu2S=6Cu+ SO2
Получение СЕРЕБРА: Серебро получают из неочищенных металлов меди, свинца. Для выделения серебра из черного свинца к нему добавляют жидкий цинк который образует с серебром прочные соединения Ag2Zn3, Ag2Zn5 .Эти соединения растворимы в жидком свинце, и всплывают на поверхность , образуя «серебряную пленку».
Получение ЗОЛОТА: Золото получают промывкой из измельченных золотоносных пород. Этот метод основан на большой разности плотностей Au и SiO2 .Часто промывку совмещают с амальгамным методом выделения золота. Промываемую породу пропускают через медный лист обработанный ртутью.
Метод Багратиона:
4Au+8NaCN+2H2O+ O2 =4Na[Au(CN)2]+4NaOH
2Na[Au(CN)2]+Zn=Na2[Zn(CN)4]+2Au
Медь взаимодействует с кислородом с образованием Cu2O и CuO. Медные изделия на воздухе покрываются серо-зеленой пленкой:
2Cu+ O2+H2O+CO2=(CuOH)2CO3
золото и серебро взаимодействуют с килородом только в присутствии цианид-ионов или сероводорода:
4Au+O2 + 8KCN+2H2O= 4K[Au(CN)2]+4KOH
4Ag+O2 +2H2S=2Ag2S++2H2O
Медь и серебро при нагревании реагирует с серой с обраованием Э2S. С хлором эти металлы образуют CuCl2 ,AgCl, AuCl3.
Медь и серебро растворяются в азотной и концентрированной серной кислотах:
Ag+2HNO3=AgNO3 +NO2+H2O
Ag+2H2SO =Ag2SO4 +SO2 +2H2O
2Au+6H2SeO4=Au2(SeO4)3+3SeO2 +6H2O
Au +HNO3 + 4HCl=H[AuCl4]+NO +2H2O
KClO3+3NaNO2→KCl+3NaNO3
Билет 21
Теория кристаллического поля. Объяснение магнитных и оптических свойств комплексных соединений.
Комплексные соед-я - молекулярные соединения, сочетание отдельных компонентов которых приводит к образованию сложных ионов или молекул, способных к самост. существованию, как в кристалле, так и в растворе.
Качественное описание координационной связи можно получить, используя модели: теория кристаллического поля и метод валентных связей.
Основные положения ТКП:
Механизм образования связей в корд.соед. объясняется чисто электростатическим взаимодействием между центральным ионом и лигандами.
Лиганды независимо от их реальной структуры представляют как точечные заряды
Электронная конфигурация центр.иона рассматривается в рамках квантовохимических представлений.
ТКП приложима для описания хим.связи корд.соед. исключительно d- и f-элементов.
Рассмотрим магнитные свойства комплексных соединений на примере октаэдрического комплекса. Покажем распределение электронов на примере конфигурации d6
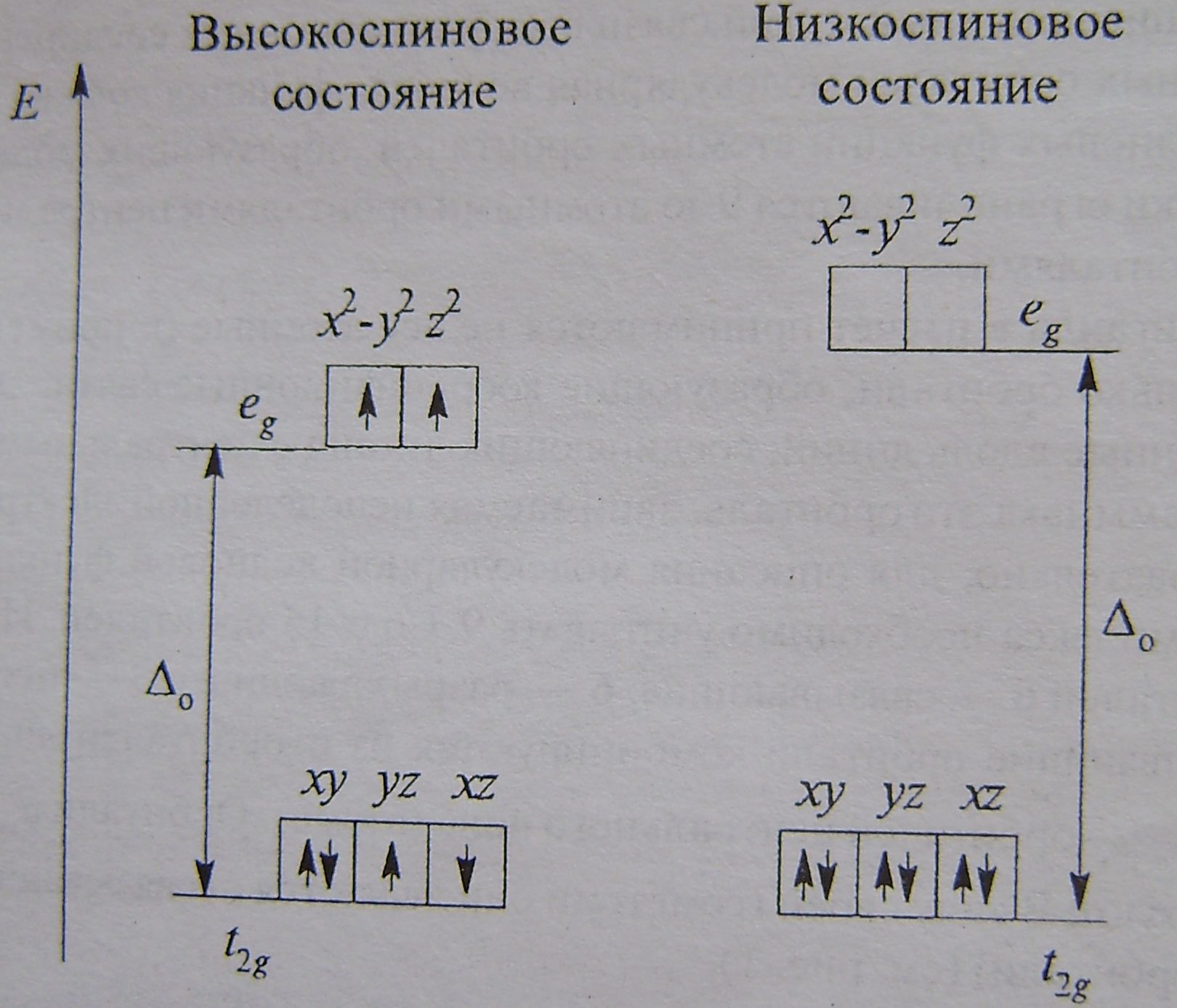 Схема
заполнения d-орбиталей
в слабом и сильном полях.
Схема
заполнения d-орбиталей
в слабом и сильном полях.
Реализация высоко- и низкоспиновых состояний определяется расщеплением (∆0), точнее соотношением между ∆0 и энергией P, затрачиваемой на размещение на одной орбитали двух электронов. При ∆0 >P реализуется низкоспиновая конфигурация, наоборот-высокоспиновая.
Высоко- и низкоспиновые конфигурации различаются и магнитнымисвойствами. Выслокоспиновая конфигурация характеризуется и более высокими магнитными моментом.
Можно предполагать, что для лигандов сильного поля реализуется низкоспиновая конфигурация, а для лигандов слабого-высокоспиновая. Это подтверждается эксперементально.
Оксиды углерода. Методы получения, кислотно-основные, окислительно-восстановительные свойства оксидов углерода. Угольная кислота, карбонаты, получение, свойства. Растворимость карбонатов. Сода, ее получение.
Углерод образует ряд оксидов: CO, СО2, С3О2 и другие. СО – оксид углерода (II) образуется при неполном сгорании угля, а также при разложении муравьиной кислоты: НСООН=СО+Н2О. Оксид углерода (II) проявляет кислотные свойства и со щелочами образует соли муравьиной кислоты – формиаты: CO+NaOH=HCOONa. СО – сильный восстановитель и легко вступает в реакции присоединения с образованием карбонилов неметаллов: CO+Cl2=COCl2; CO+S=COS и металлов: 5CO+Fe=Fe(CO)5; 10CO+2Mn=Mn2(CO)10.
СО2 – оксид углерода (IV), углекислый газ, продукт полного сгорания угля и углеводородов.
С3О2 – бесцветный газ с удушливым запахом, при нагревании разлагается: C3O2=CO2+C.
Угольная кислота H2CO3 – слабая кислота. Молекулы Н2СО3 существуют только в растворе. Соли угольной кислоты – карбонаты. Большинство карбонатов малорастворимо в воде. Хорошо растворяются только карбонаты Na, K, Rb, Cs, Ti и карбонат аммония.Для щелочных металлов известны гидрокарбонаты.
Сода Na2CO3. 2NaHCO3=Na2CO3+CO2+H2O. Не растворимые в воде карбонаты получают по обменной реакции солей с содой или с другими растворимыми карбонатами.
