
- •2.Движущая сила при массообмене.
- •4.Абсорбция. Область применения. Материальный баланс при абсорбции и рабочая линия процесса.
- •5. Конструкции абсорберов.
- •7) Адсорберы и схемы адсорбционных установок
- •9. Ионообменные процессы
- •10. Перегонка и ректификация. Основные понятия. Простая перегонка.
- •11. Экстракция в системе жидкость-жидкость и твердое тело – жидкость. Массопередача при экстракции.
- •12. Экстракция в системе жидкость-жидкость. Схемы процессов экстракции. Конструкция экстракторов.
- •13. Экстракция в системе твердое тело-жидкость. Устройство экстракционных аппаратов для выщелачивания.
- •15. Способы кристаллизации. Технические устройства для кристаллизации из растворов.
- •16.Основы теории растворения
- •17. Сушка. Основные понятия процесса.
- •18. Влажность и влагосодержание материала. Равновесное влагосодержание.
- •24. Электрофизические методы обработки пищевых продуктов. Общие сведения. Обработка пищевых продуктов в электростатическом поле.
- •25. Обработка пищевых продуктов токами промышленной частоты. Обработка пищевых продуктов в вч и свч полях. Обработка пищевых продуктов ик лучами.
- •21. Расчет процесса сушки.
- •20.Кривая сушки
Способы
кристаллизации. Для
выделения растворенного вещества в
виде кристаллов надо довести раствор
до состояния пересыщения. Это достигается
одним из следующих способов: - 1)сгущением
раствора и повышением концентрации
растворенного вещества
за счет выпаривания части растворителя
при кипении раствора в выпарном аппарате
или за счет испарения растворителя в
воздух при температурах ниже точки
кипения; -2)охлаждением раствора для
понижения растворимости; -3) добавлением
в раствор веществ, связывающих
растворитель (воду) или уменьшающих
растворимость («высаливанием»). В
соответствии с этими способами различают
изотермическую кристаллизацию (при
постоянной температуре кипения),
изогидрическую (при постоянстве
количества растворителя) и
изотермически-изогидрическую (когда
убыль растворителя из кипящей массы
возмещается внешней подпиткой раствора).
Эта терминология условна, так как в
действительности в кристаллизующейся
массе имеют место температурные и
условия изотермичности или изогидричности
строго не выдерживаются. Процесс
кристаллизации может проводиться как
в периодическом режиме, так и в
непрерывном. Это, как правило, определяется
масштабом производства.
Кристаллизаторы
делятся на аппараты периодического и
непрерывного действия, а также с отгонкой
части растворителя и с охлаждением
раствора.
Кристаллизаторы
непрерывного действия:
Эти аппараты состоят из концентратора,
кристаллогенератора и камеры роста
кристаллов. Конструкция аппарата должна
обеспечивать интенсивную циркуляцию,
препятствующую осаждению кристаллов
в аппарате, улучшающую теплоотдачу и
обеспечивающую получение равномерных
по величине кристаллов.
Простейшие
кристаллизаторы периодического действия
– вертикальные
цилиндрические аппараты со змеевиками
и механическими мешалками. Процесс
кристаллизации в них ведётся одновременно
с охлаждением раствора. В пищевой
технологии применяют в основном два
типа кристаллизаторов: корытного типа
и вращающиеся барабанные.
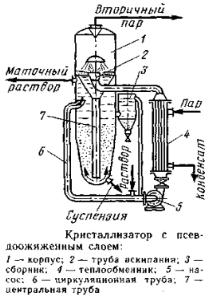
Кристаллизаторы
с псевдоожиженным слоем
Кристаллизаторы
с псевдоожиженным слоем позволяют
интенсифицировать процесс. Кристаллизация
может проводиться как с удалениемчасти
растворителя путем его испарения, так
и при охлаждении раствора. Исходный
раствор смешивается вциркуляционной
трубе с циркулирующим маточны м
раствором, смесь нагревается в
теплообменнике и поступает через трубу
вскипания в аппарат, где происходит
интенсивное парообразование.Пересыщенный
раствор опускается внижнюю часть
кристаллизатора. Здесь засчет циркуляции
раствора создаетсяпсевдоожиженный
слой. Образовавшиеся крупные кристаллы
(до 2 мм) оседаютна дно и выводятся из
аппарата, а мелкиепродолжают расти
либо удаляются через сборник 3.
Интенсивное перемешивание суспензии
в псевдоожиженном слое увеличивает
скорость диффузии вещества врастворе
и ускоряет процесс роста кристаллов.
При этом уменьшается степень пересыщения
раствора и скорость роста кристаллов
оказывается большей, чем скорость
образования центров кристаллизации.
При кристаллизации в псевдоожиженном
слое получают кристаллы более низкого
фракционного состава, чем при других
методах.
Растворение
– процесс, обратный кристаллизации.
Это образование однородного раствора
из твердой и жидкой фаз. Растворение
происходит при концентрации растворяемого
продукта, меньшей концентрации насыщения.
Этот процесс включает несколько
последовательных стадий: 1)перенос
растворителя к поверхности 2)химическую
межфазную реакцию на поверхности 3)отвод
продуктов растворения от поверхности
реакции В
зависимости от того, какая из стадий
наиболее медленная и ограничивает
скорость процесса, различают след.
предельные области процесса растворения: -кинетическую,
если скорость процесса определяется
наиболее медленной стадией химического
взаимодействия на поверхности; -диффузионную,
когда
процесс ограничивается скоростью
транспорта(подвода) реагента к поверхности
и отвода продуктов реакции в объём
системы. Твердые
вещества в зависимости от того, как
меняется их растворимость с повышением
температуры, могут обладать «положительной»
или «отрицательной» растворимостью.
Если растворимость увеличивается с
повышением температуры, такие вещества
обладают «положительной» растворимостью,
если снижается, говорят об «отрицательной»
растворимости вещества в данном
растворителе. Раствор,
находящийся в равновесии с твердой
фазой при данной температуре, называется
насыщенным. Перенасыщенным
называют такие растворы, в которых
концентрация растворенного вещества
больше его растворимости. Перенасыщенные
растворы не устойчивы, легко переходят
в насыщенные растворы. При таком переходе
из перенасыщенных растворов выпадает
твёрдая фаза. Растворы,
в которых ещё может растворятся данное
вещество, называются ненасыщенными. Если
скорость процесса определяется
соизмеримыми скоростями превращения
на поверхности и диффузии через
пограничный слой у поверхности, процесс
протекает в промежуточной,
диффузионно-кинетической области
растворения. Большинство
промышленных процессов растворения
протекает в диффузионной области и
описывается уравнениями диффузионной
кинетики. Обычно полагают, что поверхность
растворяемого вещества равнодоступна
для растворителя, что обеспечивается
благоприятными гидродинамическими
условиями(перемешивание, циркуляция..и
т.п) Результат
растворения состоит в получении раствора
с требуемой концентрацией растворённого
вещества. Растворённое вещество не
может превышать концентрации насыщенного
раствора, т.е растворимости при данной
температуре. Растворение характеризуется
порядком реакции α. Для
простых реакций скорость растворения
пропорциональна концентрации активного
компонента у поверхности, поэтому
предельная плотность потока вещества
у поверхности при постоянной температуре:
jк=
k
Cн
α, Где
jк-
плотность потока растворяющего
вещества,кг/(м2*с); k-коэф.
скорости растворения; Где
C-концентрация
растворяемого компонента в объёме,
кг/м3 β-коэф.
массотдачи,м/c Приравнивая
jк=jD,
получаем
общее
уравнение диффузионно-кинетического
режима:
kCн
α=β(Cн-C)
15. Способы кристаллизации. Технические устройства для кристаллизации из растворов.
16.Основы теории растворения
