
Строение слитков
При медленном охлаждении с равномерным отводом тепла образуются кристаллы равноостные. Если же имеет место направленный отвод тепла, то происходит формирование древовидных кристаллов, называемых дендритами.
Различие в химическом составе различных зон и участков слитка называется ликвацией. Химическая неоднородность, обусловленная формированием дендритной структуры, называется дендритной ликвацией. Структура слитков зависит от многих факторов.
Схемы структуры слитков.
Типичная
структура слитка состоит из трёх зон.
Залитый в литейную форму металл начинает
кристаллизоваться в местах соприкосновения
со стенками литейной формы. Большая
степень охлаждения способствует
образованию большого количества центров
кристаллизации, в результате чего
образуется зона мелких равноостных
кристаллов (первая зона). В результате
уменьшения степени переохлаждения и
наличия направленного теплоотвода
формируется зона
крупных столбчатых кристаллов.
В центре слитка имеет место незначительная степень переохлаждения, отсутствует направленный теплоотвод, в результате чего формируется зона крупных равноостных кристаллов. Вследствие того, что верхняя часть слитка кристаллизуется в последнюю очередь, происходит уменьшение объёма вследствие перехода металла из жидкого в твёрдое состояние. Это обусловлено тем, что растворимость газов в твёрдом металле меньше, чем в жидком. В верхней части слитка формируется усадочная раковина.
Применяя различные технологические приёмы можно изменять количественное соотношение зон или исключить из структуры одну из зон. Например, при быстром охлаждении и перегреве металла перед разливкой, можно получить структуру, состоящую из зоны крупных столбчатых кристаллов. Данная структура называется транс кристаллической.
Низкая температура разливки металла, введение модификаторов и медленное охлаждение позволяет получать структуру, состоящую из крупных равноостных кристаллов. Слитки имеют неоднородный состав. По направлению от стенок к центру и снизу вверх количество примесей и легирующих элементов увеличивается. Химическая неоднородность по различным зонам слитка называется зональной ликвацией.
В процессе кристаллизации жидкий металл уменьшается в объёме, что приводит к образованию пустот, называемых усадочными раковинами. При производстве стали в ней находится большое количество кислорода, для удаления которого в сталь вводят элементы, обладающие большим сродством к кислороду, по сравнению с железом. Данный процесс называется раскислением, а эти элементы раскислителями. В зависимости от применяемых веществ или от способа раскисления бывают:
Спокойные стали - их усадочная раковина сконцентрирована в верхней части слитка
Кипящие стали – пустоты распределены по всему объёму слитка (Mn)
Полуспокойные стали – занимают промежуточное положение (раскисляется Mn, Al)
Усадочная
раковина
Усадочная раковина
Усадочная раковина




Атомы
того или иного вещества могут образовывать
(теоретически) любой тип кристаллической
решётки. Однако, устойчивым, а,
следовательно, реально существующим,
будет решётка, которая обеспечит
минимальный запас свободной энергии
системы. Однако, в ряде случаев, при
изменении температуры или давления
может оказаться, что для одного и того
же вещества более устойчивой будет
другой тип решётки, чем решётка, при
других температуре и давлении.
Существование одного и того же вещества
в нескольких кристаллических формах
называется полиморфизм
или аллотропия.
Различные кристаллические формы одного
вещества называются полиморфными и
аллотропическими модификациями.
Аллотропические формы обозначаются с
помощью греческих букв
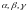 ,
которые в виде индекса добавляются к
символу, обозначающему элемент.
Аллотропическая форма, существующая
при самой низкой температуре обозначается
как
,
которые в виде индекса добавляются к
символу, обозначающему элемент.
Аллотропическая форма, существующая
при самой низкой температуре обозначается
как
 ,
а последующие
,
а последующие
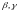 и т.д. Полиморфное превращение при
нагреве сопровождается поглощением
тепла и происходит при постоянной
температуре. При охлаждении тепло
выделяется. Для полиморфных превращений
характерен гистерезис.
и т.д. Полиморфное превращение при
нагреве сопровождается поглощением
тепла и происходит при постоянной
температуре. При охлаждении тепло
выделяется. Для полиморфных превращений
характерен гистерезис.
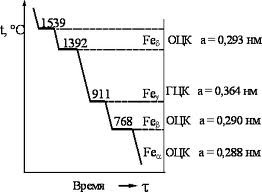
Температура, при которой осуществляется переход из одной модификации в другую называется температурой полиморфного (аллотропического) превращения. Полиморфное превращение сходно с процессом кристаллизации и заключается в образовании зародышей новой модификации и последующего их роста.
Полиморфные превращения характеризуются большими степенями переохлаждения или перегрева, а также, высокотемпературная модификация, как правило, имеет более простое строение и большую пластичность.
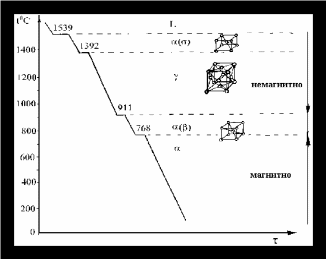
Рис. 1 Кривая охлаждения для чистого железа
Первая горизонтальная площадка обусловлена процессом кристаллизации. 1392 градуса – выгодной становится ГЦК (вместо ОЦК). При дальнейшем охлаждении (911 градусов) опять становится выгодна ОЦК.
Железо (Fe), никель (Ni) и кобальт (Co) относятся к ферромагнетикам, т.е. обладают способностью хорошо намагничиваться, однако при нагреве магнитные свойства постепенно уменьшаются и при достижении определённой температуры, называемой точкой Кюри – пропадают. Магнитное превращение, в отличие от полиморфного, имеет ряд особенностей:
Магнитные свойства постепенно уменьшаются, по мере приближения к точке Кюри
Магнитное превращение не имеет гистерезиса (протекает в одной и той же температуре, независимо от того нагрев это или охлаждение)
Механические и другие физические свойства в результате превращения не изменяются
Магнитное превращение не сопровождается перекристаллизацией (т.е. новые зёрна не образуются, и сохраняется тип кристаллической решётки)
Типы фаз, образующихся в металлических сплавах
Сплав получается в результате сплавления двух (или >) компонентов. В сплавах могут присутствовать следующие фазы, а именно:
Жидкий раствор
Твёрдый раствор
Химические соединения
Твёрдые растворы – это фазы переменного состава. При образовании твёрдого раствора один из компонентов сохраняет свою кристаллическую решётку (растворитель), а другой компонент не сохраняет свою решётку (растворённое вещество), а отдаёт атомы в решётку растворителя. Бывают твёрдые растворы внедрения и твёрдые растворы замещения. Так как размеры атомов растворителя и растворённого вещества различаются, то образование твердых растворов приводит к искажениям кристаллической решётки растворителя и изменению её параметров. При образовании твердых растворов внедрения атомы растворённого вещества располагаются в междоузлье кристаллической решётки растворителя. Твёрдые растворы внедрения характеризуются ограниченной растворимостью.
Атомы растворённого компонента часто концентрируются возле дислокаций, образуя атмосферу или облако Коттрелла. При образовании твердых растворов замещения атомы растворённого вещества замещают атомы растворителя в узлах его кристаллической решётки, причём располагаются неупорядоченно.
Твердые растворы замещения могут быть:
Ограниченными
Неограниченными
При неограниченной растворимости – любое количество атомов растворителя может быть замещено на атомы растворённого вещества. Для неограниченной растворимости необходимо соблюдение ряда условий:
Оба компонента должны иметь одинаковый тип кристаллической решётки (т.е. быть изоморфными)
Атомы компонентов должны иметь достаточно близкие размеры (величина расхождения не превышает 15%)
Компоненты должны принадлежать к одной или соседним группам периодической системы (т.е. должны иметь сходное строение внешних валентных электронных уровней)
Химические соединения
Имеют ряд особенностей, отличающих их от твердых растворов:
Кристаллическая решётка химического соединения отличается от решёток веществ, его образующих
Атомы компонентов кристаллической решётки химического соединения располагаются упорядоченно
Химическое соединение существует при определённой концентрации компонентов и может быть описано формулой: АnВm
Свойства химического соединения резко отличаются от свойств компонентов его образующих
Размеры атомов компонентов, образующих химическое соединения, и их строение могут принципиально различаться
Образование химического соединения металла с неметаллом происходит вследствие возникновения ионной связи. Называется интерметаллидом. Интерметаллиды в отличие от химических соединений не подчиняются законам валентности и не имеют постоянного состава. В том случаи, если оба компонента не растворяются друг в друге и не образуют химических соединений, твёрдое вещество будет представлять собой механическую смесь чистых компонентов.
Диаграммы состояния сплавов
Фаза – это однородная часть системы, отделённая от других частей системы поверхностью раздела, при переходе через которую химический состав структуры и свойства изменяются скачкообразно. Соответственно компоненты – это вещества, образующие систему.
Процесс кристаллизации металлических сплавов и некоторые закономерности их строения описываются с помощью диаграмм состояния (диаграмм фазового равновесия). Эти диаграммы в графической форме показывают фазовый состав и структуру в зависимости от температуры системы и концентрации компонентов. Диаграммы состояния построены для равновесных условий.
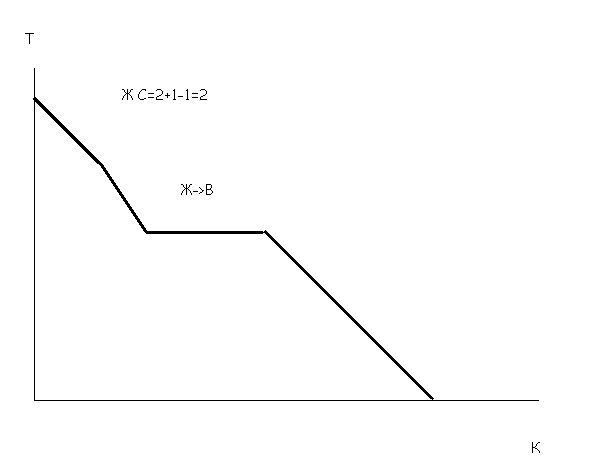
Общие закономерности существования устойчивых фаз, отвечающие теоретическим условиям равновесия, могут быть выражены в виде формулы, называемой «Закон Гиббса» или «Правило фаз». Правило фаз устанавливает зависимость числа степеней свободы системы от числа компонентов, числа фаз и внешних факторов, оказывающих влияние на системы.
Закон Гиббса:
v = п + е — r, (или С=К+2-Ф)
где v — число независимых вариаций внешних и внутренних факторов равновесия системы или число степеней её свободы; n — число её независимых слагаемых (внутренних факторов равновесия), или число тех тел, концентрация которых может быть независимо изменена; е — число внешних факторов равновесия (таковыми являются: температура, давление, капиллярное натяжение, электровозбудительная сила, различное напряжение силы тяжести и т. д.); r — число фаз, то есть физически отличных состояний материи, разделённых (r — 1) числом поверхностей раздела
Под числом степеней свободы системы понимают число внешних и внутренних факторов, которые можно изменять без изменения числа фаз в системе. К внешним факторам относятся температура и давление, к внутренним – концентрация. Если число степеней свободы системы равно 0 (т.е. система нонвариантная), то изменение факторов температуры, давления или концентрации будет приводить к изменению числа фаз в системе.
С учётом того, что для металлических систем практически существующие давления не оказывают существенного влияния на состояние системы, то при использовании правила фаз для металлических систем таким фактором как давление пренебрегают, и правило фаз принимает следующий вид:
С=К+1-Ф
Диаграмма состояний в графической форме показывает фазовый состав и структуру материалов (сплавов) в зависимости от температуры и концентрации. Если система однокомпонентная (концентрация=100%), то диаграмма состояния будет иметь одну шкалу (температурную). Если система двухкомпонентная, то диаграмма будет иметь два измерения – температура и концентрация. Изменение фазового состава сплава на диаграмме изображается точкой. Линия, соединяющая точки аналогичных превращений разграничивает диаграмму на области идентичных фазовых состояний.
Диаграмма состояния сплавов, компоненты которой образуют механические смеси (диаграмма состояния первого рода).
Оба компонента в жидком состоянии неограниченно растворимы друг в друге, в твёрдом состоянии не растворяются друг в друге и не образую химических соединений. Компонентами данной системы будут вещества А и В и на диаграмме состояния будет присутствовать 3 фазы:
Вещество А
Вещество Б
Жидкая фаза

Общий вид диаграммы состояний
Пример:
Возьмём сплав II (состав: 80% А, 20% В)
Превращение, в результате которого образуется смесь двух и более видов кристаллов, одновременно кристаллизующихся из жидкой фазы, называется эвтектическим, а образующаяся смесь кристаллов – эвтектикой.
Сплав 3 (состав 30% А и 70% В)
Линия на диаграмме состояния, отвечающая при охлаждении началу процесса кристаллизации называется «линия ликвидус» (лат. Жидкий, для нашей диаграммы кривая линия DCE). Линия на диаграмме состояния, отвечающая окончанию кристаллизации, называется линия солидус (линия FG).
Сплавы, лежащие левее точки С называются доэвтектическими, правее – заэвтектические, состава точки С – эктевтические. Для любой точки, лежащей в двухфазной области можно определить составы фаз, находящихся в равновесии и их количество. Для определения состава фаз через точку, характеризующую состояние сплава необходимо провести горизонтальную линию (каноду) до пересечения с линиями, ограничивающими данную область диаграммы. Проекции точек пересечения на ось концентрации укажет составы фаз. Для определения количества фаз, через данную точку проводят каноду. Соответственно, отрезок между данной точкой и точкой на линии диаграммы обратнопропорционален количеству данной фазы. Количество фазы равно отношению длины отрезка, прилегающего к противоположной фазе ко всей длинне каноды.
Вышесформулированное правило называется правилом рычага (отрезков).
Диаграмма состояния сплавов с неограниченной растворимостью компонентов в твёрдом состоянии (диаграмма состояния 2ого рода).
Компоненты, неограниченно растворимы друг в друге в твёрдом и жидком состоянии. Компонентами будут вещества А и В. Фазы: Жидкая (L) и твердый раствор (a).
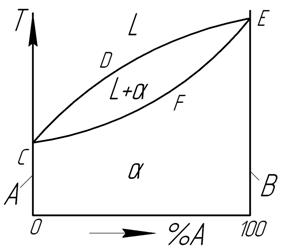
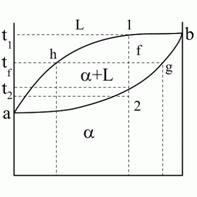
Диаграмма состояния сплавов с ограниченной растворимостью компонентов в твёрдом состоянии.
Компоненты: вещества А и В
Фазы: Жидкая, а-ограниченный твёрдый раствор компонента В в компоненте А(А(В)), В(А)
Компоненты неограниченно растворимы в жидком состоянии, ограниченно растворимы в твёрдом и не образуют химических соеднинений.
Диаграмма с эвтектикой
“вставить рисунок”
Превращение, в результате которого твёрдый раствор (твердая фаза) распадается с образованием 2х новых фаз называется эвтектоидным, а образующаяся смесь кристаллов называется эвтектоидом.
Первичная кристаллизация в реальных условиях
Диаграммы состояния описывают превращения для равновесных условий. Линии на диаграммах отвечают состоянию, когда свободные энергии фазовых состояний равны между собой. В реальных условиях все превращения (даже нонвариантные, где число степеней свободы системы = 0)будут протекать в интервале температур и выше или ниже равновесной температуры. Причём, величина отклонения от равновесной температуры и ширина температурного интервала превращения будут тем выше, чем больше скорость нагрева или охлаждения. В реальных условиях изменяется не только температура начала или окончания превращения, но и состав фаз: исходной и образующейся.
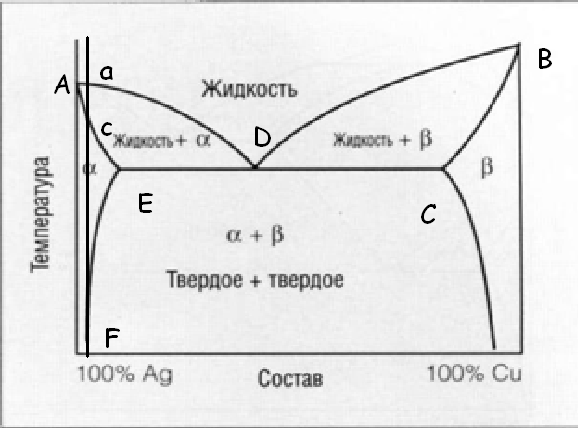
В соответствии с равновесной диаграммой процесс кристаллизации начинается в точке а, причём по ере понижения температуры состав жидкой фазы изменяется по линии ликвидус, а состав кристаллов альфа твердого расствора по линии солидус. Причём, в начале кристаллизации состав жидкой фазы соответствует среднему составу сплава, но по мере понижения температуры отклоняется от него, обогащаясь компонентом В. В свою очередь, кристаллы альфа-фазы в начальный момент времени обогащены компонентом а и отличаются от среднего, но по мере снижения температуры приближаются к нему, а по окончании кристаллизации – соответствуют. После окончания кристаллизации, сплав состоит из гомогенных кристаллов альфа-фазы.
Для протекания этих процессов необходимо диффузионное перемещение атомов. Она является достаточной для жидкого расствора и превращения в жидкой фазе соответстуют равновесным. В твердой фазе в реальных условиях подвижность атомов недостаточна и превращение запаздывает. Состав твердой фазы будет описываться не равновесной линией bE, а неравновесной линией bЕ`. Структура литых сплавов сильно отличается от равновесной. После охлаждения наш сплав будет иметь структуру, состоящую из негомогенного твердого раствора, а в ряде случаев ещё и кристаллов эвтектики. В реальных условиях возможно образование чисто эвтектической структуры у-, до- и заэвтектических сплавов. В реальных условиях, из жидкой фазы альфа-кристаллы выделяются левее(ниже) линии АD и её продолжения, а кристаллы бета-фазы выделяются правее линии BD и её продолжения. И если в процессе кристаллизации переохладить жидкость в заштрихованную область, то жидкость оказывается пересыщенной и кристаллами альфа и кристаллами бета. В результате этого сплав будет иметь чисто эвтектическую структуру, состав которой отличается от равновесной (квазиэвтектика).
При вторичной кристаллизации, когда в превращении участвуют только твердые фазы, диффузия является недостаточной как в исходной, так и в образующейся фазе.
При небольших степенях переохлаждения относительно равновесной температуры бета-фаза выделяется по границам зёрен исходной альфа-фазой и кристаллы бета-фазы не имеют определённой ориентации, относительно исходной альфа-фазы.
При больших степенях переохлаждения кристаллы бета-фазы выделяются как по границам, так и внутри зёрен альфа-фазы. Количество зародышей велико, а их размер мал. Причём, кристаллическая решётка бета-фазы сориентирована относительно решётки альфа-фазы таким образом, что пограничный слой атомов в равной степени принадлежит обеим фазам. Такое сочленение кристаллических решёток называется когерентным. Вследствие того что кристаллические решётки отличаются, на границе раздела фаз возникают большие напряжения. При повышении температуры подвижность атомов увеличивается и происходит обособление кристаллических решёток альфа и бета фаз (срыв когерентности).
Связь между свойствами сплавов и типом диаграммы состояний (правило Курнакова).
Для диаграммы состояний первого рода: при образовании механических смесей свойства сплава зависят от свойств фаз, его образующих, поэтому зависимость носит линейный характер.
Для диаграммы состояний второго рода: образование твёрдого раствора приводит к резкому изменению свойств. Зависимость криволинейная
Для диаграммы состояний третьего рода: в случаи ограниченной растворимости в однофазной области зависимость криволинейная, в двухфазной – линейная
Для диаграммы состояний четвертого рода: при образовании твёрдого раствора на кривой есть точка перегиба (сингулярная точка) для сплава сингуляции, отвечающая химическому соединению.
Деформация. Влияние нагрева на структуру и свойства деформированного металла.
Деформация – это изменение формы и размеров вещества, под действием приложенных сил. Силы могут быть внешние, обусловленные приложением внешней нагрузки, а также внутренние, вызванные протеканием различных физико-химических процессов.
В зависимости от вида сил различают внешние напряжения, исчезающие после снятия внешнего воздействия и внутренние напряжения, уравновешивающиеся в объёме тела. В зависимости от локализации, внутренние напряжения делятся на:
Напряжения первого рода, которые уравновешиваются в объёме всего тела (макронапряжение)
Напряжение второго рода, уравновешиваются в объёме зерна (микронапряжения)
Напряжения третьего рода – локализуются в объёме кристаллической ячейки (субмикронапряжения)
Деформация бывает:
Упругая деформация – не вызывает заметных изменений в структуре и свойствах металлов. Она исчезает после снятия приложенной нагрузки. При упругой деформации не происходит смещения атомных слоёв друг относительно друга (б)
Пластическая деформация - форма изменения сохраняется после снятия нагрузки (в)
Зная величину силы связи между частицами и количество атомов в плоскости скольжения, можно определить теоретическую прочность кристаллов. Низкая прочность кристаллов, существенно отличающаяся от теоретической, обусловлена наличием кристаллов дислокации и их относительно лёгкой подвижностью. С целью затруднения или уменьшения подвижности дислокаций применяют пластическую деформацию для повышения их плотности, а также термическую обработку для измельчения зерна. Прочность повышается также при легировании металлов. Это обусловлено тем, что размеры чужеродных атомов отличаются от размеров атомов самого металла, это приводит к искажению кристаллической решётки, что затрудняет перемещение дислокаций.
Металлы могут находиться в хрупком и вязком состоянии. При хрупком состоянии металл разрушается под действием приложенной нагрузки без пластической деформации. При вязком состоянии разрушение происходит после значительной пластической деформации.
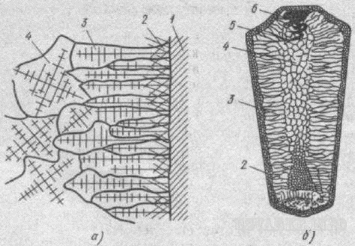
При понижении температуры металл переходит в хрупкое состояние. Данное явление называется хладноломкостью. Температура перехода металла в хрупкое состояние называется порогом хладноломкости. При пластической деформации изменяется не только структура металлов, но и форма его зёрен. При деформации образуется волокнистая структура с определённой ориентацией зёрен металлов. При пластической деформации твёрдость и прочность металла возрастает, а пластичность уменьшается. Данное явление называется НАКЛЁП. Состояние наклёпа является энергетически невыгодным для системы, однако может сохраняться длительное время при комнатных температурах, вследствие малой подвижности атомов. При нагреве 0,3 от температуры плавления подвижность атомов возрастает, что приводит к снятию внутренних напряжений второго и третьего рода. Это приводит к незначительному снижению твёрдости и прочности (на 20%) и повышению пластичности. Данное явление называется ВОЗВРАТ. При возврате существенных структурных изменений не наблюдается. При дальнейшем повышении температуры на границах деформированных зёрен происходит зарождение новых равноостных зёрен. Данный процесс называется первичной рекристаллизацией. Когда вместо ориентированной волокнистой структуры образуется структура, состоящая из равноостных зёрен, первичная рекристаллизация заканчивается. Если металл продолжать выдерживать при повышенной температуре, происходит рост одних кристаллизованных зёрен за счёт других. Данный этап называется собирательной рекристаллизацией.
Структура исходного металла до деформации.
Структура металла после деформации
Начало первичной рекристаллизации
Структура из равноостных зёрен небольшого размера
Окончание первичной рекристаллизации
Структура металла после собирательной рекристаллизации
Температура начала рекристаллизации зависит от абсолютной температуры плавления металла или сплава. Коэффициент альфа зависит от структуры и состава металла и сплава. Температура рекристаллизации имеет важное практическое значение, а именно: для того, чтобы полностью восстановить структуру после пластической деформации, металл необходимо нагреть выше температуры рекристаллизации. Такая обработка называется рекристаллизационным отжигом. Рекристаллизационный отжиг применяется как межоперационная термическая обработка, при холодной деформации металлов, или как окончательная операция для достижения требуемого комплекса свойств. В зависимости от температуры, которой подвергают материал, разделяют холодную и горячую деформацию:
Холодная деформация осуществляется ниже температуры рекристаллизации и сопровождается наклёпом
Горячая деформация осуществляется выше температуры рекристаллизации, в результате чего эффект упрочнения от наклёпа снимается
Железоуглеродистые сплавы (основной конструкционный материал)
*вставить диаграмму железа*
Равновесные точки, соответствующие превращениям в сплавах, называют критическими точками. В связи с тем, что при нагреве превращения протекают выше равновесной температуры, а при охлаждении ниже, для того чтобы различать эти процессы охлаждение записывают как Аr2, а нагрев как: Ac1.
В критическую точку полиморфного превращения альфа в гамма железо при температуре 9110С – А3
13920С - А4
7680С – железо испытывает магнитное превращение (точка Кюри). Данная критическая точка обозначается как А2. Причём, для неё не существует гистерезиса. Углерод образует с железом ряд карбидов (FeC, Fe2C), а также может существовать в свободном виде в виде графита. В железоуглеродистых сплавах могут существовать следующие фазы:
Жидкая
Феррит – это твёрдый раствор внедрения углерода и других элементов в альфа-железе. Феррит имеет ОЦК кристаллическую решётку. В низкотемпературном феррите максимальная растворимость углерода 0,02%, в высокотемпературном 0,1%. Феррит имеет следующий комплекс свойств:
Предел прочности – 250 мПа
Твёрдость – 80 НВ
Относительное удлинение – 50%
Относительное сужение – 80%
Аустенит – это твёрдый раствор внедрения углерода и других элементов в гамма-железе (имеет ГЦК кристаллическую решётку). Предельная растворимость С в аустените 2,14%. Аустенит – высокопластичное, малопрочное соединение
Цементит – химическое соединение цементита с углеродом, карбид железа с химической формулой Fe3C. Концентрация С в цементите – 6,67%. Температура плавления – 1260оС. Цементит имеет высокую твёрдость, порядка 1000 (HV), практически нулевую пластичность, хрупок. Ряд металлов, способны замещать атомы железа в кристаллической решётке цементиты. Такой цементит называется легированным. Цементит является метастабильной (неустойчивой) фазой и при определённых условиях способен распадаться с образованием свободного углерода в виде графита.
Графит
Диаграмма состояния Fe-Fe3C (метастабильное равновесие)
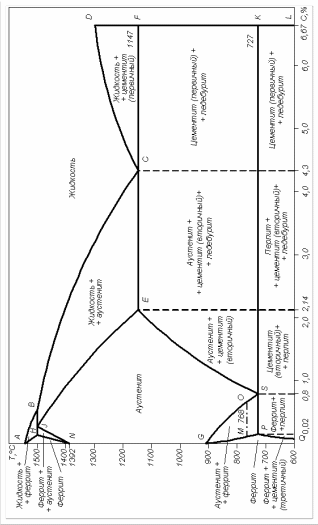
Dot |
T, OC |
C, % |
|
А |
1539 |
0 |
|
B |
1499 |
0,5 |
|
H |
1499 |
0,1 |
|
J |
1499 |
0,16 |
|
N |
1392 |
0 |
|
E |
1147 |
2,14 |
|
C |
1147 |
4,3 |
|
F |
1147 |
6,67 |
|
D |
1260 |
6,67 |
|
G |
911 |
0 |
|
P |
727 |
0,02 |
|
S |
727 |
0,8 |
|
K |
727 |
667 |
|
Q |
~600 |
0,1 |
|
Описание точек и линий диаграммы:
Объект |
Описание |
Точки: |
|
B |
Концентрация углерода в жидкой фазе при перетектическом превращении |
H |
Концентрация углерода в δ-феррите при температуре перетектического превращения |
J |
Концентрация углерода в аустените при перетектическом превращении |
Е |
Предельная растворимость углерода в аустените |
С |
Содержание углерода в жидкой фазе при эвтектическом превращении |
P |
Предельная концентрация углерода в α -железе |
S |
Концентрация углерода в аустените при эвтектоидном превращении |
А |
Температура плавления чистого железа |
D |
Температура плавления цементита |
N, G |
Температуры полиморфного превращения |
Линии: |
|
AB |
Отвечает началу кристаллизации δ-феррита из жидкости (линия ликвидус) |
AH |
Окончание кристаллизации δ-феррита (линия солидус) |
BC |
Отвечает началу кристаллизации аустенита из жидкости (линия ликвидус) |
CD |
Отвечает началу кристаллизации цементита первичного из жидкой фазы (ликв.) |
HJB (1499oC) |
Линия перетектического превращения, т.е. Жв+Фн->Аj |
ECF (1147oC) |
Соответствует эвтектическому превращению, т.е. Ж->Фе+Ц. Образующаяся эвтектика называется ледебурит |
HN |
Линия начала превращения феррита в аустенит |
NJ |
Окончание превращение феррита в аустенит |
GS |
Линия начала превращения аустенита в феррит. Является геометрическим местом критических точек А3 |
PG |
Окончание превращения аустенита в феррит |
ES |
Линия предельной растворимости углерода в аустените. Является геометрическим местом критически точек Аm |
PSK |
Линия эвтектоидного превращения, при которой Аs->Фр+Ц=ПЕРЛИТ Это
геометрическое место критических
точек А |
PQ |
|
|
|
Сплавы, содержащие до 2,14% углерода, называются сталями, а 2,14 -6,67% - чугунами. Сплавы, содержащие до 0,02% углерода, называются техническим железом и имеют структуру феррит или феррит+ЦIII. Сплавы, содержащие 0,02-0,8% углерода, называются доэвтектоидными сталями и имеют структуру феррит+перлит. Сплав, содержащий 0,8% углерода называется эвтектоидная сталь и имеет перлитную структуру. Сплавы, содержащие 0,8-2,14% углерода называются заэвтектоидными сталями и имеют структуру: перлит+ЦII.
Вследствие того, что при температуре 727оС имеет место перлитное превращение, принято разделять высокотемпературный ледебурит, существующий выше линии PSK и состоящий из аустенита и цементита и низкотемпературный ледебурит (ниже линии PSK), состоящий из перлита+цементита.
