
- •Общая и неорганическая химия
- •Часть 1 общие вопросы химии
- •Содержание
- •Введение ..………………………………………………………..29
- •7.5 Расчёт концентраций ионов в растворах
- •Основные химические понятия
- •Основные классы неорганических соединений
- •2.1 Введение
- •2.2 Оксиды
- •2.3 Основания
- •2.4 Кислоты
- •2.4.1 Классификация кислот
- •2.4.2 Номенклатура кислот и их солей
- •Продолжение таблицы 2.1
- •2.5 Соли
- •2.5.1 Номенклатура средних, кислых и основных солей
- •2.5.2 Солеобразные оксиды
- •2.5.3 Диссоциация солей в водных растворах
- •Стехиометрические законы химии
- •Типы химических реакций
- •4.1 Введение
- •4.2 Реакции ионного обмена
- •4.3 Окислительно-восстановительные реакции
- •4.3.1 Общие сведения об окислительно-восстановительных реакциях
- •4.3.2 Составление уравнений окислительно-восстановительных реакций ионно-электронным методом (методом полуреакций)
- •2 Cu(oh)2 Cu2o hcho co2
- •Понятие о химическом равновесии
- •Количественной характеристикой системы в состоянии химического равновесия является константа равновесия k.
- •5.2 Смещение химического равновесия. Принцип Ле-Шателье
- •5.3 Основные типы задач на химическое равновесие
- •Общие свойства растворов
- •6.1 Характеристика растворов. Процесс растворения
- •6.2 Способы выражения концентрации растворов
- •Если в формуле (6.1 а) не использовать множитель 100%, то массовая доля будет выражена не в процентах, а в долях единицы.
- •6.3 Растворимость
- •Растворы электролитов
- •7.1 Основные положения теории электролитической диссоциации
- •7.2 Степень диссоциации
- •7.3 Константа диссоциации
- •7.4 Расчёт концентраций ионов в растворах сильных электролитов
- •7.5 Расчёт концентраций ионов в растворах слабых электролитов
- •7.6 Закон разбавления Оствальда
- •7.7 Диссоциация воды. Водородный показатель
- •7.8 Понятие о буферных растворах
- •7.9 Произведение растворимости
- •0,1 Моль/л 0,1
- •7.10 Равновесия в реакциях ионного обмена
- •Гидролиз солей
- •8.1 Общие представления о гидролизе солей
- •8.2 Константа гидролиза
- •8.3 Степень гидролиза соли; её связь с константой гидролиза
- •8.4 Гидролиз солей, образованных многозарядными катионами и анионами
- •8.5 Смещение равновесия гидролиза
- •8.6 Соли, взаимно усиливающие гидролиз друг друга
- •8.7 Кислые гидролизующиеся соли
- •Электрохимические процессы
- •9.1 Понятие об электродном потенциале
- •9.2 Понятие о гальваническом элементе
- •9.3 Теория электродных потенциалов; уравнение Нернста
- •9.4 Окислительно-восстановительные потенциалы и направление протекания окислительно-восстановительных реакций
- •9.5 Электролиз
- •9.5.1 Электролиз расплавов
- •9.5.2 Электролиз водных растворов
- •9.5.3 Применение электролиза в промышленности
- •9.6 Понятие о контактной коррозии металлов
- •Литература
- •Часть 1 Общие вопросы химии
7.7 Диссоциация воды. Водородный показатель
Чистая вода является очень слабым электролитом; процесс диссоциации воды может быть выражен уравнением: HOH ⇆ H+ + OH–. По величине электропроводности чистой воды были определены концентрации ионов водорода и гидроксид-ионов в чистой воде. Оказалось, что при температуре 25 C C(H+) = C(OH–) = 10–7 моль/л (т.е. концентрация продиссоциировавшей воды равна 10–7 моль/л).
Для процесса диссоциации воды, как и любого слабого электролита можно записать выражение константы диссоциации.
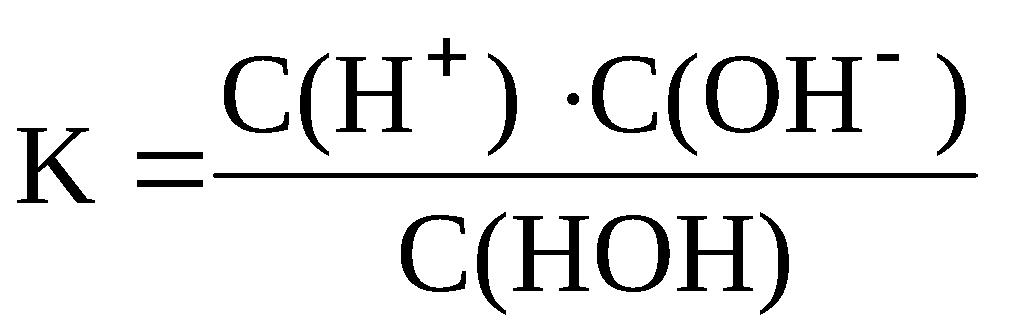
Это выражение преобразовывается в уравнение
C(H+)·C(OH–) = K·C(HOH) . (7.13)
Поскольку степень диссоциации воды очень мала, то концентрация недиссоциированных молекул H2O практически равна общей концентрации воды, т.е. 55,56 моль/л (1 л воды имеет массу 1000 г, что составляет 1000 г : 18 г/моль = = 55,56 моль. C(HOH) = 55,56 - 10–7 = 55,56 моль/л.). Таким образом, концентрацию недиссоциированных молекул воды можно считать практически постоянной величиной, равной 55,56 моль/л; это же справедливо и для разбавленных водных растворов. Поэтому уравнение 7.13 можно преобразовать к следующему виду:
C(H+)·C(OH–) = Kw . (7.14)
В уравнении 7.14 константа Kw является произведением двух констант: K·C(HOH). Это уравнение называется уравнением ионного произведения воды, а константа Kw – константой ионного произведения воды. Для константы ионного произведения воды иногда также используют обозначения KH2O и KВ.
Уравнение ионного произведения воды показывает, что для чистой воды и разбавленных водных растворов произведение концентраций ионов водорода и гидроксид-ионов является постоянной (при постоянной температуре) величиной. При 25C Kw = C(H+)·C(OH–) = 10–7·10–7 = 10–14 . (7.15)
Растворы, в которых молярные концентрации ионов водорода и гидроксид-ионов равны, называются нейтральными растворами. При 25 C в нейтральном водном растворе C(H+) = C(OH–) = 10–7 моль/л. В кислом растворе концентрация ионов водорода больше концентрации гидроксид-ионов, в щелочном растворе наоборот – преобладают ионы OH– . Но какой бы ни была реакция раствора, произведение концентраций ионов C(H+)·C(OH–) будет постоянным.
Например, если в чистую воду добавить столько кислоты, чтобы концентрация ионов водорода увеличилась, например, до 10–2 моль/л, то в соответствии с принципом Ле-Шателье равновесие диссоциации воды HOH ⇆ H+ + OH– сместится влево, в результате чего концентрация ионов OH– уменьшится настолько, что произведение C(H+)·C(OH–) останется постоянным. Концентрацию ионов OH– в этом растворе можно рассчитать по уравнению ионного произведения воды:
(моль/л) .
Е сли
в воду добавить щёлочь и увеличить
концентрацию ионов OH–
, например, до 10–4
моль/л, то из-за смещения равновесия
диссоциации воды влево, концентрация
ионов H+
уменьшается, но произведение C(H+)·C(OH–)
останется постоянным. В данном случае
сли
в воду добавить щёлочь и увеличить
концентрацию ионов OH–
, например, до 10–4
моль/л, то из-за смещения равновесия
диссоциации воды влево, концентрация
ионов H+
уменьшается, но произведение C(H+)·C(OH–)
останется постоянным. В данном случае
(моль/л) .
И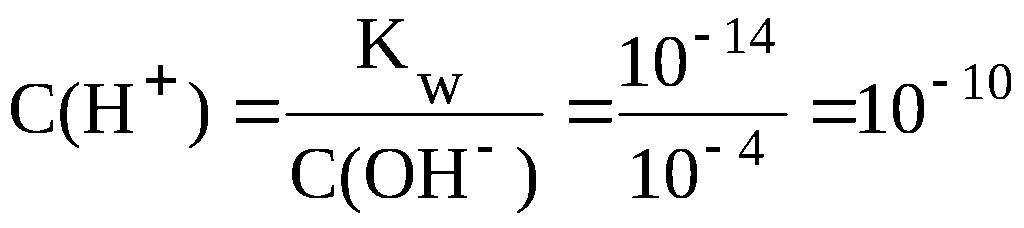 з
вышеизложенного материала следует
важный вывод: и ионы H+,
и ионы OH–
вследствие диссоциации воды содержатся
в любом водном растворе – как в кислом,
так и в щелочном. Поэтому, если концентрация
ионов водорода известна, то тем самым
определена и концентрация гидроксид-ионов.
Следовательно, кислотность, как и
щёлочность раствора можно количественно
охарактеризовать концентрацией ионов
водорода.
з
вышеизложенного материала следует
важный вывод: и ионы H+,
и ионы OH–
вследствие диссоциации воды содержатся
в любом водном растворе – как в кислом,
так и в щелочном. Поэтому, если концентрация
ионов водорода известна, то тем самым
определена и концентрация гидроксид-ионов.
Следовательно, кислотность, как и
щёлочность раствора можно количественно
охарактеризовать концентрацией ионов
водорода.
В кислом растворе C(H+) > 10–7 моль/л;
в нейтральном растворе C(H+) = 10–7 моль/л;
в щелочном растворе C(H+) < 10–7 моль/л
Кислотность или щёлочность раствора можно выразить и другим, более удобным способом: вместо концентрации ионов водорода, указывают её десятичный логарифм, взятый со знаком «минус». Эта величина называется водородным показателем и обозначается pH.
pH = – lg C(H+) (7.16)
Например, если C(H+) = 10–2 моль/л (кислый раствор), то pH = 2;
если C(H+) = 10–7 моль/л (нейтральный раствор), то pH = 7;
если C(H+) = 10–10 моль/л (щелочной раствор), то pH = 10.
Таким образом, в кислом растворе pH < 7;
в нейтральном растворе pH = 7;
в щелочном растворе pH > 7.
По аналогии с понятием «водородный показатель» (pH) вводится понятие «гидроксильный» показатель (pOH).
pOH = -lg C(OH–) (7.17)
Связь между pH и pOH легко вывести логарифмированием уравнения ионного произведения воды.
C(H+)·C(OH–) = Kw = 10–14
lg [C(H+)·C(OH–)] = lg 10–14 = –14
lg C(H+) + lg C(OH–) = -14
-lg C(H+) - lg C(OH–) = 14
pH + pOH = 14 (7.18)
