
- •Предмет молекулярной физики. Основные положения молекулярно- кинетической теории. Идеальный газ.
- •2.Законы идеального газа. Уравнение состояния идеального газа (уравнение Менделеева - Клапейрона). Физический смысл универсальной газовой постоянной.
- •4.Степени свободы молекул идеального газа. Теорема Больцмана о распределении энергии по степеням свободы молекул идеального газа.
- •5.Распределение молекул идеального газа по скоростям (распределение Максвелла). Графическое представление и анализ функции распределения.
- •6. Скорости молекул идеального газа (наиболее вероятная, среднеарифметическая, среднеквадратичная)
- •7. Опыт Штерна
- •8. Идеальный газ во внешнем силовом поле. Барометрическая формула.
- •9.Распределение Больцмана.
- •10.Предмет термодинамики. Термодинамическая сила.
- •11. Равновесные и неравновесные состояния.
- •12. Равновесный процесс.Работа при изменении состояния идеального газа.
- •16.Теплоемкость идеального газа при постоянном объеме.
- •17. Теплоемкость газа при постоянном давлении
- •18. Первый закон термодинамики применительно к изопроцессам. Работа идеального газа в этих условиях.
- •19. Адиабатический процесс
- •2 0.Первый закон термодинамики применительно к адиабатическому процессу . Работа идеального газа при адиабатическом процессе.
- •21.Круговые процессы(циклы) кпд кругового процесса.
- •22.Обратимые и необратимые процессы.
12. Равновесный процесс.Работа при изменении состояния идеального газа.
Равнове́сный тепловой процесс — тепловой процесс, в котором система проходит непрерывный ряд бесконечно близких равновесных термодинамических состояний.
Равновесный тепловой процесс называется обратимым, если его можно провести обратно и в телах, окружающих систему, не останется никаких изменений.
Поясним понятие работы применительно к адиабатическому процессу. В частном случае, когда работа совершается через изменение объёма, можно определить её следующим способом: пусть газ заключён в цилиндрический сосуд, плотно закрытый легко скользящим поршнем, если газ будет расширяться, то он будет перемещать поршень и при перемещении на отрезок dh совершать работу[9][10]
dA=Fdh, где F — сила, с которой газ действует на поршень. Перепишем уравнение: dA=psdh, где s — площадь поршня. Тогда работа будет равна[9][10] dA=pdV, где p — давление газа, dV — малое приращение объёма. Аналогично видно, что уравнение выполняется и для сосудов с произвольной поперечной формой сечения. Данное уравнение справедливо и при расширении на произвольных объёмах. Для этого достаточно разбить поверхность расширения на элементарные участки dS на которых расширение одинаково[9].
Основное уравнение термодинамики примет вид[11]: dU=-pdV
Это условие будет выполняться, если скорость хода поршня (протекания процесса в общем случае) будет удовлетворять определённым условиям. С одной стороны она должна быть достаточно малой, чтобы процесс можно было считать квазистатическим. Иначе при резком изменении хода поршня давление, которое его перемещает, будет отличаться от давления в целом по газу. То есть газ должен находиться в равновесии, без турбулентностей и неоднородностей давления и температуры. Для этого достаточно передвигать поршень со скоростью, существенно меньшей, чем скорость звука в данном газе. С другой стороны скорость должна быть достаточно большой, чтобы можно было пренебречь обменом тепла с окружающей средой и процесс оставался адиабатическим[12][13].
Однако работа может совершаться и другими путями — например, идти на преодоление межмолекулярного притяжения газов. В этом случае параллельно с изменением внутренней энергии будет происходить процессы совершения нескольких работ разной физической природы, и основное уравнение термодинамики примет вид:
dU=-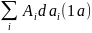
Где Ai , dai — дифференциальное выражение для работы, ai — внешние параметры, которые меняются при совершении работы, Ai — соответствующие им внутренние параметры, которые при совершении малой работы можно считать постоянными. При совершении работы путём сжатия или расширения внутренний параметр — давление. Внешний параметр — объём.
13. Внутренняя энергия тела (обозначается как E или U) — это сумма энергий молекулярных взаимодействий и тепловых движений молекулы. Внутренняя энергия является однозначной функцией состояния системы. Это означает, что всякий раз, когда система оказывается в данном состоянии, её внутренняя энергия принимает присущее этому состоянию значение, независимо от предыстории системы. Следовательно, изменение внутренней энергии при переходе из одного состояния в другое будет всегда равно разности между ее значениями в конечном и начальном состояниях, независимо от пути, по которому совершался переход.
Внутреннюю
энергию тела нельзя измерить напрямую.
Можно определить только изменение
внутренней энергии:![]()
где
![]() —
подведённая к телу теплота,
измеренная в джоулях
—
подведённая к телу теплота,
измеренная в джоулях
![]() — работа,
совершаемая телом против внешних сил,
измеренная в джоулях U = A/q. Эта формула
является математическим выражением первого
начала термодинамики
— работа,
совершаемая телом против внешних сил,
измеренная в джоулях U = A/q. Эта формула
является математическим выражением первого
начала термодинамики
Внутренняя энергия идеального газа не зависит от давления или объёма.
По определению молярной
теплоёмкости при постоянном
объёме, ![]() .
.
Так как внутренняя
энергия идеального газа является
функцией только от температуры, то
![]() .
.
Эта
же формула верна
и для вычисления изменения внутренней
энергии любого тела, но только в процессах
при постоянном объёме (изохорных
процессах);
в общем случае ![]() является
функцией и температуры, и объёма.
является
функцией и температуры, и объёма.
Если пренебречь изменением молярной теплоёмкости при изменении температуры, получим:
![]() ,
где
,
где ![]() —
количество вещества,
—
количество вещества, ![]() —
изменение температуры.
—
изменение температуры.
14. Первый закон термодинамики является обобщением закона сохранения и превращения энергии для термодинамической системы. Он формулируется следующим образом:
Изменение ΔU внутренней
энергии неизолированной термодинамической
системы равно разности между количеством
теплоты Q,
переданной системе, и работой A,
совершенной системой над внешними
телами.
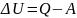
|
Соотношение,
выражающее первый закон термодинамики,
часто записывают в другой форме: Q=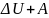
|
Количество теплоты, полученное системой, идет на изменение ее внутренней энергии и совершение работы над внешними телами.
15.
Теплоемкость идеального газа
— это отношение количества теплоты,
сообщенного газу, к изменению температуры
δТ, которое при этом произошло.![]()
Молярная
теплоемкость — теплоемкость 1 моля
идеального газа.![]() ;
;![]()
Удельной
теплоёмкостью называется
теплоёмкость, отнесённая к единичному
количеству вещества. Количество вещества
может быть измерено в килограммах,
кубических метрах и молях.![]()
Связь:
с - теплоемкость, тогда С(удел) = c/m = 1/m * dQ/dT C(моляр) = c/ню = 1/ню * dQ/dT отсюда: С(удел) = C(моляр) * ню/m, где ню = m/M = N/N(A) в молях
Разница лишь в том, что в удельной для изменения температуры на 1 гр используется ед. массы вещества, а в молярной один моль вещества.
