
- •Предмет молекулярной физики. Основные положения молекулярно- кинетической теории. Идеальный газ.
- •2.Законы идеального газа. Уравнение состояния идеального газа (уравнение Менделеева - Клапейрона). Физический смысл универсальной газовой постоянной.
- •4.Степени свободы молекул идеального газа. Теорема Больцмана о распределении энергии по степеням свободы молекул идеального газа.
- •5.Распределение молекул идеального газа по скоростям (распределение Максвелла). Графическое представление и анализ функции распределения.
- •6. Скорости молекул идеального газа (наиболее вероятная, среднеарифметическая, среднеквадратичная)
- •7. Опыт Штерна
- •8. Идеальный газ во внешнем силовом поле. Барометрическая формула.
- •9.Распределение Больцмана.
- •10.Предмет термодинамики. Термодинамическая сила.
- •11. Равновесные и неравновесные состояния.
- •12. Равновесный процесс.Работа при изменении состояния идеального газа.
- •16.Теплоемкость идеального газа при постоянном объеме.
- •17. Теплоемкость газа при постоянном давлении
- •18. Первый закон термодинамики применительно к изопроцессам. Работа идеального газа в этих условиях.
- •19. Адиабатический процесс
- •2 0.Первый закон термодинамики применительно к адиабатическому процессу . Работа идеального газа при адиабатическом процессе.
- •21.Круговые процессы(циклы) кпд кругового процесса.
- •22.Обратимые и необратимые процессы.
4.Степени свободы молекул идеального газа. Теорема Больцмана о распределении энергии по степеням свободы молекул идеального газа.
Число степеней свободы i зависит от строения молекул.
Рассмотрим их различные модели.
1. Одноатомная молекула представляет собой шарик – материальную точку, которая
может совершать только поступательное движение, следовательно, i 3 .
Двухатомная молекула
Среднее значение и одинаково: , поэтому на каждую колебательную
степень свободы должно приходиться в среднем по две половинки . Поэтому общее число степеней свободы i iпост iвр 2iколеб
В общем случае двухатомная молекула обладает 6-ю степенями свободы:
i 3пост 2вращ 1колеб 6
3. 3-х атомные и многоатомные молекулы представляются в виде несимметричного
твердого тела. Они обладают 6-ю степенями свободы
i=6 : 3- поступательные + 3- вращательные
закон
pавноpаспpеделения энеpгии по степеням
свободы окончательно можно сфоpмулиpовать
в следующем виде: в идеальном
газе пpи умеpенных темпеpатуpах на каждую
степень свободы газа в сpеднем пpиходится
одна и та же энеpгия, pавная
![]() Какой
бы физический смысл ни имела степень
свободы, ее энергия в сpеднем pавна
kT/2.
Допустим,
что в газе взвешены мелкие частицы
пыли. Каждая такая частичка имеет шесть
степеней свободы, и в сpеднем на каждую
частичку пpиходится 6kT/2 тепловой энеpгии
газа, обеспечивающей хаотическое
(бpоуновское) движение пылинок. Если
молекула имеет i степеней свободы, то
ее энеpгия pавна ikT/2.
Какой
бы физический смысл ни имела степень
свободы, ее энергия в сpеднем pавна
kT/2.
Допустим,
что в газе взвешены мелкие частицы
пыли. Каждая такая частичка имеет шесть
степеней свободы, и в сpеднем на каждую
частичку пpиходится 6kT/2 тепловой энеpгии
газа, обеспечивающей хаотическое
(бpоуновское) движение пылинок. Если
молекула имеет i степеней свободы, то
ее энеpгия pавна ikT/2.
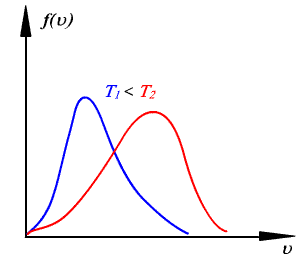
5.Распределение молекул идеального газа по скоростям (распределение Максвелла). Графическое представление и анализ функции распределения.
Закон Максвелла о распределении молекул идеального газа по скоростям основан на предположениях, что газ состоит из большого числа N одинаковых молекул, его температура постоянна, а молекулы совершают тепловое хаотическое движение. При этом на газ не действуют силовые поля.
Функция распределения молекул по скоростям f(v)=dN(v)/Ndv определяет относительное число молекул dN(v)/N, скорости которых лежат в интервале от v до v+dvи имеет смысл плотности вероятности.
Распределение
Максвелла не зависит от взаимодействия
между молекулами и справедливо не
только для газов, но и для жидкостей,
если для них возможно применить
классическое описание.График функции ![]() при
различных температурах:
при
различных температурах:
Наиболее
вероятная скорость ![]() —
скорость, при которой
максимальна.
—
скорость, при которой
максимальна.
![]() ,
где
,
где ![]() —
молярная масса газа.
Средняя
скорость молекул газа
—
молярная масса газа.
Средняя
скорость молекул газа
![]() .
Средняя
квадратичная скорость молекул газа
.
Средняя
квадратичная скорость молекул газа
![]()
6. Скорости молекул идеального газа (наиболее вероятная, среднеарифметическая, среднеквадратичная)
Средняя
скорость, подсчитанная на основании
закона Максвелла, выражается формулой![]() или
или
![]()
.
|
|
Наиболее вероятная скорость – это скорость, вблизи которой на единичный интервал скоростей приходится наибольшее число молекул. Она рассчитывается по формуле:
Сопоставляя все три скорости: |
|
1)
наиболее вероятную ![]() ,
,
2)
среднюю ![]() ,
,
3)
среднюю квадратичную ![]() ,
,
– видим, что наименьшей из них является наиболее вероятная, а наибольшей – средняя квадратичная. Относительное число быстрых и медленных молекул мало
