
- •Внутренняя энергия есть функция состояния тс.
- •Следовательно, температура - есть мера хаотического движения молекул.
- •Универсальная газовая постоянная численно равна работе, которую совершает один моль идеального газа при изобарическом расширении и изменении температуры на 1 к.
- •Теплоемкость системы численно равна количеству теплоты, которое необходимо сообщить системе, чтобы ее температура увеличилась на 1 Кельвин.
- •Молярная теплоемкость при постоянном объеме равна изменению внутренней энергии одного моля газа при его изохорическом нагревании на 1 Кельвин.
- •Адиабатический и политропные процессы.
- •Термодинамические процессы, при которых теплоемкость остается постоянной называются политропными.
Внутренняя энергия термодинамической системы и способы ее изменения.
Понятие полной и внутренней энергии термодинамической системы. Как мы уже знаем, термодинамическая система (ТС) может состоять из твердых, жидких или газообразных веществ. Полная энергия такой системы, очевидно, состоит из механической энергии системы как целого, внутренней энергии совокупности взаимодействующих между собой и хаотически движущихся частиц и энергии ядерного взаимодействия нуклонов атомов системы.
С точки зрения термодинамики под внутренней энергией тела U понимают сумму кинетической энергии хаотического движения составляющих ее частиц и потенциальной энергии их взаимодействия.
Для идеального газа потенциальной энергией взаимодействия частиц можно пренебречь.
Способы обмена энергией у ТС. Практика показывает, что существует два способа обмена энергией между закрытой системой и внешними телами:
путем совершения работы; |
|
путем теплообмена. |
Первый из этих способов связан с макроскопическими перемещениями частей системы, а второй - с совокупностью микропроцессов, связанных с обменом энергии между отдельными частицами ТС и внешней средой. Теплообмен, в свою очередь, может происходить путем конвекции, теплопроводности или излучения.
Обратим внимание, что работа и количество теплоты имеют смысл только в связи с изменением состояния ТС, обусловленного обменом энергии, но не характеризуют само это состояние. Передача энергии от внешних тел системе, в свою очередь, определяет изменение ее внутренней энергии U. Величина U при возвращении ТС в исходное состояние после совершения произвольного термодинамического цикла равняется нулю, а само значение внутренней энергии характеризует состояние системы. Следовательно,
Внутренняя энергия есть функция состояния тс.
Первое начало термодинамики. С учетом вышеизложенного, для конечных величин изменения параметров ТС, т.е. для случая перехода системы из состояния 1 в состояние 2 можно записать следующее равенство, позволяющее рассчитать изменение внутренней энергии U1-2:
U1-2 = Q1-2 + A1-2' = Q1-2 - A1-2 (14.1) или Q1-2 = U1-2 + A1-2, (14.2) где A1-2 - работа, совершаемая системой против действия внешних сил; A1-2' - работа, совершаемая внешними силами над системой Q1-2 - количество теплоты, сообщенное системе.
При переходе к бесконечно малым изменениям будет справедливо следующее равенство:
Q = dU + A, (14.3) где величины элементарного количества теплоты Q и работы A положительны, если теплота подводится к системе и система совершает работу над внешними силами.
Работа и количество теплоты не являются функциями состояния, но их элементарные количества определяют изменение внутренней энергии системы, что и отражено в уравнении (14.3), которое представляет собой математическое выражение 1 начала термодинамики.
Формула (14.1) является выражением закона сохранения энергии. Действительно, исходя из опыта, для любого способа перехода ТС из состояния 1 в состояние 2 изменение внутренней энергии не зависит от способа такого перехода. Для бесконечно малых приращений параметров состояния первое начало термодинамики можно сформулировать, исходя из формулы (14.3):
элементарное количество теплоты, сообщенное термодинамической системе, идет на изменение ее внутренней энергии и совершение системой работы.
Количество теплоты, как следует из первого начала термодинамики, измеряется в тех же единицах, что работа или энергия, т.е. в Джоулях. Существует механический эквивалент теплоты, определенный экспериментально.
1 Дж = 4.19 кал.
В случае совершения термодинамического цикла приращение внутренней энергии равняется нулю и, исходя из первого начала термодинамики, получим, что:
A = Q.
Другими словами, для циклического процесса работа, совершаемая ТС, не может быть больше количества теплоты, сообщенного ей, т.е.
невозможно создание вечного двигателя первого рода или невозможно создать периодически действующий двигатель, который бы совершал большую работу, чем полученная извне энергия.
Если в изолированной ТС не происходит никаких превращений энергии, кроме теплообмена между телами, входящими в эту систему, то количество теплоты, отданное охлаждающимися при этом телами, равно количеству теплоты, полученному телами, которые нагреваются. Суммарная внутренняя энергия системы при этом не меняется, т.е. U1-2 = 0. Это выражение называется уравнением теплового баланса.
Расчет работы и внутренней энергий.
 Рис.
14.1.
Рис.
14.1.
Работа при изменении состояния ТС. В качестве ТС рассмотрим газ, заключенный в сосуде объемом V. Газ оказывает давление на любую стенку сосуда. Если одна из стенок подвижна (например, поршень на рис. 14.1), то при перемещении поршня на бесконечно малое расстояние dL сила давления F совершит работу A, равную:
A = F· dL·cos= P·S·dL, где S - площадь поршня, - угол между направлением силы и перемещением поршня (на рис. 14.1 = 0).
Произведение S·dL равно изменению объема газа dV от начального V1 до конечного V2 значения, т.е. S·dL = dV. Тогда
A = P·dV. (14.4)
Работа, совершаемая газом при перемещении поршня на конечное расстояние, равна интегралу
 .
(14.5)
.
(14.5)
Для вычисления работы можно воспользоваться также графическим методом. Пусть процесс расширения имеет вид, изображенный на рисунке в координатах P-V (см. рис. 14.2). При любом малом изменении объема dV работа равна площади малого прямоугольника (на рис. 14.2 он выделен зеленым цветом). Полная работа равна сумме площадей всех малых прямоугольников и равна площади фигуры, ограниченной линией, представляющей собой график процесса P = f(V).
При сжатии газа внешними силами перемещение поршня dL противоположно силе давления газа F, тогда работа газа будет отрицательной величиной dV < 0. Работа внешней силы A' в данном случае будет положительной, а работа совершаемая газом - отрицательной A' = - A < 0.
Можно доказать, что выражение (14.4) справедливо при изменении объема сосуда произвольной формы. Из графика следует, что величина работы зависит от вида процесса.

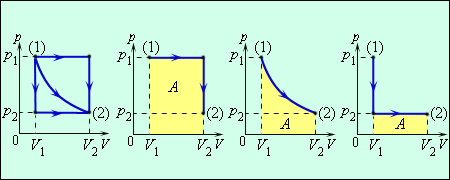
Рис. 14.2.
Средняя кинетическая энергия газа. Учитывая, что для идеального газа выполняется соотношение:
P = n·k·T, (14.6)
и выражение (14.15) получаем, что среднее значение энергии поступательного движения молекулы зависит от температуры следующим образом:
<Eпост> = 3·k·T/2. (14.7)
