
- •21. Механические и конформационные свойства мембран. Фазовые переходы.
- •Раздел 5. Транспорт веществ и биоэлектрогенез
- •22. Транспорт неэлектролитов через мембраны. Диффузия: движущая сила. Закон Фика. Понятие об облегчённой диффузии.
- •23. Транспорт ионов через мембрану. Механизмы и движущая сила пассивного транспорта. Уравнение электрохимического потенциала.
- •24. Энергия иона и причины её понижения при транспорте через биомембраны.
- •26. Электродиффузная теория транспорта ионов через мембрану. Уравнение Нерста-Планка для потока ионов через мембрану. Уравнение Гольдмана.
- •27. Индуцированный ионный тран-т через мембрану.Затраты энерг. По формуле Борна.
- •25. Электрические свойства биомембран и транспорт ионов. Понятие о двойном электрическом слое. Плотность распределения ионов в зависимости от расстояния. Электрокинетический потенциал мембраны.
- •29. Ионный транспорт в каналах. Понятие об энергетическом профиле канала. Уравнение силы тока, переносимого ионами.
- •30. Зависимость энергетического профиля ионного канала от заполнения канала, от биоэлектрических процессов. Селективность каналов.
- •31. Общие свойства ионных каналов нервных волокон. Na-канал, к-канал, их селективность.
- •32. Функционирование ионных каналов в зависимости от от внешнего электрического потенциала, понятие воротного устройства.
- •33. Активный транспорт ионов. Перенос ионов за счет энергии атф. Схема работы каналов.
- •34. Сопряжение ионообменных процессов с гидролитическим расщеплением молекулы атф. Конформационные переходы Na, k- атФазы.
- •35. Транспорт протонов в энергосберегающих мембранах. Образование градиента электрохимических потенциалов в биомембранах.
- •36. Потенциал покоя. Формула Нерста для мембранного потенциала. Уравнение Томаса.
- •37. Потенциал действия. Мембранный потенциал и изменение ионной проницаемости мембраны. Описание ионных токов в модели Ходжкина-Хаксли.
- •38. Образование воротных токов в мембранах нервных волокон. Распространение электрического импульса в нервных волокнах.
- •39.Фотопревращение бактериородопсина. Строение бактериородопсина, конформационные переходы молекулы при поглощении кванта света. Внутримолекулярный перенос протона.
- •40. Фотоизомеризация родопсина в фоторецептурной мембране зрительных клеток позвоночных. Проницаемость мембраны и светоиндуцированный электрический сигнал
- •Фоторегуляторные и фотодеструкционные процессы Фоторегуляторные реакции
- •41. Ультрафиолетовое излучение и фотодеструкционные процессы в днк: фотоизомеризация, фотогидротация, образование пиримидиновых аддукатов. Механизмы фотореактивации.
- •42.Действие ультрафиолетового излучения на белки, на биомембраны.
38. Образование воротных токов в мембранах нервных волокон. Распространение электрического импульса в нервных волокнах.
Заряженные частицы, которые перераспределяются в мембране под действием электрического поля, переводят ионные каналы в проводящее или непроводящее состояние. Эти заряженные частицы образуют воротный ток. Удалось обнаружить воротные токи смещения, связанные с частицами, открывающими Na-канал.
Вместе с тем предположение, что перескок нескольких заряженных групп должен происходить через всю толщу мембраны, представляется маловероятным. Поэтому предлагается иная интерпретация природы воротных токов.
Возможно, воротный ток обусловлен не перемещением заряженных частиц через мембраны, а кооперативным изменением ориентации диполей, выстилающих внутреннюю полость канала.
Переориентация диполей может существенно изменить энергию взаимодействия иона с окружением канала.
Конформационные перестройки белка могут изменить геометрию канала, что скажется на его пропускной способности.
Электрическое поле может, изменив дипольные моменты, «погрузить» белок переносчик в мембрану с образованием сквозной поры – ионного канала.
Распространение нервного импульса.
Импульс распространяется вдоль волокна без затухания с постоянной скоростью. Распространение возбуждения связано с протеканием локальных токов между покоящимися и активными (возбужденными) участками.
В области возникновения потенциала действия внутренняя часть нервного волокна заряжена положительно, а в соседних невозбужденных участках – отрицательно. В результате возникает локальный ток, который деполяризует мембрану, при достижении критической величины эта область также возбуждается (рис. 5.23).
В волокнах позвоночных поверхность покрыта миелином (изолятор), поэтому локальный ток проходит между перехватами Ранвье, возбуждение передается скачками. Происходит это с большей скоростью и с меньшими потерями энергии. Электрическая емкость миелиновой оболочки очень мала, на ее зарядку идет меньше энергии, чем на зарядку мембраны, имеющей высокую электрическую емкость.
Аксон не обычный кабель, вдоль его волокна в мембране размещены молекулярные генераторы, подпитывающие импульс. В организме нервные волокна объединены в нервные стволы, где каждое волокно может самостоятельно проводить возбуждение. Электрическое поле, возникающее в этом возбужденном волокне, влияет на мембранный потенциал соседних волокон, которые тем самым при некоторых условиях могут также возбуждаться.
39.Фотопревращение бактериородопсина. Строение бактериородопсина, конформационные переходы молекулы при поглощении кванта света. Внутримолекулярный перенос протона.
бактериородопсин обнаружен в пурпурной мембране галобактерий. Мембранный комплекс с бактериородопсином способен запасать световую энергию в форме разности электрохимических потенциалов.
Бактериородопсин содержит один хромофор-ретиналь (полиеновый альдегид) в комплексе с белком – опсином. Опсин использует энергию света для активного переноса протонов через мембрану, в результате происходит синтез АТФ и выполнение других функций. Ретиналь ковалентно связан с опсином, образуя так называемое шиффово основание, которое может быть протонировано.
После поглощения кванта света ретиналь изомеризуется и переходит из полностью транс- в 13-цис форму (рис. 8.1). Протон с шиффово основания переносится на аминокислотный остаток, вакансия заполняется протоном с другого остатка. По эстафетной цепочке транспортных реакций протон освобождается на внешней стороне мембраны, а поглощается из внеклеточного пространства.
![]()
Рис. 8.1. Структурные формулы полностью транс-ретиналя (I) и 13-цис-ретиналя (II).
Конформационные переходы бактериородопсина инициируются кулоновским взаимодействием в донорно-акцепторных парах аминокислот. После поглощения кванта конформационная энергия запасается в виде градиента электрохимического потенциала ионов водорода.
Трансмембранная часть бактериородопсина сложена из 7 регулярных α-спиралей, идущих от одного до другого края мембраны, а одинокая β-шпилька и все нерегулярные участки цепи (соединяющие спирали-петли) выходят из мембраны. Сидящие на α-спиралях гидрофобные группы обращены «наружу» к липидам (тоже гидрофобным) мембраны. Полярные же группы (их немного) обращены внутрь очень узкого канала, по которому идет протон. Ретиналь прикреплен к лиз-216, находящемуся в конце Gα-спирального столба (рис. 8.2). В состав ближайшего белкового окружения ретиналя помимо лиз-216 входят и другие аминокислоты, которые играют важную роль в структурной стабилизации и функционировании бактериородопсина. Они могут играть роль сложного противоиона для протона шиффова основания.
Фотоцикл бактериородопсина. В основе функционирования бактериородопсина как протонной помпы лежит его способность за счет энергии света переносить протоны с цитоплазматической на внешнюю сторону клеточной мембраны. После поглощения кванта света ретиналь изомеризуется и переходит из полностью-транс в 13-цис форму (рис. 8.1). При этом протон с шиффова основания переносится на Асп 85, после чего образовавшаяся вакансия заполняется протоном, перешедшим с Асп 96. Такой внутримолекулярный перенос протона инициирует эстафетную цепочку транспортных реакций, в результате которых происходит высвобождение протона на внешней стороне мембраны и поглощение протона из внутриклеточного пространства. В схематическом виде это показано на рис. 8.3. В ходе цикла фотохимических превращений бактериородопсин испытывает конформационные переходы, которые по сути сходны с таковыми у большинства ферментов. Эти конформационные переходы инициируются кулоновским взаимодействием в донорно-акцепторных парах аминокислот: между положительно заряженным внутримолекулярным донором и отрицательно заряженным акцептором протона.
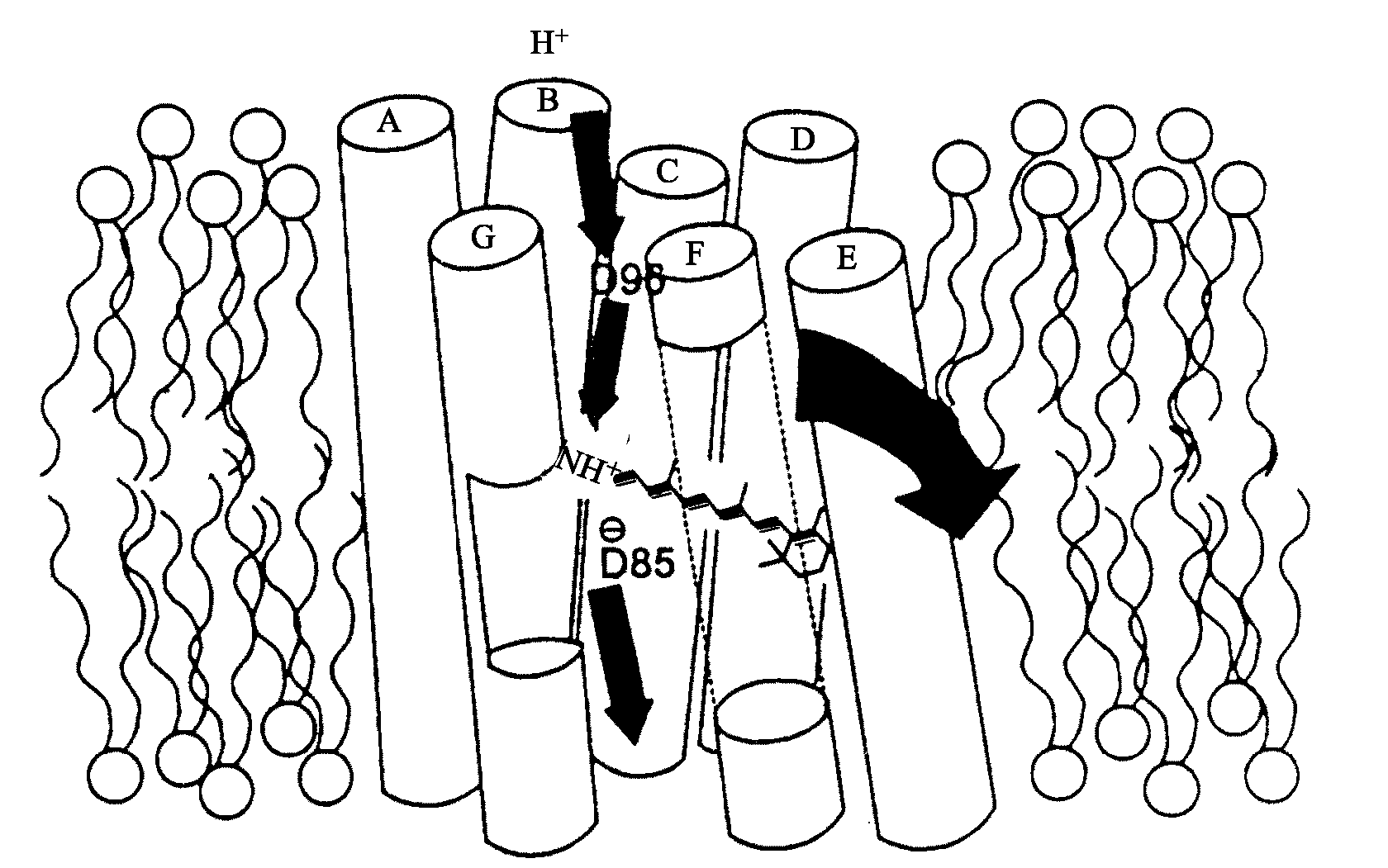
Рис. 8.3. Схематическое изображение бактериородопсина
Путь протона показан прямыми стрелками. Изогнутая стрелка показывает направление изгиба спирали F в ходе фотохимического цикла (по J.K.Lanyi, 1995).
До поглощения кванта света структура белка стабилизирована энергией связи комплекса, образованного протонированным шиффовым основанием, заряженными группами в локусе ретиналя и связанной водой (рис. 8.2). В этом конформационном состоянии (конформация Е) протон шиффова основания координационно связан с Асп 85 и находится в контакте с наружной стороной мембраны. Фотоизомеризация ретиналя смещает шиффово основание относительно Асп 85, но возникающие в молекуле напряжения способствуют переносу протона с шиффова основания на Асп 85. Бактериородопсин при этом переходит в новую конформацию (конформация С), отличающуюся сдвигом спирали G от цитоплазматической стороны мембраны к центру молекулы (см. рис. 8.3). В конформации G шиффово основание уже находится в контакте с цитоплазматической стороной мембраны, а его контакт с Асп 85 и, следовательно, с наружной стороной мембраны нарушен.
Таким образом, бактериородопсин представляет собой ионный насос с переменным доступом активного центра к противоположным сторонам мембраны. В терминах конформационной динамики бактериородопсин представляет собой систему с двумя устойчивыми состояниями, причем избыточная конформационная энергия запасается в ходе фотоцикла в виде трансмембранного градиента электрохимического потенциала ионов водорода.
Механизмы переноса протона. Современные модели переноса протона в цикле бактериородопсина основаны на представлениях о двух протонных каналах, связывающих ретиналь с внутренней и наружной сторонами мембраны. Ретиналь служит своего рода молекулярным переключателем, регулирующим общий трансмембранный перенос протонов по цитоплазматическому и периплазматическому каналам (рис. 8.3). Происходящая в результате транс-цис фотоизомеризация ретиналя является триггером, «запускающим» всю дальнейшую цепь последовательных превращений фотоцикла. Первичным акцептором протона от шиффова основания является Асп 85. Группа X, определенная как Глю-204, непосредственно отдает протон в наружную среду. Остаток Асп 96 репротонирует шиффово основание, восполняя дефицит протонов за счет цитоплазматического источника.
В результате изменения конфигурации ретиналя (фотоизомеризация) шиффово основание смещается в гидрофобную область белка с более низким значением диэлектрической постоянной. Это приводит к увеличению взаимодействия между положительным протоном основания и отрицательным зарядом противоиона Асп 85, в результате чего сродство к протону шиффова основания уменьшается. Теперь протон может перейти на отрицательно заряженный остаток Асп 85 и протонировать его. Протонирование Асп 85 и нейтрализация отрицательного заряда его группы СОО~ понижает сродство к протону аминогруппы, что способствует ее депротонированию и выбросу протона во внешнюю среду.
