
- •Роль физико-химических процессов в технологии и конструировании электронных средств.
- •Основные термодинамические понятия.
- •Законы термодинамики.
- •Энтропия.
- •Условия равновесия термодинамических систем. Правило фаз.
- •Диаграммы состояния различных систем и их роль при проектировании технологических процессов.
- •Однокомпонентные системы.
- •Объемные диаграммы состояния.
- •Многокомпонентные системы.
- •Основные типы диаграмм равновесия бинарных систем.
- •Статистический характер второго закона термодинамики.
- •Характеристические функции и термодинамические потенциалы системы.
- •Явления и процессы на поверхности раздела двух фаз. Адсорбция физическая и химическая.
- •Термодинамическое равновесие поверхностного слоя с объемными фазами.
- •Растворы и их применение в технологии эс.
- •Виды химической связи между атомами. Равновесное состояние системы атомов. Основные свойства материалов, определяемые особенностями химической связи.
- •Металлическая связь:
- •Молекулярная связь:
- •Пространственное расположение частиц при образовании кристалла.
- •Кристаллические решётки. Типы симметрии и виды решёток. Индексы Миллера.
- •Структура жидкости.
- •Структура полимеров.
- •Жидкие кристаллы.
- •Образование и структура пленок.
- •2. Ионно-плазменное распыление:
- •3. Электрохимическое осаждение:
- •Получение тонких пленок на ориентирующих подложках (эпитаксия).
- •Особенности структуры пленок. Влияние физико-химических факторов на структуру и свойства пленок.
- •Влияние физико-химических факторов на свойства пленок.
- •Закономерности и механизмы диффузии в полупроводниковых и планарных структурах.
- •Диффузия в твердых телах. Механизмы диффузии.
- •Законы диффузии Фика.
- •Использование диффузии для введения примеси в полупроводниковые кристаллы. Диффузия из ограниченного и неограниченного источника.
- •Физические основы ионной имплантации.
Виды химической связи между атомами. Равновесное состояние системы атомов. Основные свойства материалов, определяемые особенностями химической связи.
По характеру сил связи твердые кристаллические вещества делятся на 4 группы:
Ионные кристаллы – преобладающий тип ионная связь;
Атомные кристаллы – ковалентная связь;
Металлические кристаллы – металлическая связь;
Молекулярные кристаллы – за счет сил Вандервальса.
Ионная связь: в 1916 году Коссель создал теорию ионной связи.
Атом с малым числом электронов отдает их атому с большим числом электронов для завершения электрических пар. В результате получаются ионы с противоположными знаками, которые притягиваются.
В классической физике была рассчитана потенциальная энергия притяжения ионов.
![]() (1)
(1)
е – заряд взаимодействующих ионов;
- расстояние между ними.
Нельзя ограничится только учетом действия сил притяжения, для установившегося состояния силы притяжения должны уравновешиваться силами отталкивания, существует определенное расстояние, на котором силы притяжения равны силе отталкивания. В классической физике потенциальную энергию отталкивания можно рассчитать только имперически:
![]() (2)
(2)
где а и m – const определяемые экспериментально.
Тогда полная потенциальная энергия:
![]()
Ионная связь высокоэнергетическая. Энергия связи от сотен до тысяч кДж/моль.
Свойства материалов обладающих ионной связью:
высокая прочность;
высокая твердость;
высокие температуры плавления;
высокие теплоты сублимации.
С точки зрения электропроводности, она имеет ионную природу, ток образуется ионами и резко зависит от температуры.
С оптической точки зрения – это материалы прозрачные в широком диапазоне длин волн.
Ковалентная связь: была разработана Льюисом.
Объединяются одинаковые атомы
![]() или разнородные
или разнородные
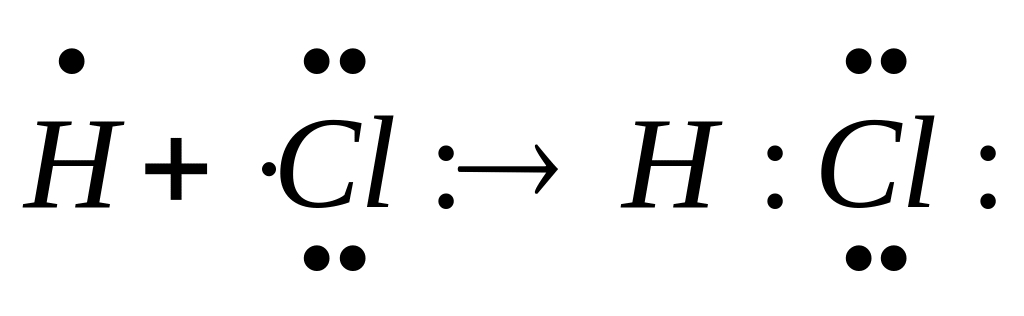 .
.
В 1927 году Гейтлер и Лондон провели расчет для системы из двух атомов водорода (Н).
Плотность электронных облаков.
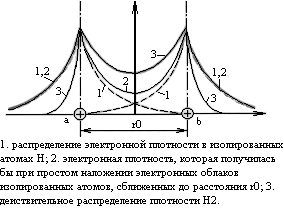
Электронные облака взаимодействующих атомов втягиваются в пространство между атомами. Ковалентная связь возникает за счет сил электростатического притяжения стягивающих положительные ядра атомов. Ядра стягиваются отрицательно заряженным электронным облаком высокой плотности в пространство между ядрами.
Спиновые моменты электронов взаимодействующих атомов S1 и S2 должны быть противоположно направлены.
Свойства веществ с ковалентной связью:
энергия связи очень высока сотни кДж/моль;
высокая прочность;
высокая твердость;
высокие теплоты плавления и сублимации;
диэлектрики (отсутствие ионов);
прозрачные в длинноволновой части спектра.
К материалам этой группы относятся: алмаз, кремний, германий, серое олово, висмут, сурьма, йод и т.д.
Металлическая связь:
В металлах в процессе кристаллизации при сближении атомов на порядок расстояния постоянной кристаллической решетки валентные электроны становятся свободными и обобществленными, в результате в пространстве между ионами образуется электронный газ, металлическая связь образуется за счет электростатического взаимодействия положительно заряженных ионов с отрицательно заряженным облаком электронного газа.
Металлическая связь высокоэнергетическая. Энергия связи порядка сотен кДж/моль. Поскольку связь высокоэнергетическая, материалы обладают высокой прочностью, твердостью, температурой плавления, теплотой сублимации.
В связи с тем, что в кристаллической решетке металлов содержится высокая концентрация электронов, они обладают высокой электропроводностью и теплопроводностью. Они обладают высокой отражательной способностью (блеск), это результат высокой концентрации свободных электронов.
Эти материалы обладают пластичностью – способностью изменять форму под влиянием механических нагрузок, не испытывая разрушений. Под влиянием механических усилий в металлах возникает скольжение по кристаллографическим плоскостям, при этом металлическая связь рвется и тут же восстанавливается, так как свободные электроны обобществлены и не принадлежат отдельным атомам.
