
Билет №10
Мы уже знаем, что химические свойства элемента определяются его внешней электронной оболочкой. Поскольку именно эти внешние электроны ответственны за образование связей с другими атомами, такие электроны называются валентными электронами. Выберем среди элементов те, которые имеют похожие валентные оболочки.
Водород Н (заряд ядра Z=1) имеет валентную оболочку 1s1. Аналогичную валентную оболочку – только на более далеком от ядра уровне 2s1 – имеет элемент литий Li (Z=3). Валентную оболочку 3s1 имеет элемент натрий Na (Z=11), валентную оболочку 4s1 – элемент калий K (Z=19), оболочку 5s1 – рубидий Rb (Z=37), оболочку 6s1 – цезий Cs (Z=55) и, наконец, самую удаленную от ядра валентную оболочку такого типа 7s1 имеет элемент франций Fr (Z=87)
Все эти элементы должны иметь сходные химические и физические свойства. Во–первых, они должны быть одновалентны, потому что могут отдавать с внешнего уровня только один электрон для образования одной пары электронов, поделенной с атомом какого–нибудь другого элемента.
Во–вторых, все перечисленные элементы должны охотно отдавать свой единственный внешний электрон в химических реакциях с другими атомами. Иными словами, все перечисленные элементы должны быть хорошими восстановителями, легко отдающими свои электроны окислителям.
В–третьих, сами эти элементы должны быть металлами, потому что их атомы могут связываться между собой только металлической связью. Как вы помните, малое число валентных электронов не дает возможности атомам элемента связаться между собой октетными, завершенными молекулярными электронными оболочками, поэтому они образуют ионную кристаллическую решетку, которую омывает "электронный газ" (именно такой вид химической связи называется металлической связью). Исключение должен составлять ВОДОРОД – ему до завершенной электронной оболочки 1s2 не хватает всего 1–го электрона, поэтому атом водорода образует с другим атомом водорода не металлическую, а обыкновенную ковалентную связь H:H.
Таким образом, несмотря на некоторые различия в свойствах, все элементы можно считать определенной группой схожих между собой элементов.
Но в этом случае зададимся вопросом: если Li (Z=3) и Na (Z=11) являются однотипными элементами, то что происходит "на пути" от Li к Na, то есть при возрастании заряда ядра от 3 до 11? Какие свойства имеют элементы с Z = 4, 5, 6, ... 10?
Оказывается, свойства этих элементов меняются постепенно – по мере заполнения внешних электронных оболочек все возрастающим числом электронов. Но только до определенного предела! Элемент с зарядом ядра Z=10 (инертный газ неон) уже очень сильно отличается по своим свойствам от элемента Li, но буквально следующий за неоном элемент Na (Z=11) является химическим аналогом лития!
Это явление легко объяснимо с точки зрения электронного строения атомов. Действительно, если электронные уровни заполняются от элемента к элементу постепенно, то рано или поздно электронные конфигурации внешних электронных оболочек должны повторяться. А раз так, то должны повторяться и химические особенности в поведении элементов.
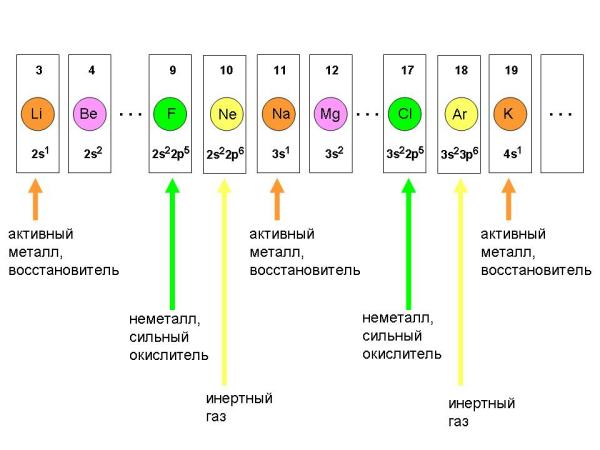
При расположении в ряд элементов с зарядом ядра от Z=3 до Z=19 наблюдается определенная периодическая закономерность в изменении химических свойств элементов, которая выражается в том, что по мере заполнения электронных оболочек свойства элементов периодически повторяются.
Периодический закон: Свойства элементов периодически изменяются в соответствии с зарядом ядер их атомов.
Правило Клечковского (также Правило n+l; также используется название правило Маделунга) — эмпирическое правило, описывающее энергетическое распределение орбиталей в многоэлектронных атомах.
-
Заполнение электронами орбиталей в атоме происходит в порядке возрастания суммы главного и орбитального квантовых чисел
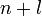 .
При одинаковой сумме раньше заполняется
орбиталь с меньшим значением
.
При одинаковой сумме раньше заполняется
орбиталь с меньшим значением
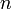 .
.
![]()
При
заполнении орбитальных оболочек атома
более предпочтительны (более энергетически
выгодны), и, значит, заполняются раньше
те состояния, для которых сумма главного
квантового числа
и
побочного (орбитального) квантового
числа
![]() ,
т.е.
,
имеет меньшее значение.
,
т.е.
,
имеет меньшее значение.
Оказывается, электроны в ядре располагаются не как попало, а слоями - энергетическими уровнями. Эти уровни, как этажи в доме - первый, второй, третий и так далее.
Да еще внутри каждого уровня есть электронные подуровни - s, p, d, f, на которых располагаются атомные орбитали соответственно s, p, d, f-типа. Чем больше номер "этажа" - уровня, тем "выше" (дальше от ядра) находятся электроны этого уровня. На первом уровне может быть один-единственный s-подуровень, на втором подуровней уже два: s и p. На третьем "этаже" три подуровня (s, p и d), на четвертом - четыре (s, p, d, f).
Электронные подуровни, так же, как и энергетические этажи - уровни, различаются по энергии. Они располагаются на разной энергетической "высоте".
Теперь надо представить себе "квартиры" наших жильцов-электронов. Или хотя бы договориться, как их обозначать. В сущности, согласно квантовой механике, очень трудно предложить какую-либо механическую аналогию (подобие) тому, что в атоме имеет место на самом деле... Ученые условились обозначать каждую атомную орбиталь квантовой ячейкой - квадратиком на энергетической диаграмме: |
На s-подуровне может находиться одна атомная орбиталь, а на p-подуровне их может быть уже три (в соответствии с тремя осями координат): |
|
Орбиталей d- и f-подуровня в атоме может быть уже пять и семь соответственно |
|
Правило Хунда определяет порядок заполнения орбиталей определённого подслоя и формулируется следующим образом: суммарное значение спинового квантового числа электронов данного подслоя должно быть максимальным.
Это означает, что в каждой из орбиталей подслоя заполняется сначала один электрон, а только после исчерпания незаполненных орбиталей на эту орбиталь добавляется второй электрон. При этом на одной орбитали находятся два электрона с полуцелыми спинами противоположного знака, которые спариваются (образуют двухэлектронное облако) и, в результате, суммарный спин орбитали становится равным нулю.
