
- •Строение и состав атмосферы
- •Строение и состав гидросферы
- •Строение и состав Земли
- •Состав биосферы
- •Назовите факторы миграции
- •Соленость воды. Единицы измерения солености
- •Предмет, задачи и методы геохимии
- •Что такое pH. Пределы значений.
- •Как определяется биофильность
- •Как оценивается технофильность элемента
- •Какие элементы в геохимической системе называют ведущими
- •Что означает понятие “парагенная ассоциация”
- •Типы геохимических барьеров
- •Кларк элемента. Методы расчета кларка
- •Формы нахождения элементов
- •Как определить фоновое содержание элемента
- •Основной геохимический закон Гольдшмидта
- •Природа газов в атмосфере
- •Понятие геохимического барьера
- •Коэффициент разделения изотопов
- •Охарактеризуйте способность элементов к минералообразованию
- •Озон в атмосфере. Образование, разрушение и значение для биосферы
- •Происхождение газов в атмосфере
- •Причины эволюции атмосферы
- •Основные черты геохимии морских вод
- •Основные черты геохимии речных вод
- •Геохимические свойства воды
- •Геохимические классификации элементов
- •Понятие техносферы. Ее роль в эволюции биосферы.
- •Что такое кларк концентрации (кк)?
- •Назовите главный источник эндогенного тепла Земли
- •Причины разделения изотопов
- •Задачи, решаемые с помощью изотопного анализа
- •Как определяется коэффициент эмиссионной нагрузки городов.
- •Охарактеризуйте термины: литофильность, халькофильность, сидерофильность
Коэффициент разделения изотопов
Для анализа в изотопной геохимии принято использовать коэффициенты разделения: α, Δ, δ.
α – коэффициент разделения – отношение содержаний любых двух изотопов в одном химическом соединении А к содержаниям соответствующих изотопов в другом химическом соединении В:
αА-В=RA/RB;
Например, коэффициент разделения изотопов O18 и O16 между водой и CaCO3 согласно реакции:
H2O18+1/3CaCO316↔H2O16+1/3CaCO318
выражается в виде:
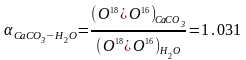
при 25 0С
Обычно значение α близко к 1, например 1,00Х, поэтому коэффициент разделения принято писать в виде Δ – величин, т.е. значения Х в промилле (‰).
‰ – Проми́лле (от лат. pro mille, букв. «к тысяче») — одна тысячная доля, 1/10%. Обозначается дробью «0 делить на 00» (‰). Обычно используется для обозначения доли чего-либо по отношению к целому.
Так,
1 ‰ = 1⁄1000 = 0,001 = 0,1 %
0 ‰ = 0
0,07 ‰ = 0,00007
30 ‰ = 0,03
45,1 ‰ = 0,0451
1000 ‰ = 1
2000 ‰ = 2
10 ‰ = 1 %
Величина в промилле от массы, выраженной в килограммах, эквивалентна массе в граммах. От массы в тоннах — килограммам.
Значения α и Δ связаны между собой выражением:
ΔA-B=(RA/RB - 1)*103=(α-1)*103,‰
Охарактеризуйте способность элементов к минералообразованию
От кларка зависит способность элемента к минералообразованию. Число минералов уменьшается с кларком.
Если К=1-10% - 239 минералов;
Если К=10-5-10-6% - 23 минерала
С уменьшением кларка уменьшается активная концентрация элементов, труднее достигается произведение растворимости.
Способность к минералообразованию, количество самостоятельных минералов, видов у элемента, с одной стороны, зависят от химических свойств элемента, а с другой – от его кларка.
Способность к минералообразованию характеризует отношение числа минералов данного элемента к его кларку в земной коре.
[CrO4]2, SeO42, MoO42- обычно встречаются с распространенными катионами
Озон в атмосфере. Образование, разрушение и значение для биосферы
2O2 + hV (<2025Å) – O3 + Oвозб
O2 + Oвозб – O3
O3 + hV (<2655Å) – O2 + Oвозб
O3 + Oвозб – 2O2
Озон – газ с резким специфическим запахом – сильный яд, по токсичности превосходи угарный газ; обладает мутагенными и канцерогенными свойствами.
Стратосферный озон обладает способностью поглощать ультрафиолетовое излучение, защищает от постоянных вирусов и бактерий.
Происхождение газов в атмосфере
Кислород
Первичный кислород возник при фотодиссоциации воды
Возникновение жизни резко усилило генерацию кислорода.
Фотосинтез (3 млрд.лет назад): СО2 + Н2О = НСОН + О2
Около 500 млн лет О2 назад было больше современного уровня
В герцинское время снизилось до современного уровня (около 300 млн лет назад).
Современный состав атмосферы установился около 50 млн лет назад (с палеогена).
Ежегодно количество О2 уменьшается а атмосфере на 10 – 12 млрд. тонн за последние 20 лет человечество изъяло примерно 250-300 млрд. тонн О2
Установившейся равновесный уровень содержания кислорода в современной атмосфере сохранится надолго до полного окисления Fe2+ в мантии. После этого должно начаться выделение глубинного кислорода за счет бародиффузного распада окислов железа:
Fe3O4 - 3Fe∙FeO + 5O
Азот
В свободном состоянии присутствует во всех горных породах и метеоритах.
Первичный азот поступал в атмосферу в виде N2 или аммиака NH3.
В современной атмосфере 55% реликтового азота, а 45% – дегазировало из мантии.
В настоящее время происходит изъятие азота из атмосферы организмами и накопление его в осадках.
Благоприятны для фиксации азота в осадках аридный климат, отсутствие дождей. Значительное количество азота в виде азотных соединений скапливается, например, в гуано.
