
- •1.1. Эпидемиология
- •1.2. Этиология, патогенез и факторы риска
- •1.8. Классификация рака шейки матки
- •1.9. Лечение рака шейки матки
- •2.1. Эпидемиология
- •IV. Изменения диффузной эндокринной системы (apud)
- •2.8. Лечение рака эндометрия
- •3.1. Эпидемиология
- •3.8. Классификация рака яичников
- •3.9. Лечение рака яичников
3.1. Эпидемиология
Пристальное внимание, уделяемое проблемам лечения больных раком яичников, объясняется не только частотой встречаемости этого заболевания. Занимая третье место в структуре онкогинекологической патологии, рак яичников удерживает лидирующие позиции среди причины смерти у онкогинекологических больных. Так, по данным МАИР (Международного агентства по изучению рака), ежегодно в мире регистрируется 166000 новых случаев этой патологии и из них 100000 женщин умирает в течение первого года.
Встретить ЗНО яичников у женщин можно практически в любом возрасте (как у новорождённых девочек, так и у женщин после 80 лет). Отсутствие выраженных клинических признаков, поздняя обращаемость к врачу, недостаточная диагностическая база и ошибки в ведении этих больных являются основными причинами того, что у 2/3 больных первично диагностируется местнораспространённый и распространённый рак яичников. Внедрение дорогостоящих диагностических и лечебных мероприятий в III и IV стадиях заболевания не могут значительно изменить показателей лечения и выживаемости этих больных.
В ранней диагностике важно не только своевременное «появление» больного, но и технология его обследования. Известно, что около половины больных первоначально обращаются к врачам общей практики (хирургам, терапевтам); правильный диагноз в этом случае устанавливается у 17-20% больных. Неутешительно, что при обращении к гинекологам 50% заболеваний также остаются нераспознанными.
Злокачественные опухоли репродуктивной системы (рак молочной железы и гинекологические опухоли рак тела, шейки матки и яичников) являются наиболее частыми в структуре онкологической заболеваемости женщин, и их суммарная доля превышает 35%. Рак яичников составляет 4-6% среди злокачественных опухолей у женщин и занимает седьмое место по частоте. Если удельный вес рака яичников в онкологической заболеваемости женщин во всех странах мира примерно одинаков, то частота заболеваемости на 100000 женского населения значительно варьирует. В Европе, особенно в Северных странах и Великобритании, а также в Северной Америке, стандартизованные показатели заболеваемости наиболее высокие (10 и более на 100000). В Центральной и Южной Америке, Африке и Азии, включая индустриальные страны, такие как Япония, но исключая Израиль, эти показатели значительно ниже (7 и менее на 100000) (рис. 31).
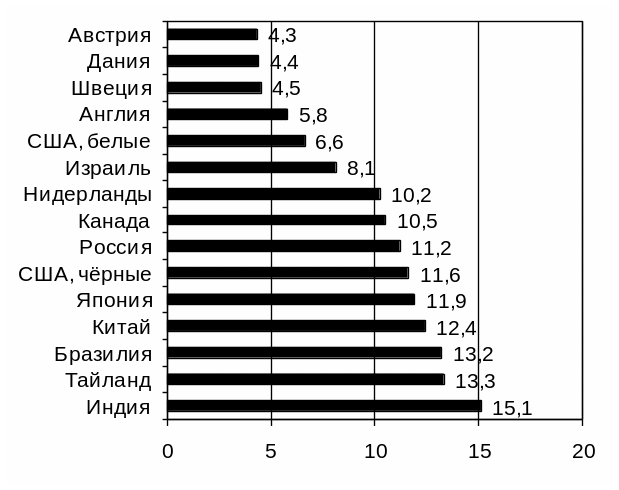
Рис. 31. Стандартизованные показатели заболеваемости раком яичников в мире в 1990-е годы (на 100000 женского населения). Практическая онкология: избранные лекции /под редакцией С.А.Тюляндина и В.М.Моисеенко. – Санкт-Петербург: Центр ТОММ, 2004. – 784 с.
За последние 20 лет уровни заболеваемости раком яичников в большинстве стран с высоким риском (Скандинавия, Великобритания, США, Канада) остаются стабильными и даже несколько снижаются. В то же время отмечено повышение заболеваемости в странах с низким риском, таких как Япония, Индия, Сингапур, а также в некоторых странах Южной и Восточной Европы (Португалии, Испании, Югославии, Польше).
В России ежегодно рак яичников выявляется более чем у 11000 женщин (10,17 на 100000). За последние 10 лет в стране произошел прирост заболевания на 8,5%. Интерпретация трендов в заболеваемости раком яичников крайне затруднительна, особенно в экономически развитых странах. С одной стороны, необходимо учитывать широкое применение оральных контрацептивов и факторов, обладающих протективным эффектом, как роды и лактация. С другой стороны, сокращение в цивилизованных странах числа беременностей и родов, приводящее к «непрекращающейся овуляции», способствует, возможно, повышению риска развития неоплазии в яичнике, как и применение препаратов, стимулирующих овуляцию в лечении бесплодия, и эстрогенов в терапии климактерических расстройств. Кроме того, нельзя не учитывать и фактора питания. Увеличение животных белков в рационе питания не исключает увеличения риска заболевания раком яичников.
В большинстве индустриальных стран мира рак яичников имеет самые высокие показатели смертности среди всех гинекологических опухолей, что связано с поздней диагностикой заболевания. По сводным данным популяционных раковых регистров стран Европы, 1-летняя выживаемость больных раком яичников составляет 63%, 3-летняя 41%, 5-летняя 35%. На рисунке 32 представлены показатели выживаемости больных основными гинекологическими опухолями.

Рис. 32. Относительная выживаемость больных гинекологическим раком по сводным данным популяционных раковых регистров Европы в 1990-е годы (в %). Практическая онкология: избранные лекции /под редакцией С.А.Тюляндина и В.М.Моисеенко. – Санкт-Петербург: Центр ТОММ, 2004. – 784 с
За последнее десятилетие отмеченное в Европе увеличение 5-летней выживаемости больных злокачественными опухолями яичников на 3% (с 32 до 35%), а в США на 4% (с 36 до 39%) объясняется не столько улучшением диагностики, сколько эффективным применением химиотерапии в лечении диссеминированных форм рака яичников и герминогенных опухолей.
Рассматривая онкогинекологические показатели заболеваемости и смертности в Омской области за 5 лет (с 2003 по 2007 годы) можно сказать, что в целом основные тенденции соответствуют Российским и мировым.
Успех лечения и прогноз дожития больных всецело зависит от стадии развития злокачественного процесса и своевременности диагностики. К сожалению, статистика свидетельствует, что опухоль выявляется в III-IV стадиях настолько часто (до 40%), что на долю так называемых ранних форм приходится ничтожно малое количество случаев, в основном диагностируемых случайно. Именно количеством диагностируемых у больных ранних опухолей определяются хороший прогноз их полного излечения.
3.2. Молекулярная генетика рака яичников
Наследственным факторам еще десять лет назад не придавали особого значения, хотя отдельные указания на существование семейной предрасположенности к данному заболеванию появились довольно давно. Сегодня роль генетической составляющей в патогенезе РЯ не вызывает сомнений.
Суть молекулярно-генетических изменений в опухолях сводится к трём компонентам:
1) активирующие мутации в онкогенах;
2) инактивирующие мутации в антионкогенах;
3) геномная нестабильность.
Онкогены кодируют белки, играющие важную роль в процессах позитивной регуляции клеточного деления и дифференцировки; если их экспрессия избыточна или протекает в измененном виде, то это индуцирует неконтролируемую пролиферацию клеток. Гены-супрессоры, называвшиеся до недавнего времени антионкогенами, ответственны за синтез белков, осуществляющих негативный контроль клеточного деления или индукцию апоптоза. В противоположность онкогенам функционально значимые мутации в супрессорных генах носят инактивирующий характер.
Соматические мутации. Одним из наиболее изученных онкогенов, активация которого достаточно часто обнаруживается при раке яичников, является ген K-ras. Продукт гена K-ras относится к классу G-белков и участвует в самых разнообразных аспектах регуляции клеточных процессов. Мутации K-ras встречаются значительно чаще в муцинозных, по сравнению с немуцинозными РЯ, что позволяет обсуждать перспективность данного теста для дифференциальной диагностики.
Другой онкоген, к которому привлечено в последние годы пристальное внимание, это c-erbB2/HER2, кодирующий мембранный гликопротеид семейства рецепторов эпидермального фактора роста. Гиперэкспрессия данного гена наблюдается в 10-50% случаев. Во многих работах показано, что активация c-erbB2/HER2 указывает на неблагоприятный прогноз течения рака яичника.
Существенное место в патогенезе РЯ принадлежит супрессорному гену р53. Продукт гена р53 отвечает за самоустранение клеток, получивших критические повреждения ДНК. Инактивация р53 наблюдается примерно в половине опухолей РЯ.
Нарушения в различных генах клеточного цикла, по-видимому, могут иметь весьма сходные функциональные проявления. Известно, что регуляция клеточного цикла находится под контролем белкового комплекса, состоящего из циклинов и циклин-зависимых киназ (Cdk).
Считается, что активирующие события в генах циклинов и Cdk имеют онкогенный эффект, в то время как Cki выступают как гены-супрессоры.
В последние годы внимание широкого круга специалистов, в том числе и онкологов, привлечено к ферменту теломеразе. Основная функция теломераз состоит в препятствовании укорочению концевых участков хромосом в процессе деления клеток. Установлено, что при многих типах опухолей наличие активной теломеразы коррелирует с неблагоприятным прогнозом. Теломеразная активность обнаруживается в 92% карцином яичника. При этом следует заметить, что наиболее высокая активность фермента обнаруживается в низкодифференцированных карциномах.
Роль генного полиморфизма в патогенезе рака яичников. Предполагается, что некоторые варианты генов, продукты которых участвуют в синтезе андрогенов и эстрогенов, могут несколько увеличивать риск новообразований репродуктивной сферы.
В частности, к кандидатам относятся гены группы цитохрома р450 (CYP1A1, CYP17 и CYP19).
Значительный интерес представляют гены, ответственные за метаболизм эндогенных и экзогенных канцерогенов, например группы полициклических ароматических углеводородов (ПАУ). В метаболизме ПАУ ключевая роль принадлежит ферментам группы цитохрома р450. Полиморфизм этих генов может участвовать в формировании целого ряда новообразований.
Молекулярная генетика наследственного рака яичников. Хотя семейные раки яичника достаточно редки, их молекулярная генетика изучена значительно лучше по сравнению со спонтанными опухолями. Эпидемиологические исследования и анализ семейной истории РЯ позволили выявить, что около 10% случаев эпителиального РЯ обусловлены передаваемыми в поколениях генетическими изменениями. В настоящее время описаны две независимые формы наследственного РЯ:
1) синдром рака молочной железы и яичников, на который приходится 90-95% всех случаев наследственного РЯ;
2) синдром, ассоциированный с высокой семейной встречаемостью рака толстой кишки и раком эндометрия (5-10% случаев).
Успехи молекулярной генетики привели к разработке методик прямого обнаружения случаев наследственного РЯ (табл. 5).
Таблица 5
Молекулярно-генетические детерминанты наследственного рака яичников
Синдромы |
Гены |
Хромосомная локализация генов |
Удельная встречаемость в пределах синдрома, % |
Рак молочной железы и яичников |
BRCA 1 BRCA 2 неизвестен |
17q21 13q12 ? |
75-90 10-25 < 5 |
Наследственный неполипозный рак толстой кишки (HNPCC) |
MSH 2 MSH 1 MSH 6 PSM 2 PSM 1 неизвестен |
2p22-p21 3p21 2p16-p15 7p22 2q31-q38 ? |
30-35 30-35 5 < 5 < 1 30 |
Как показывает генетический анализ, большинство случаев наследственного РЯ связано с врождёнными мутациями гена BRCA1 и гена BRCA2.
Синдром неполипозного семейного рака толстой кишки в сочетании с РЯ и раком эндометрия определяется наличием наследственного дефекта в каком-либо из пяти известных генов, MSH2, МLH1, MSH6, PMS2 или PMS1.
В заключение остановимся коротко на том, какое клиническое значение имеют данные о наследственной природе определенной группы опухолей яичников. Накопленные к настоящему времени результаты исследований не дают еще полного представления об особенностях течения и прогнозе наследственного РЯ.
Не вызывает сомнений, что BRCA-1 ассоциированный РЯ морфологически относится к серозному типу и диагностируется обычно у более молодых женщин. Кроме того, создается впечатление, что в случае BRCA мутаций опухоли проявляют несколько большую чувствительность к химиотерапии. Идентификация мутаций в генах наследственных раковых синдромов имеет решающее значение для превентивной медицины. Предполагается, что лабораторные генетические тесты позволят сфокусировать мероприятия, направленные на раннюю диагностику новообразований, именно на тех лицах, которые в них больше всего нуждаются. В частности, обнаружение зародышевых мутаций, ассоциированных с семейным РЯ, свидетельствует о необходимости учащённых ультразвуковых обследований органов брюшной полости, пристального внимания за состоянием молочных желёз. В некоторых случаях ставился вопрос о целесообразности профилактической овариэктомии и мастэктомии.
По данным исследований, проведённых на базе Омского областного онкологического диспансера, установлено, что у больных с запущенными формами рака яичников пре- и постменопаузального периода отмечается выраженная иммунная дисфункция, характеризующаяся как количественными, так и функциональными нарушениями Т-клеточного иммунитета. Кроме того, при этом:
1) снижались показатели субклассов Ig G1, IgG2, IgG3 в 3,2-4,8 раза;
2) С4 комплемента в 2,5 раза;
3) лактоферрина в 5,7-7,0 раз по сравнению с контрольной группой;
4) уровень ЦИК превышал показатели контрольной группы в 1,6-1,7 раза.
Подводя краткий итог, можно заключить, что в последние годы наши знания о молекулярных механизмах туморогенеза яичников существенно изменились. Хотя многие детали этого сложнейшего процесса остаются не до конца ясными, стало очевидным, что формируются научные основы повышения эффективности диагностики и лечения данной группы злокачественных новообразований.
3.3. Клинические проявления рака яичников
Клиническая картина рака яичников обусловлена анатомическими особенностями и морфологической структурой опухоли:
1) яичники свободно расположены в брюшной полости на довольно длинной ножке, которая гипертрофируется с увеличением овариального образования. Рост опухоли, как правило, не сопровождается сдавлением рядом расположенных органов, и клиническая картина может длительное время отсутствовать;
2) яичник не имеет серозной оболочки, следствием чего является быстрое имплантационное метастазирование по органам брюшной полости;
3) яичник содержит элементы всех трёх зародышевых листков и таким образом имеет исходные зачатки для развития любой злокачественной опухоли.
Можно выделить 2 группы симптомов и синдромов, характерных для злокачественных опухолей яичников:
1) общие неспецифичные – характерны для любого морфологического варианта опухоли;
2) специфичные – связаны с особенностями морфологического строения опухоли.
Подробно остановимся на общих неспецифичных симптомах и синдромах.
Увеличение живота. Является наиболее частым симптомом при раке яичников. Увеличение живота может происходить как за счёт асцита или значительных размеров опухоли, так и за счет обоих этих факторов. Нередко с увеличением живота пациентка отмечает похудание верхних и нижних конечностей. Реже больная самостоятельно обнаруживает опухоль в животе.
Болевой синдром. Может существенно варьировать по характеру и интенсивности в зависимости от механизма его возникновения:
1) чаще всего болевой синдром не выражен и проявляется неопределённого характера болью в различных отделах живота, небольшой интенсивности. Больная предъявляет жалобы на дискомфорт, тяжесть, чувство распирания в животе;
2) при возникновении некроза капсулы опухоли боль усиливается и пациентка может конкретно указать область живота, где её беспокоят довольно интенсивные боли режущего характера. При пальпации боль усиливается и может быть локальный симптом Щёткина;
3) периодически возникающие схваткообразные боли в животе, сопровождающиеся его вздутием, характерны для хронической кишечной непроходимости. Причиной данного болевого синдрома является сдавление и/или врастание метастазов опухоли, реже первичного очага, в различные отделы кишечника;
4) внезапно возникшие острые боли в низу живота, высокой интенсивности, режущего характера, с иррадиацией в прямую кишку и крестец характерны для перекрута ножки опухоли и могут быть первым признаком заболевания.
Одышка. Нередкий симптом заболевания. Причиной одышки являются:
1) значительное увеличение живота, асцит, сопровождающиеся существенным подъёмом купола диафрагмы, что влечёт за собой уменьшение жизненной ёмкости лёгких и разворот сердца от физиологической оси с нарушением функции сердечной деятельности;
2) плеврит, причиной которого зачастую бывает канцероматоз плевры;
3) анемия, которая связана с большим объёмом опухолевой ткани и резорбцией продуктов распада и жизнедеятельности опухоли, а также с нарушением функции органов желудочно-кишечного тракта вследствие их сдавления и вторичного поражения опухолью.
Повышение температуры тела. У большинства пациенток это связано с некрозом опухоли и/или её капсулы, более редкая причина – метастатическое поражение печени, лёгких и плевры.
Кровянистые выделения из половых путей. Появление кровянистых выделений обусловлено:
1) прорастанием опухоли в матку;
2) гормональной активностью опухоли яичника и связанными с ней гиперпластическими процессами эндометрия, которые сопровождаются дисфункциональными маточными кровотечениями и кровотечениями в менопаузе;
3) наличием первично-множественной злокачественной опухоли тела или шейки матки.
3.4. Диагностика рака яичников
По литературным данным, причинами врачебных ошибок при диагностике рака яичников являются недостаточное знание семиотики злокачественных опухолей и тактические, состоящие в длительном наблюдении больной без уточнения диагноза, а именно:
1) длительное наблюдение за больными с «небольшими» кистами яичников;
2) длительное безуспешное проведение противовоспалительной терапии при аднекстуморах;
3) длительное наблюдение за больными с предполагаемым диагнозом узловатой миомы матки;
4) длительное наблюдение за больными с опухолями в малом тазу неясной локализации;
5) непатогномоничные для гинекологических заболеваний признаки (нелокализованная боль в брюшной полости, немотивированная слабость, расстройства диспепсического характера, нарушение функции мочевых органов, субфебрильная температура, повышение СОЭ), которые не связываются с опухолями яичников;
6) недиагностированные небольшие раковые опухоли яичников, которые могут давать массивные метастазы и сопровождаться асцитом.
Такие пациентки нуждаются в тщательном комплексном обследовании, вплоть до диагностической лапаротомии.
3.5. Группы риска
Группы риска - это:
1) пациентки с ранним и поздним наступлением менструаций;
2) пациентки с поздней менопаузой (после 50 лет);
3) больные, страдающие миомой матки и эндометриозом;
4) длительно наблюдающиеся по поводу хронического воспаления придатков;
5) женщины, страдающие дисфункциональными маточными кровотечениями и кровотечениями в менопаузе;
6) женщины с отсутствием половой жизни;
7) пациентки с первичным бесплодием или нарушением детородной функции (18-38%); отсутствие родов повышает риск на 100%.
8) женщины, которые ранее подвергались оперативным вмешательствам по поводу различных гинекологических заболеваний с оставлением яичников (10-12%);
9) отягощённый наследственный фон:
а женщины, имеющие родственников, больных раком яичников (риск заболеть в 3 раза выше),
б синдром Линча, когда наряду с раком яичников у ближайших родственников наблюдается развитие рака молочной железы, эндометрия, желудочно-кишечного тракта и мочеполовой сферы,
в имеющие родственников, болеющих аденокарциномой любой локализации (риск развития рака яичников в 1,5 раза выше).
3.6. Алгоритм обследования
Алгоритм обследования пациенток с подозрением на опухоль яичников можно сформулировать следующим образом:
1) обязательное ректо-вагинальное исследование;
2) ультразвуковое исследование органов малого таза (с трансвагинальной эхографией);
3) ультразвуковое исследование органов брюшной полости (с подробным описанием на только структуры паренхиматозных органов, но и описанием лимфатических коллекторов малого таза и брюшной полости и забрюшинного пространства;
4) рентренография органов грудной полости (или флюорографическое исследование);
5) исследование желудочно-кишечного тракта:
- фиброгастродуоденоскопия,
- колоноскопия (или ирригоскопия с предшествующей ректороманоскопией);
6) цитологическое исследование материала, полученного при пункции через задний свод влагалища (через переднюю брюшную стенку при наличии асцита);
7) цитологическое исследование материала из цервикального канала и аспирационная биопсия эндометрия;
8) определение концентрации опухолевых маркёров Са125, Са19,9.
3.7. Патоморфологическая верификация опухолей яичников
Опухоли яичников составляют один из труднейших разделов частной онкоморфологии. Объясняется это их чрезвычайным разнообразием и, с другой стороны, предельной запутанностью вопросов гистогенеза, по поводу которых были высказаны самые противоречивые мнения. Приводимое далее описание некоторых гистологических вариантов опухолей помогает взглянуть на доброкачественную, пролиферирующую и малигнизированную опухоли как на естественные этапы канцерогенеза.
Сецернирующая серозная кистома. Однокамерная или многокамерная, с очень тонкими стенками, в просвете находится прозрачная слегка желтоватая жидкость. Внутренняя поверхность стенки кисты гладкая (рис. 33).
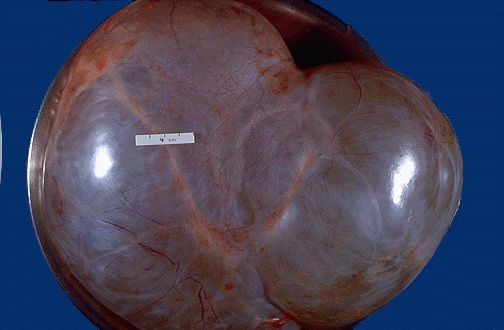
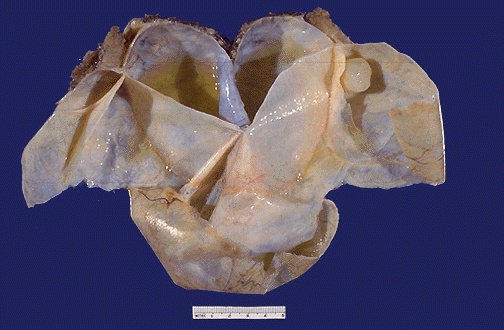
Рис. 33. Цилиоэпителиальная кистома яичника, множественная цистаденома яичника.
Эпителиальная выстилка обладает удивительным сходством с эпителием маточных труб (рис. 34).
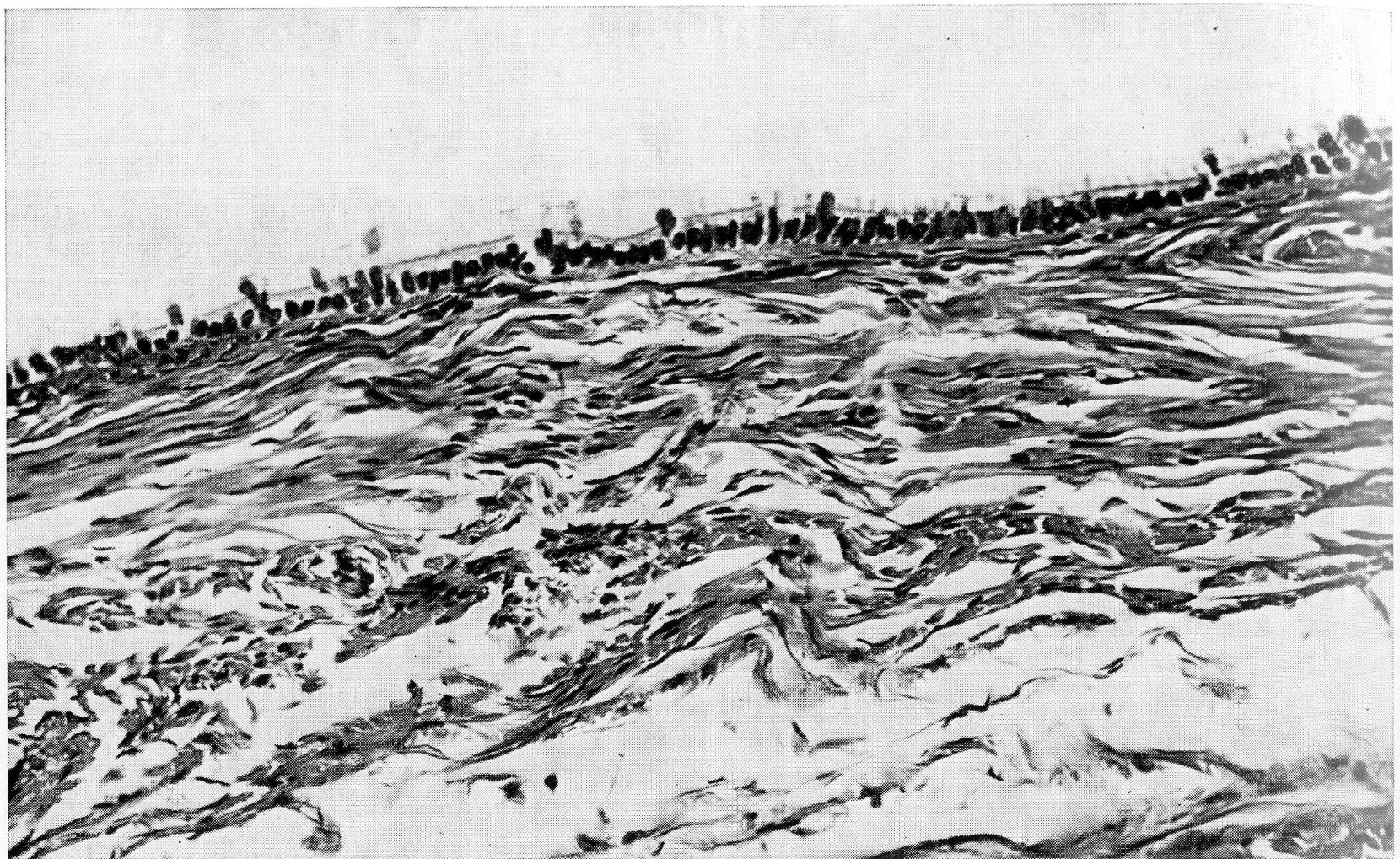
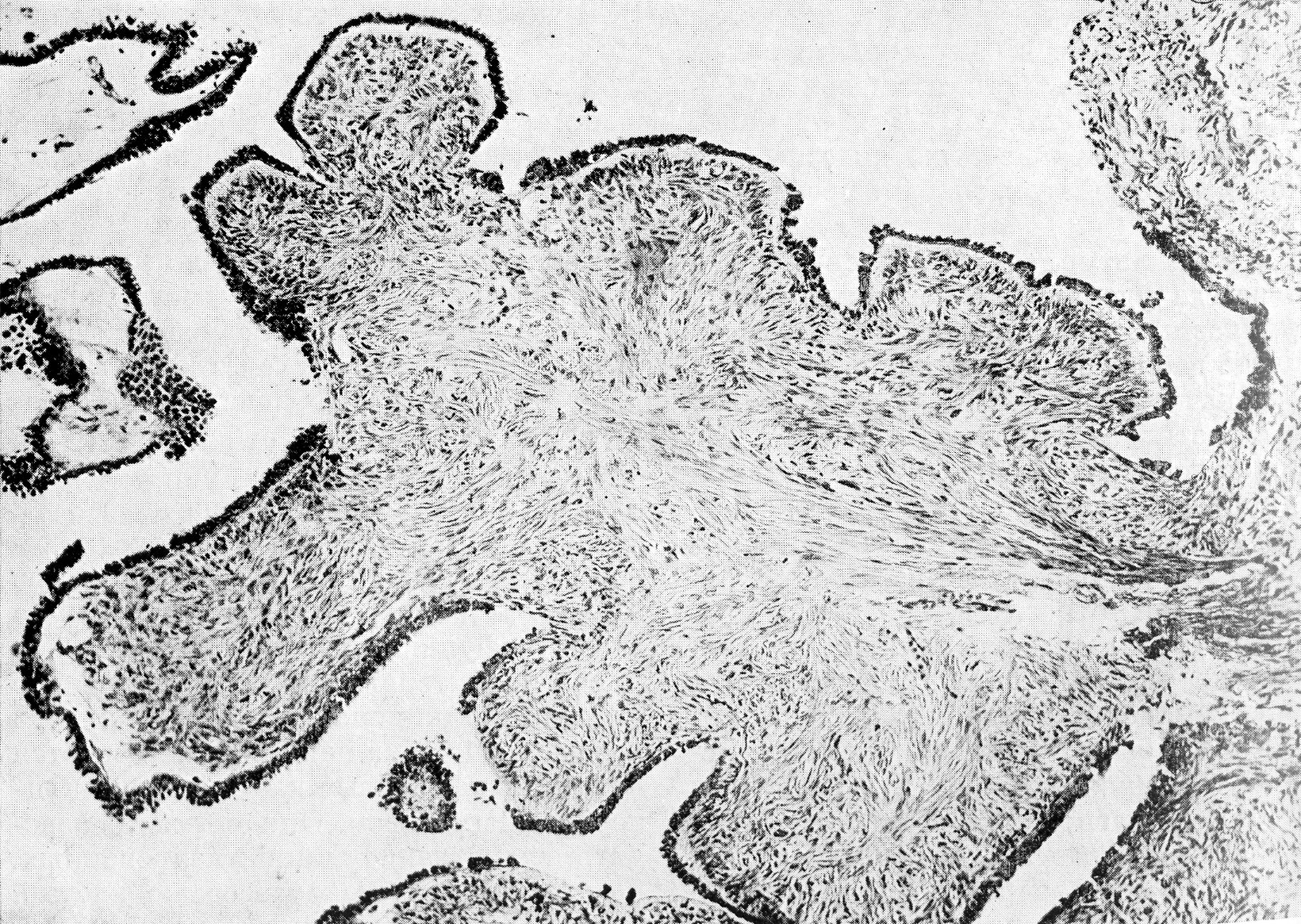
Рис. 34. Сецернирующая серозная киста яичника, грубые сосочковые структуры в сецернирующей серозной кисте. Д.И.Головин Ошибки и трудности гистологической диагностики опухолей. –Л. 1982. -304с.
Создается впечатление, что трубный эпителий как бы пересажен в яичник. В стенке кисты видны те же клеточные формы, которые обнаруживаются в трубах половозрелой женщины. Это реснитчатые клетки, затем клетки, вырабатывающие слизь, функция тех и других ясна. Не менее характерны и другие клеточные формы, функциональные обязанности которых еще пока не известны. Имеются в виду штифтиковые клетки с узким гиперхромным ядром. Они могут производить впечатление пикнотизированных, но это вполне жизнеспособные клетки. Это же следует сказать о так называемых клетках-пузырях округлой формы, с крупным, светлым, цитоплазматическим телом. Все эти клетки располагаются в один слой, сосочки отсутствуют.
Правда, в просвет простой серозной кисты могут вдаваться крупные грубые фиброзные выступы (рис. 34), покрытые таким же эпителием, что и в остальных участках кисты, или вовсе лишенные эпителиальной выстилки. Такие грубые фиброзные сосочки ничего общего не имеют со следующей формой, пролиферирующей серозной кистой. Кисты с грубыми сосочками являются разновидностью сецернирующей серозной кисты. Если эпителий кисты подвергается атрофии, то он не только уплощается, но и становится индифферентным. Тогда установлению диагноза могут помочь мелкие известковые тельца – в стенке серозных кист они встречаются почему-то часто, а муцинозных – редко.
Пролиферирующая серозная кистома. Согласно классификации ВОЗ, папиллярные серозные опухоли могут быть как доброкачественными, так и пограничными. Думается, что это неверно. Пограничные опухоли есть не что иное, как пролиферирующие. Но уже само появление множественных, сильно ветвящихся, мелких сосочков свидетельствует о наличии пролиферации. Размножающийся эпителий уже не умещается на ровной поверхности стенки кисты, как это имеет место в простых серозных кистах, и начинает заполнять просвет кисты в виде упомянутых сосочков (рис. 35). Поэтому сосочковая киста не может быть простой, то есть сецернирующей, она всегда является пролиферирующей. Эпителиальный покров ворсинок, располагающийся в один слой, может сохранить цитологические особенности трубного эпителия (реснитчатые, штифтиковые, клетки-пузыри и т. д.) или оказаться индифферентным (рис. 35).
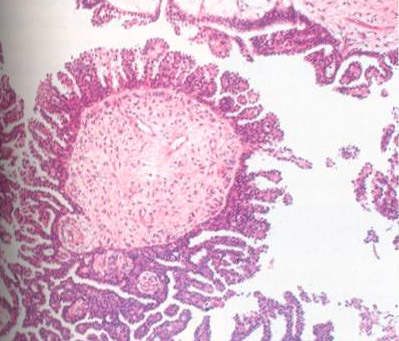
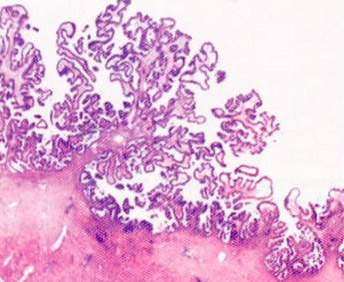
Рис.35. Пограничная серозная кистома.
World health organization classification of tumors of the breast and female genital organs, IARS Press Lyon, 2003
Клиническое поведение пролиферирующих серозных кист часто оказывается непредсказуемым, быть может, потому, что всю кисту разложить на серию срезов невозможно и участки малигнизации могут оказаться просмотренными (многослойность, митозы, полиморфизм).
Удивительно, что эвертирующий рост с образованием сосочков на наружной поверхности кисты и даже обсеменение брюшины пролиферирующими кистомами некоторыми авторами не рассматриваются как признак их озлокачествления.
Сецернирующая муцинозная кистома. Обычно односторонняя. Может достигать очень больших размеров. Чаще многокамерная. Содержимое в типичных случаях напоминает желе. Внутренняя поверхность кисты выстлана одним слоем клеток, не отличимых от клеток цервикального канала – с четкими клеточными границами, ядрами, имеющими форму чашек и расположенными базально, и слизью в апикальных отделах (рис. 36). Иногда отмечается сходство с покровными клетками эпителия желудка (слизь ШИК-положительна, но дает отрицательные реакции с муцикармином) или клетками кишечника (слизь окрашивается муцикармином и коллоидальным железом). Иногда эпителий выстилает не только свободную поверхность стенки кисты, но и содержащиеся в ней щели, создавая гландулярные или подобие сосочковых структур. Во избежание путаницы важно подчеркнуть, что никакого отношения к пролиферации эти псевдожелезы и псевдососочки не имеют.
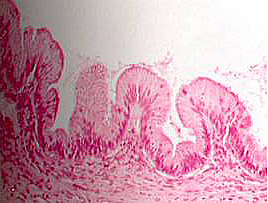
Рис. 36. Сецернирующая муцинозная киста. а муцинозная кистома яичника; б муцинозная цистаденома яичника.
World health organization classification of tumors of the breast and female genital organs, IARS Press Lyon, 2003
Пролиферирующая муцинозная кистома. Главное ее отличие от простой – наличие сосочков, выступающих в просвет кисты. Сосочковые муцинозные кисты, равно как и серозные, вопреки классификации ВОЗ, не могут быть «простыми», т. е. вполне доброкачественными, иначе сецернирующими. Само наличие сосочков служит свидетельством пролиферации, состояния пограничного между доброкачественностью и злокачественностью. Сосочки обычно нежные, с тонкой соединительнотканой ножкой. Они покрыты, как и при простых муцинозных кистах, однослойным эпителием. Последний местами сохраняет цитологические особенности эпителия шейки матки, местами их утрачивает и становится просто кубическим или цилиндрическим (рис. 37).
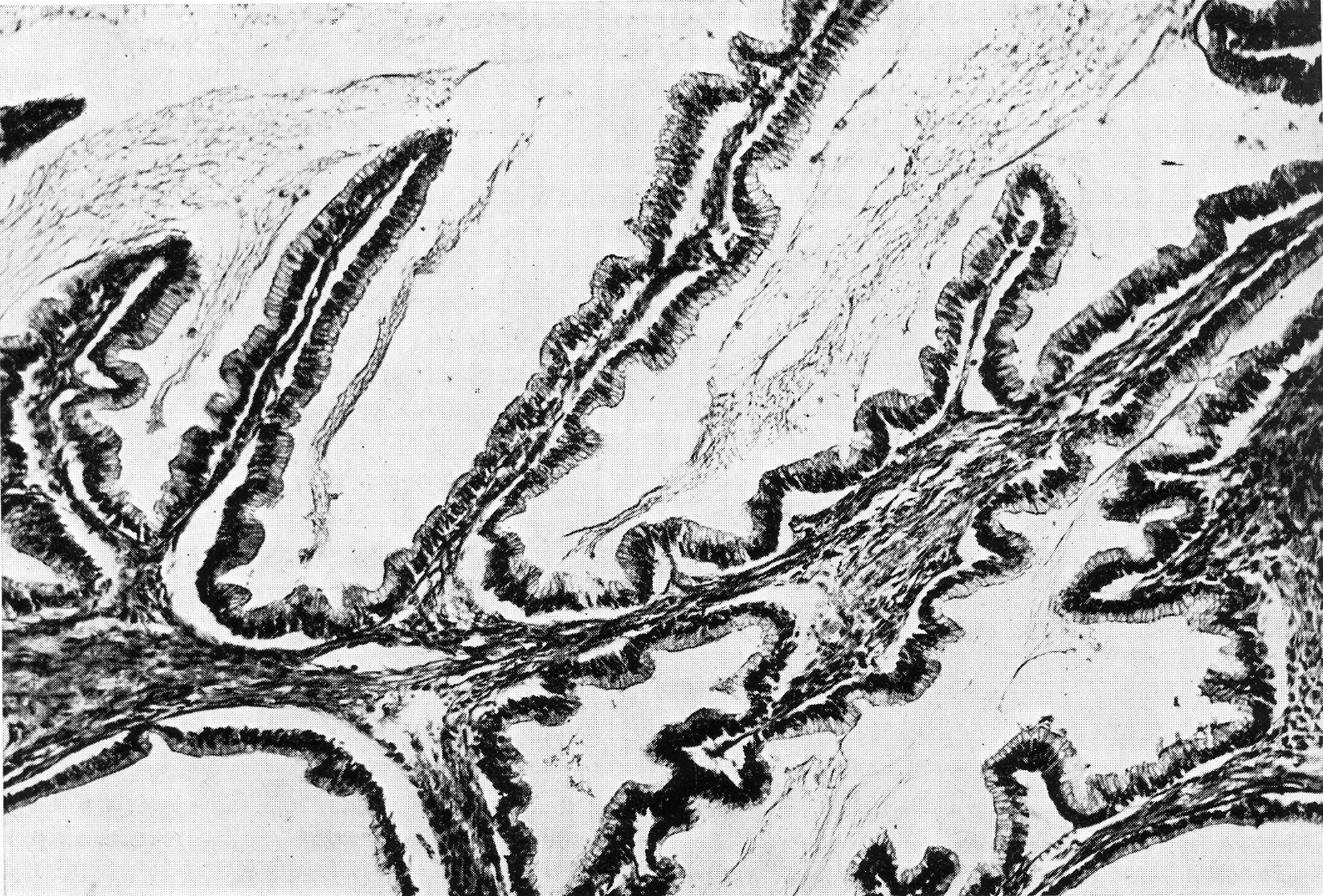
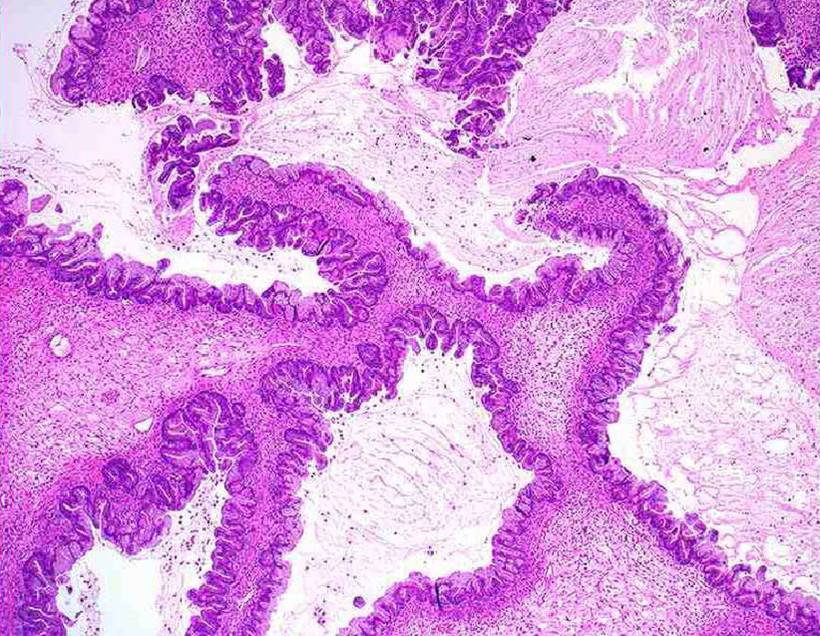
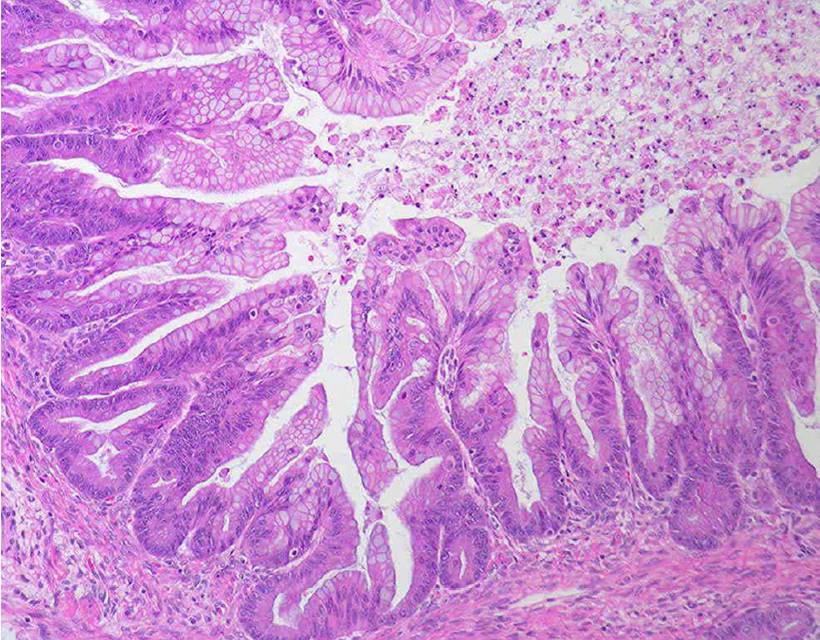
Рис. 37. Пролиферирующая муцинозная киста.
World health organization classification of tumors of the breast and female genital organs, IARS Press Lyon, 2003
Малигнизированные кистомы. Их сосочки, если они еще сохранены, выстланы уже не однослойным эпителием, как в пролиферирующих кистомах, а многослойным, появляются митозы, нарастает полиморфизм. В раковых пластах иногда удается найти клетки, характерные для серозных или муцинозных кист (рис. 38), но часто по раковым структурам установить их гистогенез не удается. Они уже не несут в себе никаких признаков цилиоэпителиального или муцинозного происхождения. Догадаться об этом можно, лишь изучая ранние стадии процесса, наименее измененные участки кисты, так называемый фон.

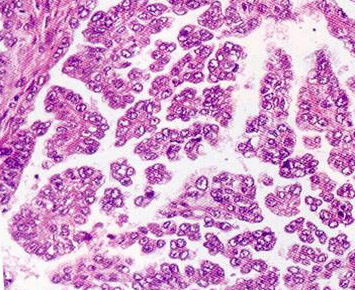
Рис. 38. Малигнизированная муцинозная киста. Серозная аденокарцинома.
World health organization classification of tumors of the breast and female genital organs, IARS Press Lyon, 2003
Все серозные кисты встречаются значительно чаще, чем муцинозные. Но динамика малигнизации остается одной и той же. Сецернирующие кисты выстланы однослойным трубным или эндоцервикальным эпителием. Сосочков нет. Пролиферирующие кисты отличаются от сецернирующих образованием сосочков; эпителий остается однослойным, трубным или эндоцервикальным. В малигнизированных кистах сосочки обычно сохраняются, но выстланы они уже эпителием многослойным, атипичным и полиморфным, появляются гигантские клетки и митозы.
Аденофиброма (аденокистозная фиброма). Очень редкий вариант серозных или муцинозных опухолей. Представляет собой фиброму (или текому), в составе которой находятся эпителиальные трубки или кисты, выстланные эпителием типа трубного или эндоцервикального (рис. 39). В литературе сообщения о малигнизации аденофибром очень малочисленные.

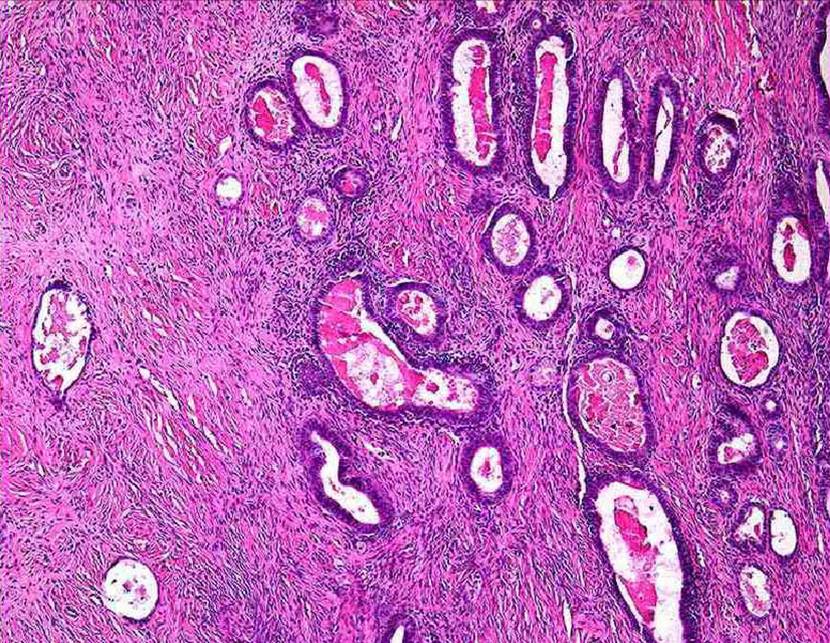
Рис. 39. Эндометриоидная цистаденофиброма.
World health organization classification of tumors of the breast and female genital organs, IARS Press Lyon, 2003
Опухоль Бреннера. По М.Ф.Глазунову (1961), аденофиброма (аденокистозная фиброма) и опухоль Бреннера являются, собственно говоря, вариантами одной и той же формы, отличаясь друг от друга лишь вторичными деталями строения эпителиальных структур. Основу опухоли составляет своеобразная плотная волокнистая ткань. Если на этом фиброзном фоне видны железистые или микрокистозные структуры, выстланные эпителием типа трубного или эндоцервикального, то это аденофиброма (или аденокистозная фиброма). Если эпителиальные гнезда становятся многослойными, образуя солидные островки, то это опухоль Бреннера (рис. 40).

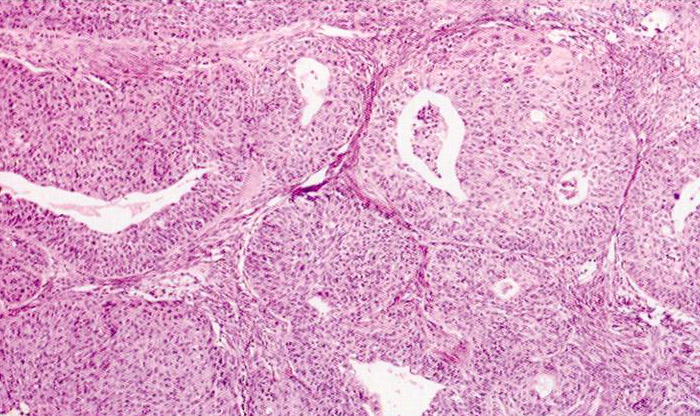
Рис. 40. Опухоль Бреннера.
World health organization classification of tumors of the breast and female genital organs, IARS Press Lyon, 2003
Мезонефрома. Под этим названием объединены опухоли различного происхождения, неодинаковой структуры и очень отличающиеся друг от друга по клиническому поведению. Дело в том, что мезонефромами называют по крайней мере три различные опухоли: истинную мезонефрому Шиллера, парвилокулярную кистому Шиллера и мезонефрому Сафира и Лакнера. Истинная мезонефрома Шиллера, по современным представлениям, представляет собой герминогенную опухоль. Место этой опухоли – среди тератоидных опухолей яичника.
Парвилокулярная кистома Шиллера не что иное, как вариант аденофибромы или, точнее, аденокистозной фибромы, отличающейся от своего прототипа тем, что эпителиальная выстилка микрокист не дифференцируется в направлении эндоцервикального или трубного эпителия.
Вариант Сафира и Лакнера резко отличается от только что описанных мезонефром. Это кистозно-сосочковый светлоклеточный рак. Опухоли подобного строения встречаются не только в яичниках, но и в самых различных участках женского полового тракта: матке, эндоцервиксе и влагалище.
Опухоли из гормонпродуцирующих компонентов яичника. Если опухоли с явно мюллеровой дифференцировкой эпителия (серозные и муцинозные кисты с их вариантами в виде аденофибром, опухоли Бреннера, эндометриоидных кист) свойственны только яичникам, то в отношении гормонпродуцирующих новообразований дело обстоит иначе. Чем больше увеличивается число наблюдений этих редких опухолей, тем яснее становится морфологическая идентичность гормонпродуцирующих опухолей яичников и яичек.
Ответственны за выработку гормонов, как известно, специализированные ткани гонад гранулеза, тека, сертолиевы и лейдиговы клетки (рис. 41). Среди гормонпродуцирующих новообразований яичников следует различать опухоли типа элементов женской части гонады (гинобластомы) и типа элементов мужской части гонады (андробластомы).

Рис.41. Опухоль из клеток Сертоли-Лейдига.
World health organization classification of tumors of the breast and female genital organs, IARS Press Lyon, 2003
Клинический эффект гормонпродуцирующих опухолей имеет необычайно сложный механизм и зависит не только от численного преобладания тех или иных клеточных форм, но и степени их функциональной активности, возможности выработки не свойственных им гормонов. В результате этого, например, при гранулёзоклеточных опухолях (рис. 42) может иметь место как избыток эстрогенов, так и избыток андрогенов. Это же следует сказать и об андробластомах и текомах.
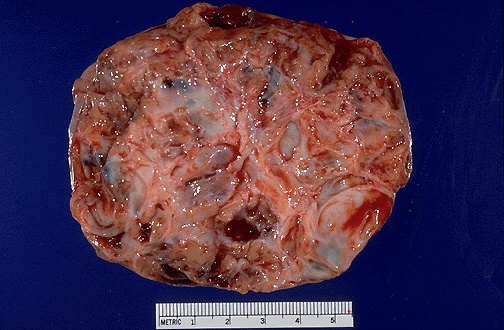
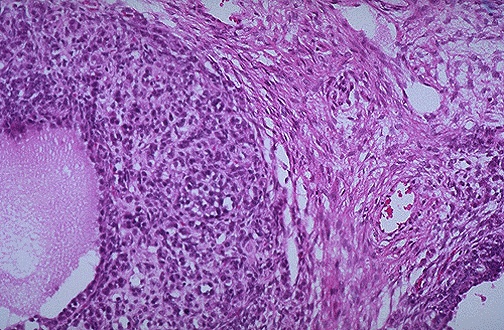
Рис. 42. Гранулёзоклеточная опухоль яичника.
