
- •1.6 Елементи механіки суцільних середовищ
- •1.7 Принцип відносності в класичній механіці
- •2.1 Молекулярно-кінетична теорія речовини
- •2.2 Розподіл молекул ідеального газу за їхніми швидкостями
- •3.8 Магнітне поле
- •3.9 Сила Лоренца.
- •3.12 Робота з переміщення
- •4.6. Швидкість механічних хвиль в газах, рідинах та твердих тілах. Потік енергії хвилі. Звукові хвилі, їх основні характеристики. *Ультразвук. Область чутності. *Акустика приміщень та споруд.
- •5.1 Геометрична оптика та основні її закони.
- •5.2 Інтерференція світла.
- •6.2 Волновая функция и ее статистический смысл
- •Общее уравнение Шредингера. Уравнение Шредингера для стационарных состояний
- •7.2. Радіоактивні перетворення. Ядерні реакції, їхній механізм та класифікація. Закони збереження в ядерних реакціях. *Одержання та використання радіоактивних ізотопів.
- •7.3. Радіоактивність. Закон радіоактивного розпаду. Активність нукліду. Закономірності альфа- та бета-розпадів. Нейтрино.
- •7.6*. Сучасна фізична картина світу. Субатомні частинки, їхня класифікація та основні властивості. Частинки та античастинки. Кваркова модель будови матерії. Проблеми фізики та астрофізики.
Общее уравнение Шредингера. Уравнение Шредингера для стационарных состояний
Статистическое толкование волн де Бройля (см. § 216) и соотношение неопределенностей Гейзенберга (см. § 215) привели к выводу, что уравнением движения в квантовой механике, описывающим движение микрочастиц в различных силовых полях, должно быть уравнение, из которого бы вытекали наблюдаемые на опыте волновые свойства частиц. Основное уравнение должно быть уравнением относительно волновой функции Y(х, у, z, t), так как именно она, или, точнее, величина |Y|2, определяет вероятность пребывания частицы в момент времени t в объеме dV, т. е. в области с координатами х и x+dx, у и y+dy, z и z+dz. Taк как искомое уравнение должно учитывать волновые свойства частиц, то оно должно быть волновым уравнением, подобно уравнению, описывающему электромагнитные волны.
Основное уравнение
нерелятивистской
квантовой механики
сформулировано в 1926 г. Э. Шредингером.
Уравнение Шредингера, как и все основные
уравнения физики (например, уравнения
Ньютона в классической механике и
уравнения Максвелла для электромагнитного
поля), не выводится, а постулируется.
Правильность этого уравнения
подтверждается согласием с опытом
получаемых с его помощью результатов,
что, в свою очередь, придает ему характер
закона природы. Уравнение Шредингера
имеет вид![]() (217.1)
(217.1)
где ћ=h/(2p),
т—масса
частицы, D—оператор
Лапласа
![]() i
— мнимая единица, U
(х, у, z,
t)
— потенциальная
функция частицы в силовом поле, в котором
она движется, Y(х,
у, z,
t)
— искомая волновая функция частицы.
i
— мнимая единица, U
(х, у, z,
t)
— потенциальная
функция частицы в силовом поле, в котором
она движется, Y(х,
у, z,
t)
— искомая волновая функция частицы.
Уравнение (217.1)
справедливо для любой частицы (со
спином, равным 0; см. § 225), движущейся с
малой (по сравнению со скоростью света)
скоростью, т. е. со скоростью v<<с.
Оно дополняется условиями, накладываемыми
на волновую функцию: 1) волновая
функция должна быть конечной, однозначной
и непрерывной (см. § 216); 2) производные
![]() должны быть непрерывны; 3) функция |Y|2
должна быть интегрируема; это условие
в простейших случаях сводится к условию
нормировки вероятностей (216.3).
должны быть непрерывны; 3) функция |Y|2
должна быть интегрируема; это условие
в простейших случаях сводится к условию
нормировки вероятностей (216.3).
Чтобы прийти к
уравнению Шредингера, рассмотрим
свободно движущуюся частицу, которой,
согласно идее де Бройля, сопоставляется
плоская волна. Для простоты рассмотрим
одномерный случай. Уравнение плоской
волны, распространяющейся вдоль оси
х,
имеет вид (см. § 154)
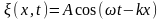 ,
или в комплексной записи
,
или в комплексной записи
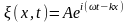 .
Следовательно, плоская волна де Бройля
имеет вид
.
Следовательно, плоская волна де Бройля
имеет вид![]() (217.2)
(217.2)
(учтено, что w = E/ћ, k=p/ћ). В квантовой механике показатель экспоненты берут со знаком минус, но поскольку физический смысл имеет только |Y|2, то это (см. (217.2)) несущественно. Тогда
![]()
откуда![]() (217.3)
(217.3)
Используя взаимосвязь между энергией Е и импульсом р (E=p2/(2m)) и подставляя выражения (217.3), получим дифференциальное уравнение
![]()
6.3 Ядра всіх атомів складаються з протонів (електричний заряд +е, маса mp=1,67·10-27кг) і нейтронів (заряд рівний нулю, маса mn=1,675·10-27кг). Спільна назва протонів і нейтронів – нуклони. Нуклони – складові частинки ядра. Між нуклонами діють короткодіючі сили притягання – ядерні сили. Кількість протонів у ядрі позначається Z і збігається з порядковим номером елемента в таблиці Менделєєва. Заряд ядра дорівнює Ze. Кількість нейтронів у ядрі позначається N. Загальна кількість нейтронів і протонів у ядрі позначається А і називається масовим числом A=Z+N.
Атомні
ядра позначають символами. Якщо Х
відповідає символу атома хімічного
елемента в періодичній системі
Менделєєва, то символ ядра цього атома
має вигляд ![]() .
.
Наприклад, ![]() -
ядро атома водню,
-
ядро атома водню, ![]() -
ядро атома гелію. Атоми, які мають
однаковий заряд ядра, але різну масу,
називаються ізотопами.
Ізотопи ядра хімічного елемента мають
однакове число протонів, але різне
число нейтронів у складі ядра. Всі
ізотопи одного і того самого елемента
мають однакові хімічні властивості,
але можуть відрізнятись радіоактивністю.
Наприклад:
-
ядро атома гелію. Атоми, які мають
однаковий заряд ядра, але різну масу,
називаються ізотопами.
Ізотопи ядра хімічного елемента мають
однакове число протонів, але різне
число нейтронів у складі ядра. Всі
ізотопи одного і того самого елемента
мають однакові хімічні властивості,
але можуть відрізнятись радіоактивністю.
Наприклад: ![]() -
дейтерій і
-
дейтерій і ![]() -
тритій є ізотопами водню (тритій
радіоактивний).
-
тритій є ізотопами водню (тритій
радіоактивний).
Теорія Бора-напівкласична теорія будови атома в основі якої лежить 2 постулати:
Первый постулат Бора (постулат стационарных состояний): в атоме существуют стационарные (не изменяющиеся со временем) состояния, в которых он не излучает энергии. Втором постулат Бора (правило частот): при переходе электрона с одной стационарной орбиты на другую излучается (поглощается) один фотон с энергией
![]()
Рассмотрим
сейчас решение уравнения Шрёдингера
для атома водорода. Так как потенциальная
функция электрона в атоме водорода
имеет вид ![]() гдеe —
заряд электрона (и протона), r — радиус-вектор,
то уравнение
Шрёдингера запишется
следующим образом:
гдеe —
заряд электрона (и протона), r — радиус-вектор,
то уравнение
Шрёдингера запишется
следующим образом:
![]()
Здесь ψ — волновая
функция электрона
в системе отсчёта протона, m —
масса электрона, ![]() — постоянная
Планка, E —
полная энергия электрона,
— постоянная
Планка, E —
полная энергия электрона,
Спін (англ. spin — веретено) — фундаментальна характеристика частинки (наприклад атомного ядра чи елементарної частки), яка в деякому відношенні аналогічна «власному моменту імпульсу частинки».
Спін може набувати лише певні (квантовані) значення:
цілі: 0,1,2,3 ...
напівцілі: 1/2, 3/2, ...
Спін є важливою характеристикою елементарних часток.
При изучении излучения ученым удалось установить общие закономерности в характере спектров и найти ряд эмпирических законов, которым они подчиняются. Было установлено, что спектральные линии всех элементов можно разбить на ряд серий.
Спектр атома водорода
6.4 Если тождественные частицы имеют одинаковые квантовые числа, то их волновая функция симметрична относительно перестановки частиц. Отсюда следует, что два одинаковых фермиона, входящих в одну систему, не могут находиться в одинаковых состояниях, так как для фермионов волновая функция должна быть антисимметричной. Обобщая опытные данные, В. Паули сформулировал принцип, согласно которому системы фермионов встречаются в природе только в состояниях, описываемых антисимметричными волновыми функциями (квантово-механическая формулировка принципа Паули).
Из этого положения вытекает более простая формулировка принципа Паули, которая и была введена им в квантовую теорию (1925) еще до построения квантовой механики: в системе одинаковых фермионов любые два из них не могут одновременно находиться в одном и том же состоянии. Отметим, что число однотипных бозонов, находящихся в одном и том же состоянии, не лимитируется.
Многоэлектронные атомы. Для атомов, содержащих более одного валентного электрона, уравнение Шрёдингера может быть решено лишь приближенно. В приближении центрального поля предполагается, что каждый электрон движется в центрально-симметричном поле, создаваемом ядром и другими электронами.
ПЕРИОДИЧЕСКАЯ СИСТЕМА ЭЛЕМЕНТОВ представляет собой классификацию химических элементов в соответствии с периодическим законом, устанавливающим периодическое изменение свойств химических элементов по мере увеличения их атомной массы, связанного с увеличением заряда ядра их атомов; поэтому заряд ядра атома совпадает с порядковым номером элемента в периодической системе и называется атомнымномером элемента.. Физические и химические свойства (агрегатное состояние, твердость, цвет, валентность, ионизация, стабильность, металличность или неметалличность и т.д.) можно предсказывать для элемента на основании периодической таблицы. Для цього необхідно користуватися такими правилами:
· заповнювати електронні шари електронами необхідно від першого шару до наступних згідно з порядком послаблення їх притяжіння до ядра;
· заповнювати орбіталі електронами необхідно також у порядку послаблення їх зв’язку з ядром: спочатку необхідно заповнити sорбіталі, потім p орбіталі, а потім d орбіталі;
· на кожній з орбіталей можна розмістити лише два електрони;
· на кожній із орбіталей спочатку міститься по одному електрону, а потім, якщо число електронів перевищує кількість орбіталей, розміщують по другому електрону, при цьому утворюються електронні пари.
6.5 При достаточно большой энергии бомбардирующих анод электронов на фоне сплошного спектра появляются отдельные резкие линии — линейчатый спектр, определяемый материалом анода и называемый характеристическим рентгеновским спектром (излучением).
Квантовая электроника — область физики, изучающая методы усиления и генерации электромагнитного излучения на основе явления вынужденного излучения в неравновесныхквантовых системах, а также свойств получаемых таким образом усилителей и генераторов и их применения.
7.1. Склад, будова та характеристики атомних ядер. Основні властивості ядерних сил, піони. Моделі ядер.
Ко времени открытия атомного ядра (Резерфорд,1911) были известны только две
элементарные частицы – протон и электрон. Однако при использовании этой модели появились трудности, известные как азотная катастрофа. По протонно-электронной модели, ядро азота должно было содержать 14 протонов и 7 электронов. Спин всех этих частиц равен ½, поэтому спин всего атома должен быть полуцелым. Ядра с одинаковыми Z, но разными A, называются изотопами. Размер ядра порядка 10-15 м.
Для таких малых величин введено обозначение 1 Ферми = 1 Ф = 10-15 м.
Взаимодействие между нуклонами в ядре получило название сильного взаимодействия.
Отличительными особенностями ядерных сил являются следующие:
1) Ядерные силы короткодействующие. Радиус их действия ограничивается областью
расстояний между нуклонами порядка 10-15 м. На меньших расстояниях притяжение
сменяется отталкиванием.
2) Ядерные силы не зависят от заряда нуклона.
3) Ядерные силы зависят от взаимной ориентации спинов нуклонов.
4) Ядерные силы не являются центральными.
5) Ядерные силы обладают свойством насыщения. Каждый нуклон в ядре
взаимодействует с определенным числом нуклонов.
