
- •Буферные растворы
- •2.Классификация кислотно-основных буферных систем.
- •3.Расчет pH для буферных систем.
- •3.1.Применение уравнения Гендерсона–Гассельбаха на практике.
- •4. Буферное действие. -
- •4.1.Механизм буферного действия
- •5.Буферная емкость.
- •5.1 Уравнение для расчета буферной емкости растворов сильных кислот и оснований.
- •5.2 Уравнение для расчета буферной емкости слабых кислот и оснований.
- •6.Основные характеристики стандартных буферных растворов
- •7.Экспериментальная часть.
6.Основные характеристики стандартных буферных растворов
Таблица 1
Концентрация рН ∆рH1/2 β,
Буферная система раствора. М при 25 °Сэкв/рН
Тетраоксалат калия 0,05 1,68 0,070 0,186
Кислый виннокислый насыщ. 3,56 0,0270,049
(калий КНС4Н408) при 25 °С
Бифталат калия 0,05 4,01 0,016 0,052
(КНС8Н4О4)
Фосфатный буфер:
(NaH2P04 + Na2HP04) по 0,025 6,860,029 0,080
Бура Na2B407 х10Н20 0,01 9,18 0,020 0,01
Гидроксид кальция насыщ. 12,45 - -
(Са(ОН)2) при 25 °С
Примечание. Для приготовления буферных растворов фосфатов, буры в под оксида кальция должна использоваться дистиллированная вода, освобожденная oт углекислоты. Приготовленные растворы этих веществ должны быть защищены от доступа углекислоты.
Для создания буферности в тех случаях, когда введение в раствор дополнительных веществ — растворимых кислот и оснований, — нежелательно, можно применять твердые полимерные кислоты и основания — иониты .
Для этой цели пригодны слабокислотные катиониты в Н+-форме или слабоосновные аниониты в OH-форме. В более широком интервале рН проявляют буферность полифункциональные иониты, содержащие отличающиеся по кислотности (основности) активные группы. Полифункциональные иониты можно применять подобно жидким универсальным буферным системам.
В настоящее время промышленность выпускает сухие «стандарт-титры» для приготовления стандартных буферных растворов.
7.Экспериментальная часть.
1. Построили буферную кривую, т.е. зависимости рН раствора от соотношения кислоты и ее соли в растворе.(соотношения основания и ее соли в растворе).Для этого приготовили 3 буферных раствора: ацетатный, аммиачный и фосфатный буферные системы. Сначала работали с ацетатной буферной системой. Для этого в девяти химических стаканах, вместимостью 50 мл, приготовили по 30 мл ацетатные буферные растворы различного состава . Значение рН для каждой смеси определили на приборе . Далее вычислили рН по формуле Гендерсона - Гассельбаха:
рН = рКкисл + lg(CcолиVсоли)-lg(CкислVкисл),
где рКкисл= -lgКкисл ; Ккисл - константа диссоциации кислоты; Ссоли и Скисл - соответственно молярные концентрации эквивалентов соли и кислоты, моль/л; Vсоли и Vкисл - объем растворов соли и кислоты, мл.
Составы ацетатных буферных растворов и рН
пробирка |
0,1М СН3СООН |
Номер |
Состав буферного раствора мл |
Значение рН |
Табличное |
1 |
27 |
3 |
3,92 |
3,79 |
3,72 |
2 |
24 |
6 |
4,25 |
4,14 |
4,05 |
3 |
21 |
9 |
4,47 |
4,37 |
4,27 |
4 |
18 |
12 |
4,64 |
4,56 |
4,45 |
5 |
15 |
15 |
4,82 |
4,74 |
4,63 |
6 |
12 |
18 |
4,99 |
4,92 |
4,80 |
7 |
9 |
21 |
5,19 |
5,10 |
4,99 |
8 |
6 |
24 |
5,42 |
5,34 |
5,23 |
9 |
3 |
27 |
5,76 |
5,69 |
5,57 |
Потом в девяти химических стакана приготовили по 30 мл аммиачные буферные растворы. На рН-метре измерили значения рН для каждой смеси. Вычислили рН по формуле:
рН = 14 - рКосн – lg с (соль)/с (основание)
Составы аммиачных буферных растворов и рН
-
Номер
Состав буферного раствора мл
Значение рН
пробирка
0,1М
NH4OH
0,1М
NH4Cl
измеренное
вычисленное
табличное
1
27
3
9,91
10,2
10,28
2
24
6
9,58
9,85
9,95
3
21
9
9,36
9,61
9,73
4
18
12
9,18
9,43
9,55
5
15
15
8,98
9,25
9,37
6
12
18
8,83
9,07
9,20
7
9
21
8,63
8,88
9,01
8
6
24
8,40
8,65
8,77
9
3
27
8,06
8,3
8,43
Далее приготовили в девяти химических стаканах, вместимостью 50 мл, по 30 мл фосфатные буферные растворы.
Составы фосфатных буферных растворов и рН
-
Номер
Состав буферного раствора мл
Значение рН
пробирка
0,05М
NаH2PO4
0,025М
Na2HPO4
измеренное
вычисленное
табличное
1
27
3
6,08
5,94
5,91
2
24
6
6,42
6,29
6,24
3
21
9
6,60
6,53
6,47
4
18
12
6,78
6,72
6,64
5
15
15
6,92
6,9
6,81
6
12
18
7,11
7,08
6,98
7
9
21
7,31
7,26
7,17
8
6
24
7,50
7,50
7,38
9
3
27
7,76
7,74
7,73
2.Провели исследование зависимости рН буферного раствора от количества добавленной кислоты и основания. Сначала исследовали ацетатную буферную систему. Для этого в один из буферных растворов (мы взяли пятый раствор, где соотношения кислоты и соли составляет 15:15) добавляли порциями по 0,5 мл раствор соляной кислоты концентрации 0,1 моль/л до тех пор, пока рН раствора не изменится на единицу. После добавления каждой порции раствора кислоты определяли рН на рН-метре. Данные заносили в таблицу.
Объем доб-ой кислоты и основания |
рН при доб-ии кислоты |
рН при доб-ии основания |
|
Vк, мл |
Vосн, мл |
||
0,5 |
0,5 |
4,82 |
4,81 |
1 |
1 |
4,78 |
4,91 |
1,5 |
1,5 |
4,74 |
4,95 |
2 |
2 |
4,70 |
4,98 |
2,5 |
2,5 |
4,67 |
5,03 |
3 |
3 |
4,64 |
5,07 |
3,5 |
3,5 |
4,60 |
5,11 |
4 |
4 |
4,56 |
5,15 |
4,5 |
4,5 |
4,54 |
5,20 |
5 |
5 |
4,48 |
5,24 |
5,5 |
5,5 |
4,45 |
5,30 |
6 |
6 |
4,41 |
5,36 |
6,5 |
6,5 |
4,37 |
5,40 |
7 |
7 |
4,33 |
5,48 |
7,5 |
7,5 |
4,30 |
5,52 |
8 |
8 |
4,25 |
5,59 |
8,5 |
8,5 |
4,20 |
5,69 |
9 |
9 |
4,14 |
5,80 |
9,5 |
|
4,08 |
|
10 |
|
4,03 |
|
10,5 |
|
3,96 |
|
11 |
|
3,87 |
|
11,5 |
|
3,78 |
|
Используя полученные данные, аналитически вычисили значение буферной емкости по кислоте Вкисл по формуле:
Вк=Ск Vк /Vб∆ рН=0,1х11,5/ 30 (4,82-3,78)=0,037
где Ск- молярная концентрация эквивалента кислоты, моль/л; Vк - объем раствора кислоты, мл; Vб - объем буферного раствора,
мл; рН - изменение значения рН.
Буферную емкость растворов определяют также графически
по тангенсу угла наклона зависимости рН=f (Vк), tg а = ∆рН/Vк
Аналогичное исследование провели для нахождения значения буферной емкости по основанию Восн. В заданный буферный раствор добавляли сильное основание (NaOH) концентрации 0,1 моль/л.
Значение буферной емкостипо основанию вычислилитак же,как и для определения Вк, поаналогичной формуле:
Восн=Сосн Vосн /Vб ∆рН=0,1х9/ 30(5,81-4,81)=0,03
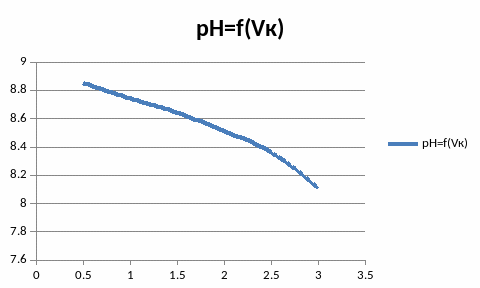
Далее провели исследование зависимости рН буферного раствора от количества добавленной кислоты и основания для аммиачной буферной системы.
Объем доб-ой кислоты и основания |
рН при доб-ии кислоты |
рН при доб-ии основания |
|
Vк, мл |
Vосн, мл |
||
0,5 |
0,5 |
8,85 |
9,01 |
1 |
1 |
8,74 |
9,09 |
1,5 |
1,5 |
8,64 |
9,14 |
2 |
2 |
8,51 |
9,21 |
2,5 |
2,5 |
8,36 |
9,26 |
3 |
3 |
8,11 |
9,31 |
3,5 |
3,5 |
|
9,35 |
4 |
4 |
|
9,39 |
4,5 |
4,5 |
|
9,43 |
5 |
5 |
|
9,49 |
5,5 |
5,5 |
|
9,51 |
6 |
6 |
|
9,55 |
6,5 |
6,5 |
|
9,59 |
7 |
7 |
4,33 |
9,61 |
7,5 |
7,5 |
4,30 |
9,66 |
8 |
8 |
4,25 |
9,70 |
8,5 |
8,5 |
4,20 |
9,73 |
9 |
9 |
4,14 |
9,77 |
9,5 |
|
4,08 |
9,80 |
10 |
|
4,03 |
9,82 |
10,5 |
|
3,96 |
9,89 |
11 |
|
3,87 |
9,93 |
11,5 |
|
3,78 |
9,97 |
12 |
|
|
10,01 |
12,5 |
|
|
10,07 |
13 |
|
|
10,11 |
Вк=Ск Vк /Vб∆ рН=0,1х3/30x0,74=0,014
Восн=Сосн Vосн /Vб ∆рН=0,1x13/30(10,11-9,01)=0,039
Далее провели исследование зависимости рН буферного раствора от количества добавленной кислоты и основания для фосфатной буферной системы.
Объем доб-ой кислоты и основания |
рН при доб-ии кислоты |
рН при доб-ии основания |
|
Vк, мл |
Vосн, мл |
||
0,5 |
0,5 |
6,90 |
7,05 |
1 |
1 |
6,82 |
7.10 |
1,5 |
1,5 |
6,79 |
7,05 |
2 |
2 |
6,75 |
7,08 |
2,5 |
2,5 |
6,71 |
7,12 |
3 |
3 |
6,67 |
7,15 |
3,5 |
3,5 |
6,62 |
7,20 |
4 |
4 |
6,60 |
7,24 |
4,5 |
4,5 |
6,55 |
7,28 |
5 |
5 |
6,49 |
7,33 |
5,5 |
5,5 |
6,47 |
7,38 |
6 |
6 |
6,40 |
7,42 |
6,5 |
6,5 |
6,35 |
7,49 |
7 |
7 |
6,15 |
7,52 |
7,5 |
7,5 |
6,18 |
7,60 |
8 |
8 |
6,17 |
7,67 |
8,5 |
8,5 |
6,08 |
7,75 |
9 |
9 |
5,99 |
7,92 |
9,5 |
|
5,86 |
|
Вк=Ск Vк /Vб∆ рН=0,1х9,5/30x (6,90-5,86)=0,03
Восн=Сосн Vосн /Vб ∆рН=0,1х9/ 30 (7,92-7,05)=0,03
3.Графики зависимостей рН буферных растворов от количества добавленной сильной кислоты и основания.
1)Ацетатный буферный раствор.
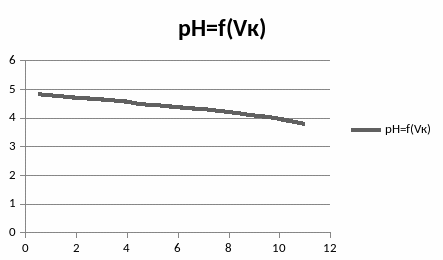
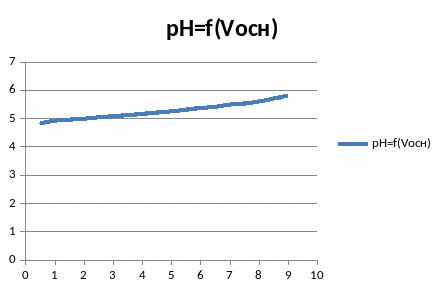
2)Фосфатный буферный раствор.

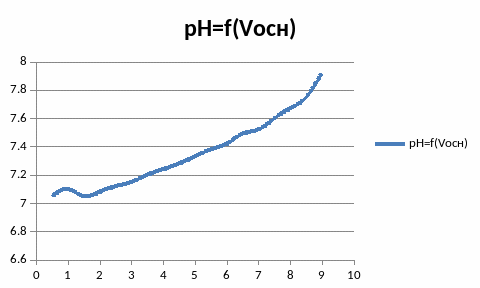
3)Аммиачный буферный раствор.
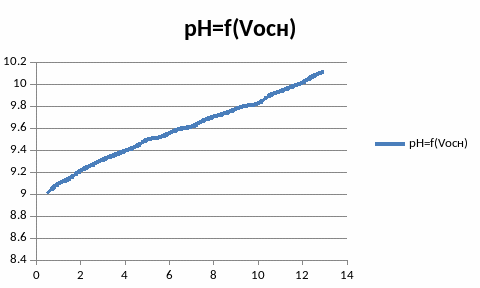
4.Построение буферных кривых,т.е зависимости рН раствора от соотношения кислоты и её соли в растворе.
а)для ацетатного буферного раствора.
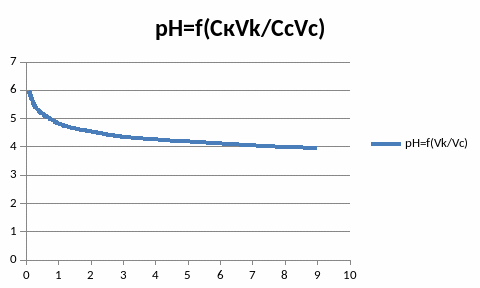
б)для фосфатного буферного раствора

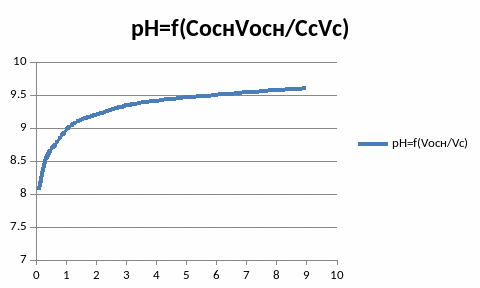
в)для аммиачного буферного раствора
Вывод.
Буферные растворы играют важную роль во многих технологических процессах. Они используются, например, при электрохимическом нанесении защитных покрытий, в производстве красителей, фотоматериалов и кожи. Кроме того, буферные растворы широко используются в химическом анализе и для калибровки рН-метров.
Исследовали свойства буферных растворов методом рН-метрии. Рассмотрели влияние кислоты и основания. Построили буферные кривые, т.е зависимости рН раствора от соотношения кислоты и ее соли в растворе. Построили графики зависимостей рН буферных растворов от количества добавленной кислоты и основания. Рассчитали буферную емкость по кислоте и основания.
Список использованной литературы:
Никольский, Б.П.- Физическая химия.- Ленинград, 1987.- 599-606 стр.
Кольцов, Н.И, Верхунов, С.М, Андреева Э.В, Кузьмин М.В.- Физическаяхимия. Электрохимия(Мет.указания к лаборат. Работам).- Ч.,2004.-49-57 стр.
С.М. Кочергин, Г.А. Добреньков, В.Н. Никулин и др. Краткий курс физической химии.- М,1980.-233-239 стр.
Хмельницкий Р.А. Физическая и коллоидная химия. – М.: Высшая школа, 1988.-345-348 стр.
Балезин С.А., Ерофеев Б.В., Подобаев Н.И. Основы физической и коллоидной химии. – М.: Просвещение, 1975.-278-296 стр.
Болдырев А.И. Физическая и коллоидная химия. – М.: Высшая школа, 1983.- 401-412 стр.
Кузнецов В.В., Усть-Качинцев В.К. Физическая и коллоидная химия. – М.: Высшая школа, 1976.- 194-198 стр.
