
- •Молекулярная физика
- •1. Тепловое движение молекул. Межмолекулярное взаимодействие. Агрегатные состояния вещества. Идеальный газ.
- •2. Температура и внутренняя энергия.
- •4. Давление. Основное уравнение мкт.
- •5. Идеальный газ во внешнем поле. Барометрическая формула. Распределение Больцмана.
- •7. Теплоемкость идеального газа. Отношение Ср/Сv.
- •8. Адиабатический процесс. Уравнение адиабаты. Работа при адиабатическом процессе.
- •9. Реальные газы. Изотерма Ван-дер-Ваальса. Критическое состояние газа.
- •10. Первое начало термодинамики.
- •11. Циклические процессы. Идеальный цикл Карно. Второе начало термодинамики.
- •12. Физический смысл энтропии. Энтропия и вероятность.
- •13. Явление переноса. Длина свободного пробега. Диффузия. Теплопроводность. Вязкость.
4. Давление. Основное уравнение мкт.
Давление (P) — физическая величина, характеризующая состояние сплошной среды и численно равная силе F, действующей на единицу площади S поверхности перпендикулярно этой поверхности. Давление является интенсивной физической величиной. Давление в системе СИ измеряется в паскалях.
Молекулярно-кинетическая теория – МКТ.
![]() , где k является
постоянной Больцмана (отношение
Универсальной газовой постоянной R к
числу Авогадро NA), а i — число степеней
свободы молекул.
, где k является
постоянной Больцмана (отношение
Универсальной газовой постоянной R к
числу Авогадро NA), а i — число степеней
свободы молекул.
Основное уравнение МКТ связывает макроскопические параметры (давление, объём, температура) газовой системы с микроскопическими (масса молекул, средняя скорость их движения).
5. Идеальный газ во внешнем поле. Барометрическая формула. Распределение Больцмана.
Барометрическая формула — зависимость давления или плотности газа от высоты в поле тяжести. Для идеального газа, имеющего постоянную температуру T и находящегося в однородном поле тяжести (во всех точках его объёма ускорение свободного падения g одинаково), барометрическая формула имеет следующий вид:
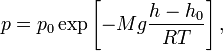 где
p — давление газа в слое, расположенном
на высоте h, p0 — давление на нулевом
уровне (h = h0), M — молярная масса газа, R
— газовая постоянная, T — абсолютная
температура.
где
p — давление газа в слое, расположенном
на высоте h, p0 — давление на нулевом
уровне (h = h0), M — молярная масса газа, R
— газовая постоянная, T — абсолютная
температура.
Распределение
Больцмана — распределение вероятностей
различных энергетических состояний
идеальной термодинамической системы
(идеальный газ атомов или молекул) в
условиях термодинамического равновесия.
Согласно распределению Больцмана
среднее число частиц с полной энергией
![]() равно
равно
![]()
7. Теплоемкость идеального газа. Отношение Ср/Сv.
Теплоемкость идеального газа — это отношение тепла, сообщенного газу, к изменению температуры δТ, которое при этом произошло.
![]()
Сv- изохорический процесс, протекающий при постоянном обьеме системы, V=const.
Cv=(DQ/vdT)по v= 1/v* dU/dT= i/2*R
Cp – изобарический процесс, протекающий при постоянном давлении системы, p=const.
Сp=dQ/vdT=dU/vdT+dA/vdT=Cv+dA/vdT
Используя уравнение состояния идеального газа:
pv=vRT, можно показать, что для одного моля газа dA/vdT=R. Поэтому уравнение Cp=… можно переписать в виде формулы Майера: Cp=Cv+R, тогда разделив Cp на Сv, получим:
γ=Сp/Cv=i+2/i.
8. Адиабатический процесс. Уравнение адиабаты. Работа при адиабатическом процессе.
Адиабатический процесс - это процесс, протекающий без теплообмена системы с окружающей средой, dQ = 0. На практике адиабатическими процессами являются те процессы, которые протекают очень быстро, и теплообмен с окружающей средой не успевает произойти, или же процессы, протекающие в системах, находящихся в термостате.
Уравнение
адиабаты:
![]() ,
γ=Сp/Cv
– показатель адиабаты.
,
γ=Сp/Cv
– показатель адиабаты.
9. Реальные газы. Изотерма Ван-дер-Ваальса. Критическое состояние газа.
Реальный газ — газ, который не описывается уравнением состояния идеального газа Клапейрона — Менделеева.
Зависимости между его параметрами показывают, что молекулы в реальном газе взаимодействуют между собой и занимают определенный объем.
Уравнение состояния газа Ван-дер-Ваальса — уравнение, связывающее основные термодинамические величины в модели газа Ван-дер-Ваальса.
Термическим уравнением состояния (или, часто, просто уравнением состояния) называется связь между давлением, объёмом и температурой.
Для одного моля газа Ван-дер-Ваальса оно имеет вид:
![]() где
где
p — давление,
V — молярный объём,
T — абсолютная температура,
R — универсальная газовая постоянная.
Для ν молей газа Ван-дер-Ваальса уравнение состояния выглядит так:
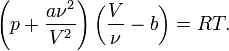 ,
где V — объём.
,
где V — объём.
