
- •Глава 1. Гипертоническая болезнь (эссенциальная гипертензия)
- •Глава 2. Стенокардия......................................................................................................................48
- •2.4.1.3. Ингибиторы ангиотензинпревращающего фермента...............................................................71
- •Глава 3 Инфаркт миокарда ........................................................................................................88
- •Глава 4. Осложнения инфаркта миокарда ........................................................................136
- •Глава 5. Нрс ……………………………………………………………...............................157
- •Глава 6. Недостаточность кровообращения ......................................................................230
- •7.4. Аортальная недостаточность...........................................................................................................267
- •Глава 1 Гипертоническая болезнь (эссенциальная гипертензия) и симптоматические гипертензии
- •1.1. Классификация гипертонической болезни
- •I стадия II стадия III стадия
- •1.2. Патогенез гипертонической болезни
- •2. Факторы, связанные с образом жизни:
- •1.3. Клиническая картина и особенность течения гипертонической болезни
- •1.4.1. Электрокардиографические признаки гипертрофи левого желудочка
- •1.4.2. Рентгеноскопия и рентгенография грудной клетки
- •1.4.3. Эхокардиографические критерии гипертрофии левого желудочка
- •1.4.4. Оценка состояния глазного дна
- •1.4.5. Изменение почек при гипертонической болезни
- •1.5. Симптоматические артериальные гипертензии
- •1.5.1. Почечные артериальные гипертензии
- •1.5.2. Вазоренальная артериальная гипертензия
- •1.5.2.1. Атеросклероз почечных артерий
- •1.5.2.2. Фибромускулярная дисплазия почечный артерий
- •1.5.3. Болезнь Такаясу
- •1.5.4. Эндокринные артериальные гипертензии
- •1.5.4.1. Акромегалия
- •1.5.4.2. Болезнь и синдром Иценко-Кушинга
- •1.5.4.3. Феохромоцитома
- •1.5.4.4. Синдром Конна
- •1.5.4.5. Диффузный или диффузно-узловой токсический зоб
- •1.5.4.6. Гиперпаратиреоз
- •1.5.4.7. Климактерическая артериальная гипертензия
- •1.5.4.8. Артериальная гипертензия при использовании гормональных контрацептивов
- •1.5.5. Церебральные артериальные гипертензии
- •1.5.6.. Гемодинамические артериальные гипертензии
- •1.5.6.1. Склеротическая систолическая артериальная гипертензия
- •1.5.6.2. Коарктация аорты
- •1.5.6.3. Аортиты
- •1.5.6.4. Аортальная недостаточность
- •1.5.6.5. Атриовентрикулярная блокада III степени
- •1.5.6.7. Застойная артериальная гипертензия при сердечной недостаточности
- •1.5.7. Артериальная гипертензия лекарственного генеза
- •1.6. Принципы дифференциальной диагностики симптоматических гипертензий
- •Лечение гипертонической болезни
- •1 Изменение образа жизни в лечении гипертонической болезни:
- •1.7.1. Характеристика гипотензивных средств
- •1.7.1.1. Бета-адреноблокаторы
- •1.7.2. Альфа-1-адреноблокаторы
- •1.7.3. Антагонисты кальция
- •1.7.4. Диуретики
- •1.7.5. Ингибиторы ангиотензинпревращающего фермента
- •1.7.6. Монотерапия гипертонической болезни
- •1.7.7. Комбинированное использование антигипертензивных препаратов
- •1.7.8. Лечение изолированной систолической артериальной гипертензии у пожилых больных
- •1.7.9. Гипертензивные (гипертонические) кризы и их лечение
- •Глава 2 Стенокардия
- •2.1. Классификация и клинические формы стенокардии
- •2.1.1. Стабильная стенокардия
- •2.1.2. Нестабильная стенокардия
- •2.1.3. Острая коронарная недостаточность
- •2.2. Диагностика стенокардии
- •2.2.1. Диагностика стенокардии с помощью нагрузочных проб
- •2.2.1.1. Пробы, проводимые при отсутствии изменений конечной части желудочкового комплекса – зубца т и сегмента s-t
- •2.2.1.2. Функциональные нагрузочные пробы при наличии изменения конечного комплекса qrs-t (подъем или депрессия сегмента s-t или инверсия зубца т)
- •2.3. Дифференция диагностика стенокардии (кардиалгий)
- •II группа. Основной клинический синдром – постоянные боли в области грудной клетки, длительностью от нескольких суток до нескольких недель или месяцев, не купирующиеся приемом нитроглицерина.
- •III группа. Основной клинический синдром – боли в грудной клетке, появляющиеся при физической нагрузке, стрессе, в покое длительностью от нескольких минут до 1 ч, уменьшающиеся в покое.
- •IVб подгруппа. Основной клинический синдром – развитие болей в грудной клетке при приеме пищи, уменьшающихся в покое, не купирующихся приемом нитроглицерина.
- •2.4. Лечение больных стенокардией
- •2.4.1 Антиангинальные препараты
- •2.4.1.1. Нитросоединения (нитраты)
- •2.4.1.2. Бета-адреноблокаторы и антагонисты кальция
- •2.4.1.3. Ингибиторы ангиотензинпревращающего фермента
- •2.4.1.4. Антиагреганты
- •2.4.2. Выбор препаратов при лечении стенокардии
- •2.4.3. Оперативное лечение больных стенокардией
- •2.4.4. Использование низкоинтенсивного лазерного излучения в терапии стенокардии
- •Глава 3 Инфаркт миокарда
- •3.1. Этиология инфаркта миокарда
- •3.2. Диагностика инфаркта миокарда
- •3.2.1. Электрокардиографическая диагностика инфаркта миокарда
- •3.2.1.1. Крупноочаговый инфаркт миокарда
- •3.2.1.2. Мелкоочаговый инфаркт миокарда
- •3.2.1.3. Атипичные формы первого инфаркта миокарда
- •3.2.1.4. Изменения электрокардиограммы при повторных инфарктах миокарда
- •3.2.2. Биохимическая диагностика инфаркта миокарда
- •3.2.3. Сцинтиграфия миокарда
- •3.2.4. Эхокардиографическая диагностика
- •3.3. Дифференциальная диагностика инфаркта миокарда
- •3.4. Неосложненный инфаркт миокарда
- •3.4.1. Резорбционно-некротический синдром при инфаркте миокарда
- •3.4.2. Лечение неосложненного инфаркта миокарда
- •R Комментарии к лечению больных неосложненным инфарктом миокарда
- •R Наблюдение за больными инфарктом миокарда
- •R Уровень активности больных инфарктом миокарда
- • Анальгезия и использование антидепрессантов при инфаркте миокарда
- •R Магнезия (MgS04 25% раствор)
- •3.5. Инфаркт правого желудочка и его дисфункция
- •3.6. Подготовка к выписке больных инфарктом миокарда из стационара
- •3.7. Вторичная профилактика у больных инфарктом миокарда после выписки из стационара
- •3.8. Длительное ведение больных инфарктом миокарда
- •Глава 4 Осложнения инфаркта миокарда
- •4.1. Осложнения инфаркта миокарда
- •4.1.2. Кардиогенный шок.
- •4.1.3. Сердечная астма и отек легких.
- •4.1.4. Нарушения сердечного ритма и проводимости
- •4.1.4.1. Тахисистолические нарушения сердечного ритма
- •1 Лечение фибрилляции и трепетания предсердий, пароксизмальной наджелудочковой тахикардии
- •1 Желудочковая тахикардия и фибрилляция желудочков.
- •4.1.4.2. Брадиаритмии и блокады сердца
- •4.1.5. Разрывы миокарда
- •4.1.5.1. Острая митральная регургитация
- •4.1.5.2. Постинфарктный дефект перегородки
- •4.1.5.3. Разрыв свободной стенки левого желудочка
- •4.1.6. Аневризма левого желудочка
- •4.1.7. Тромбоэмболия легочной артерии
- •4.1.8. Перикардит
- •2 Лечение перикардита при инфаркте миокарда.
- •4.1.9. Острая язва желудка
- •4.1.10. Атония мочевого пузыря
- •4.1.11. Парез желудочно-кишечного тракта
- •4.1.12. Синдром Дресслера (постинфарктный синдром)
- •4.1.13. Хроническая недостаточность кровообращения
- •4.1.14. Показания для экстренного проведения аортокоронарного шунтирования при инфаркте миокарда
- •4.1.15. Рецидивирующий инфаркт миокарда
- •Глава 5 Нарушения сердечного ритма и проводимости: диагностика и лечение
- •5.1. Классификация антиаритмических средств и характеристика основных противоаритмических препаратов
- •5.2. Экстрасистолия
- •5.2.1. Электрокардиографическая диагностика желудочковой и наджелудочковой экстрасистолии
- •5.2.2. Лечение и профилактика наджелудочковой и желудочковой экстрасистолии в зависимости от механизмов их развития
- •5.2.2.1. Оценка механизмов развития экстрасистолии
- •5.3. Диагностика и лечение пароксизмальных тахикардий
- •5.3.1. Диагностика наджелудочковых тахикардий
- •5.3.1.1. Электрокардиографические критерии однофокусных предсердных тахикардий
- •5.3.1.2. Электрокардиографические критерии постоянно-возвратной или экстрасистолической формы предсердной тахикардии (форма Gallaverdin)
- •5.3.1.3. Электрокардиографические критерии многофокусной (политопной) или хаотической предсердной тахикардии
- •5.3.1.4. Электрокардиографические критерии реципрокных атриовентрикулярных тахикардий
- •5.3.2. Электрокардиографические признаки желудочковой тахикардии
- •5.3.3.1. Лечение атриовентрикулярных, очаговых (реципрокных) предсердных тахикардий
- •5.3.3.3. Лечение многофокусной, политопной или хаотической пароксизмальной предсердной тахикардии
- •5.3.4. Лечение желудочковых тахикардий
- •5.3.4.1. Лечение экстрасистолической или возвратной формы пароксизмальной желудочковой тахикардии
- •5.4. Фибрилляция (мерцание) и трепетание предсердий
- •5.4.1. Электрокардиографическая диагностика фибрилляции и трепетания предсердий
- •5.4.1.1. Электрокардиографическая диагностика трепетания предсердий
- •5.4.1.2. Электрокардиографические диагностические критерии фибрилляции (мерцания) предсердий
- •5.4.2. Классификация мерцания и трепетания предсердий
- •5.4.3. Лечение и профилактика пароксизмов фибрилляции и трепетания предсердий
- •5.4.3.1. Лечение и профилактика пароксизмов трепетания предсердий
- •I тип II тип эит (кардиоверсия) 150-400 j
- •5.4.3.2. Лечение и профилактика мерцания (фибрилляции) предсердий
- •2. Особенность течения пароксизмов мерцания предсердий:
- •5.5. Использование лазеротерапии для лечения нарушений сердечного ритма
- •5.6. Аритмии, обусловленные нарушением функции проводимости
- •. Алгоритм диагностики брадисистолических форм нарушений сердечного ритма, в том числе характерных для синдрома слабости синуовго узла, представлен на рис. 5.28.
- •5.6.2. Атриовентрикулярная блокада
- •5.6.3. Лечение синдрома слабости синусового узла и атриовентрикулярных блокад
- •5.6.3.1. Электрокардиостимуляция
- •Глава 6
- •6.1. Причины сердечной недостаточности
- •2. Некардиальные:
- •6.2. Патогенез недостаточности кровообращения
- •Митральная регургитация
- •1 Классификация недостаточности кровообращения.
- •Классификация недостаточности кровообращения в.Х. Василенко, н.Д. Стражеско при участии г.Ф. Ланга (1935) с дабавлениями н.М. Мухарлямова (1978).
- •I стадия. Подразделяется на период а и б.
- •6.4. Лечение хронической сердечной недостаточности
- •6.4.1. Фармакотерпия сердечной недостаточности
- •6.4.1.1. Применение ингибиторов ангиотензинпревращающего фермента для лечения сердечной недостаточности
- •6.4.1.2. Применение диуретиков для лечения сердечной недостаточности
- •1 Тактика назначения диуретиков:
- •1 Причины резистентности к диуретикам:
- •Выбор диуретика в зависимости от стадии (функционального класса) сердечной недостаточности.
- •6.4.1.3. Применение b-адреноблокаторов для лечения сердечной недостаточности
- •1 Противопоказания к использованию b-адреноблокаторов при сердечной недостаточности (помимо общих противопоказаний):
- •6.4.1.4. Применение сердечных гликозидов для лечения сердечной недостаточности
- •1 Взаимодействие сердечных гликозидов с другими препаратами:
- •6.4.1.5. Принципы лечения недостаточности кровообращения в зависимости от стадии заболевания
- •1 Принципы лечения недостаточности кровообращения в зависимости от стадии заболевания (Smith j.W. Et al., 1997).
- •2. Диуретики;
- •3. Диуретики;
- •1 Критерии стабильного клинического состояния при недостаточности кровообращении (Stevenson l.W. Et al., 1998)
- •6.4.2. Хирургическое лечение сердечной недостаточности
- •Глава 7 Приобретенные пороки сердца
- •7.1. Митральный стеноз
- •2 Классификация митрального стеноза по а.Н. Бакулеву и е.А. Дамир (1955).
- •Осложнения митрального стеноза
- •7.2. Митральная недостаточность
- •2 Показание к оперативному лечению:
- •7.3. Аортальный стеноз
- •7.4. Аортальная недостаточность
- •Основные клинические симптомы аортальной недостаточности, выявляемые при объективном обследовании:
- •7.5. Трикуспидальные пороки сердца
- •7.5.1. Трикуспидаольный стеноз.
- •7.5.2. Трикуспидальная недостаточность
- •2Этиология трикуспидальной недостаточности.
- •7.6. Дифференциальная диагностика пороков сердца
Анальгезия и использование антидепрессантов при инфаркте миокарда
Боль при инфаркте миокарда является следствием ишемии и повреждения сердечной мышцы в области инфаркт-обусловленной артерии. Поэтому выглядит рациональным использование для уменьшения боли антиишемическое вмешательство, включая реперфузию, кислород, нитраты, -блокаторы и, в определенных ситуациях - интрааортальную контрпульсацию. Эффективная анальгезия, например, внутривенное введение морфина сульфата, должна быть выполнена немедленно при диагностировании инфаркта и ни в коем случае не откладываться в надежде, что будет эффект от антиангинальной терапии.
Наиболее эффективными анальгетиками при инфаркте миокарда являются:
таламонал (сочетание фентанила 0,0025%-2,0 и дроперидола 0,25%-2,0),
морфина сульфат 0,1%-1,0,
промедол 0,1%-1,0,
анальгин 50%-2,0(4,0) с дроперидолом 0,25%-2,0
Примечание: вверху самый сильный, снизу – наиболее слабый анальгетик.
У больных острым инфарктом миокарда обычно выявляется повышенная активность симпатической нервной системы, которая неблагоприятно увеличивает потребность миокарда в кислороде вследствие увеличения частоты сердечных сокращений, повышения артериального давления, сократимости сердечной мышцы, что способствует развитию желудочковых аритмий. Так как эти симптомы нарастают при болях в грудной клетке ишемического характера и беспокойстве, а также повышенной возбудимости, то следует назначать в достаточной дозе вышеуказанные анальгетики (таламонал, морфина сульфат и т.д.), в том числе и для уменьшения ощущений, описываемого больными как надвигающаяся смерть. При неинтенсивных и непродолжительных болях в грудной клетке у больных инфарктом миокарда можно использовать вначале анальгин с дроперидолом, а затем промедол, морфин или таламонал, а при наличии сильного и (или) продолжительного ангинозного синдрома – следует начинать с морфина сульфата или таламонала. Сульфат морфина применяется внутривенно в дозе от 2 до 4 мг каждые 5 мин. и введение этого препарата прекращается при купировании болевого синдрома. Для некоторых больных требуется от 25 до 30 мг для достижения адекватного обезболивания. Из-за боязни индуцирования гипотонии многие врачи ограничивают дозу назначаемого морфина. Важно понимать, что вызванная морфином гипотония преимущественно появляется при снижении объема циркулирующей крови в ортостатическом положении и не представляет угрозы для больных в горизонтальном положении. Поэтому, по-видимому, у больных инфарктом миокарда с тяжелой непрекращающейся болью при применении этого препарата оправдано избегать параллельного назначения других вазодилататоров таких, как нитроглицерин и т.д. (Малая Л.Т. и соавт., 1981, Чазов Е.И., 1992, Rayn B., 1994, 1996, Braunwald E., 1997).
Угнетающий эффект морфина на дыхание требует особого внимания и широкой оценки. У подавляющего большинства пациентов в остром периоде инфаркта миокарда угнетение дыхания не наступает из-за высокого тонуса симпатической нервной системы, тяжелого ангинозного синдрома и легочного застоя. Для уменьшения морфин-индуцированой депрессии дыхания может быть использовано применение 0,4 мг налоксона (антагонист наркотических анальгетиков) внутривенно в течение 3-х минутного интервала до максимальной дозы 0,12 мг.
После прекращения курения у госпитализированных курильщиков могут появиться такие симптомы, как беспокойство, бессонница, депрессия, нарушение концентрации внимания, раздражительность, злость, замедление сердечного ритма. В этих случаях использование антидепрессантов зависит от понимания их фармакодинамических и фармакокинетических свойств. Следует подчеркнуть, что ряд медикаментов, часто используемых в палате интенсивной терапии, такие, как лидокаин, мексилетин, новокаинамид, атропин, циметидин, меперидин, могут индуцировать делирий. В этих случаях наиболее эффективным оказалось использование галоперидола, быстро действующего нейролептика, который показан пациентам с избыточной тревожностью и волнением (Чазов Е.И., 1992, Rayn B., 1996). Следует отметить, что этот препарат редко вызывает гипотонию и не угнетает дыхания. Применение антидепрессантов не является необходимым для всех пациентов. B. Dixon et al (1993), показали, что частота регистрации беспокойства, повышения артериального давления, увеличения частоты сердечных сокращений и ангинозных болей в грудной клетке не отличались у больных, леченных, например, диазепамом в сравнении с плацебо. Наоборот, психологическая поддержка в период госпитального этапа развития заболевания привело к значительному уменьшению беспокойства и депрессии, в том числе в течение 6 месяцев после выписки из стационара. Следует подчеркнуть, что свободные правила посещения больных в палате интенсивной терапии могут быть полезны для пациентов инфарктом миокарда, причем многие рандомизированные исследования не продемонстрировали отрицательного влияния на состояние больных при использовании политики свободных посещений их родственниками.
Тромболитическая терапия
Патофизиология инфаркта миокарда и собственно роль коронарного тромбоза подвергались сомнению вплоть до начала 80-х годов. Поворотным этапом явилось исследование R. DeWood et al. (1980), показавшее полную, преимущественно тромботическую окклюзию инфаркт-зависимой артерии: тромбоз коронарной артерии был выявлен у 87% больных в остром периоде инфаркта миокарда с элевацией сегмента ST, обследованных с помощью корнарографии в течение 4 часов и у 65% - в 12-24 часов от начала заболевания. Развитие коронарного тромбоза во время проведения аортокоронарного шунтирования, а также отсутствие реканализации инфаркт-зависимой артерии при интракоронарном тромблизисе привело к пониманию роли тромбоза при острой коронарной окклюзии. Последующие патологанатомические и ангиоскопические исследования показали следующую концепцию формирования тромба при инфаркте миокарда: трещина интимы неизмененной венечной артерии или разрыв уязвимой атеросклеротической бляшки (липидного пятна) является пусковым механизмом коронарной окклюзии, возникающие как вследствие коронароспазма, так и кровоизлияния в бляшку, что приводит к образованию пристеночного тромбоза, в том числе и на неизмененных венечных артериях (Braunwald E., 1986-1997). Второй предпосылкой, подтверждаемой многоцентровыми исследованиями по тромболитической терапии при инфаркте миокарда, явились данные, полученные на экспериментальной модели инфаркта миокарда и в ранних клинических исследованиях, показавшие, что реперфузия приводит к сохранению жизнеспособного миокарда и способствует улучшению течения этого заболевания как на госпитальном этапе, так и при выписке из стационара. Однако при проведении реокклюзии, включая использование тромболитической терапии, был выявлен прямопропорциональный время-зависимый ее положительный эффект. B. Reiner et al. (1982) показали, что у животных окклюзия коронарных артерий приводит к формированию инфаркта, причем распространение некроза от субэндокарда к субэпикарду начинается через 20 минут, вызывая более 70% трансмуральных некрозов в течение 6 часов после окклюзии (с небольшим добавлением некроза в последующие 24 часа). Восстановление коронарного кровотока в течение 2 ч приводило к реальному сохранению жизнеспособности сердечной мышцы и функциональному восстановлению ишемизированного миокарда, в то время как при реперфузии позже 6 ч жизнеспособный миокард наблюдался преимущественно только в субэндокардильных отделах левого желудочка. Последующие контролированные исследования продемонстрировали ограничение очага инфаркта миокарда, снижение смертности и сохранение функции левого желудочка в тех случаях, когда терапия была начата с первых 6 ч от начала заболевания и вызывала реперфузию.
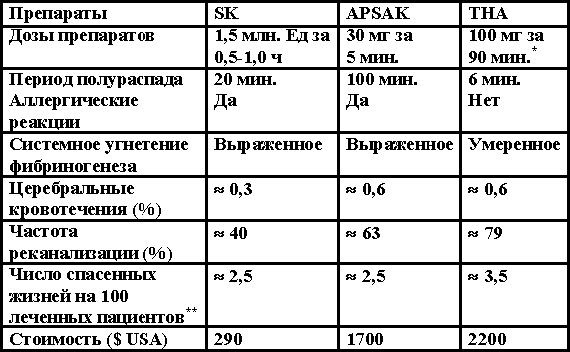
Клиническое применение препаратов, содержащих стрептокиназу, при остром инфаркте миокарда насчитывает около 40 лет. Однако интерес к внутривенной тромболитической терапии появился в середине 80-х годов, когда появилось сообщение об ее эффективности не только при интракоронарном применении, но и при внутривенном введении в первые часы от начала инфаркта миокарда. Кроме того, понимание, что острый коронарный тромбоз является первичным звеном патогенеза в развитии инфаркта миокарда, привело к тому, что для достижения быстрого тромболизиса были синтезированы многочисленные тканевые и плазменные активаторы плазминогена, которые нашли широкое клиническое применение. Следует отметить, что к тромболитическим препаратам, используемым в настоящее время и находящимся на стадии исследования, относят только активаторы плазминогена (тканевого и (или) плазменного). Они все функционируют энзиматически (прямо или опосредованно), конвертируя одноцепочечную молекулу плазминогена в духцепочечную, обладающей фибринолитической активностью, путем расщепления цепи в месте сочленения Аргинин 560 и Валин-561, раскрывая активный энзиматический центр плазмина. Однако имеется много различий между используемыми тромболитиками как в дозе, так и в периоде полураспада, «фибрин-специфичности», частоте реканализации коронарных артерий, риске церебральных кровотечений и стоимости. Некоторые особенности тромболитиков для внутривенного использования (Стрептокиназа и Antistreplase) и тканевого активатора плазминогена Alteplase, представлены в таблице 3.4.
Анализ девяти рандомизированных исследований (с 1988 по 1998 гг.) по применению тромболитической терапии у больных с острым инфарктом миокарда показал, что при использовании вышеуказанных фибринолитиков наблюдалось высоко достоверное (р<0,0001) 18% снижение смертности в течение 35 дней от начала инфаркта миокарда. У больных с элевацией сегмента ST снижение смертности составило, в среднем, на 21%, причем летальность значительно уменьшается и в более поздних сроках после инфаркта миокарда (от 6 месяцев до 4 лет).
Основным показанием для назначения тромболитических препаратов являются больные инфарктом миокарда с элевацией сегмента ST более 0,1 мм от изолинии или с наличием впервые выявленной полной блокады левой ножки пучка Гиса. Однако в ранней стадии инфаркта миокарда тромболизис может проводиться без элевации сегмента ST. Например, при заднем инфаркте миокарде, когда в первые часы развития заболевания может наблюдаться только депрессия сегмента ST в грудных отведениях (V1-V4). Таким образом, прежде чем решение об использовании тромболитической терапии будет принято или отвергнуто, необходима профессиональная интерпритация электрокардиограммы.

Дополнительные факторы, влияющие на решение применять или не использовать тромболитическую терапию, включают время от начала инфаркта миокарда, возраст больных, состояние гемодинамики и наличие сопутствующих заболеваний. Сохранение жизнеспособного миокарда прогрессивно возрастает с ранним тромболизисом, хотя снижение смертности также наблюдается у больных, леченных фибринолитиками в последующие 12 часов от начала заболевания. Следует отметить, что у больных с рецидивирующим болевым синдромом и элевацией сегмента ST может быть получен положительный эффект при применении тромболитической терапии в течение 12-24 часов от начала симптомов заболевания, а также положительный результат тромболизиса может быть получен у больных старше 75 лет, однако в значительно меньшей степени, чем у молодых пациентов. Увеличение возраста повышает риск инсультов при инфаркте миокарда как с применением тромболитической терапии, так и без нее. Высокий риск развития осложнений при использовании фибринолитиков может наблюдаться при наличии следующих условий: женский пол, пожилой возраст (более 70 лет), предшествующий инфаркт миокарда, фибрилляция предсердий, передний инфаркт миокарда, хрипы более чем в одном из трех легочных полей, гипотензия, синусовая тахикардия и сахарный диабет (Julian D., Braunwald E., 1993). Следует подчеркнуть, что только у больных с первым инфарктом миокарда при наличии гипотонии, тахикардии отмечается высокий положительный эффект тромболизиса (Julian D., Braunwald E., 1993, Rayn B., 1994).
Противопоказания и предосторожности для проведения тромболизиса
r Абсолютные противопоказания:
Предшествующий геморрагический инсульт;
Ишемический инсульт или другие цереброваскулярные болезни в течение последнего года;
Известная интракраниальная неоплазма;
Наличие внутреннего кровотечения (за исключением месячных);
Подозрение на расслаивающую аневризму аорты;
Повторное использование стрептокиназы и аntistreplase в течение 2 лет после перенесенного предшествующего инфаркта миокарда из-за высокого титра антител к стрептокиназе.
r Предосторожности и относительные противопоказания:
При наличии тяжелой неконтролируемой гипертензии ( 180/100 мм.рт.ст.);
Наличие в анамнезе других церебральных расстройств, не относящихся к противопоказаниям;
Использование антикоагулянтов в текущий момент; наличие геморрагического диатеза;
Недавняя травма (2-4 недели), включая черепно-мозговую травму или состояние после затяжной реанимации (более 10 мин), а также большой объем оперативного вмешательства (через 4 недели после операции);
Через 2-4 недели после кровотечения любой этиологии;
Для стрептокиназы/антистреплазы: предшествующее назначение (5 дней- 2 года), или наличие аллергических реакций;
Беременность;
Язвенная болезнь в фазе обострения;
Наличие тяжелой артериальной гипертензии.
Стептокиназа и урокиназа применяют для интракоронарного введения, однако в настоящее время этот путь назначения тромболитиков в остром периоде инфаркта миокарда повсеместно практически не используется. Стрептокиназу вводят внутривенно капельно в дозе 250.000 МЕ в течение 30 мин., в затем1 500 000 МЕ внутривенно капельно в течение 30-60 мин. Интракоронарно этот препарат вводят в дозе 250000-300000 МЕ в течение 30-60 мин.
В настоящее время широко известно, что наиболее эффективными фибринолитиками являются стрептокиназа, аntistreplase, аlteplase, duteplase (Чазов Е.И., 1992, Braunwald E., 1993, 1996, 2000, Rayn B., 1996). Крупнейшее исследование ISIS-2 показало, что аспирин комбинированный со стрептокиназой, при лечении в течение 4 часов от наступления симптомов инфаркта миокарда, дополнительно позволяет снизить смертность на 53%. В двух больших исследованиях по уменьшению смертности (GISSI 2/International и ISIS-3), 4-5 недельная смертность при использовании тканевого активатора плазминогена duteplase составила в среднем 8,9%, при применении стрептокиназы - 8.5%,аlteplase -10.3%, аntistreplase - 10.5%). В этих исследованиях дополнительная антитромботическая терапия включала аспирин (160-325 мг в день), подкожно - гепарин (12500 ЕД два раза в день, начиная с 4-12 часов после тромболитической терапии). Внутривенно гепарин не использовался из-за возможности повышения частоты интракраниальных кровотечений и инсультов. В исследованиях с Alteplase, являющимся тканевым активатором плазминогена, был использован ускоренный режим введения этого препарата (этот тромболитик вводился за 90 мин, а не за 3 часа). Ускоренный режим приводит к большей частоте раннего восстановления проходимости без повышения риска кровотечений и он становится наиболее предпочтительным способом введения фибринолитиков (Julian D., Braunwald E., 1993). Положительный эффект ускоренного введения тромболитиков при использовании Alteplase был подтвержден ангиографической подгруппой GUSTO, которая обнаружила разницу в восстановлении ранней проходимости (при введении препарата в течение 90 мин.) среди режимов для Alteplase, стрептокиназа-покожный Гепарин, стрептокиназа-внутривенно гепарин и комбинированный режим применения этих препаратов оказался эффективным в среднем в 81%, 56%, 61%, 73% соответственно. Полученные данные показывают увеличения частоты реперфузити при применении ускоренного режима Alteplase по сравнению с Antistreplase. Другие предлагаемые тромболитические препараты находятся в стадии клинического изучения (проурокиназа, reteplase, staphylokinase, TNK-plasminogen активатор и различные мутантные активаторы плазминогена).
Ранние плацебо-контролируемые исследования по применению тромболитической терапии при инфаркте миокарда пришли к выводу о парадоксальном увеличении смертности в течение первых 24 часов после тромболизиса. Последние исследования (с 1988 по 1996 гг.) подтвердили высокую смертность в первые 24 часа от начала инфаркта миокарда, что это может быть скорее следствием неудачной реперфузии или развитием реперфузионных осложнений (реперфузионные аритмии, расширение очага некроза и т.д.) (Чазов Е.И., 1992, Rayn B., 1996, Braunwald E., 1997).
В последние годы при использовании фибринолитиков в остром периоде инфаркта миокарда было обнаружено, что риск развития реперфузионного синдрома в первые 1-4 ч от начала заболевания составляет 20-30%, в то время как с 4 по 6 ч - 60-80%, а через 6-12 ч - фибринолитики или неэффективны, или при лизировании тромба риск развития реперфузионных осложнений составляет около 90-95% (Чазов Е.И.,1992, Braunwald E., 1989, 1997). Поэтому поиск методов и способов предупреждения реперфузионного синдрома при инфаркте миокарда от 4 до 6 ч от начала его развития представляет актуальную проблему в современной кардиологической практике.
Проведенные нами клинико-экспериментальные исследования показали, что одним из методов предупреждения отрицательного действия тромболитиков, проявляющегося в развитии реперфузионного синдрома, является использование лазерного излучения: внутривенного облучения венозной крови длиной волны 0,63 мкм мощностью 10-15 мВТ и прекардиальной области – длиной волны 0,93 мкм мощностью 20-40 мВТ в дозе 3-5 Дж/см2 (Олесин А.И. и соавт, 1992).
Полученные нами данные показали, что отсутствовали различия в эффективности интравенозного облучения крови длиной волны 632,8 нм и облучения прекардиальной области длиной волны 930,0 нм. Это определяет значительное преимущество последней методики в клинической практике:
Таблица 3.4. Сравнительная оценка тромболитических препаратов.
Примечание: SK – стрептокиназа, APSAC – тканевой и плазменный активатор плазминогена, TPA -тканевой активатор плазминогена (аlteplase, dulteplase); *- 15 мг болюсом, затем 0,75 мг/кг за 30 мин (максимально до 50 мг), затем – 0,5 мг за 60 мин (до максимальной дозы 35 мг); ** - на основании на опубликованных данных, включая исследование GUSTO и принимая во внимание, что 20% артерий проходимы до начала терапии.
простота использования, неинвазивность, что позволит ее применять с первых часов развития инфаркта миокарда, начиная с догоспитального этапа медицинской помощи. Кроме того, как показали ранее проведенные исследования, эффективность применения лазерного излучения в этих диапазонах длин волн обусловлена уменьшением перекисного окисления липидов, улучшением микроциркуляции, повышением белковосинтетической функции кардиомиоцитов пораженных отделов миокарда (Корочкин И.М. и соавт., 1988, Олесин А.И. и соавт., 1992,1994).
В клинике исследования проведены у 65 больных в остро-острейшем периоде инфаркта миокарда. Все больные были распределены на три группы. В I группу вошло 14 больных, которым проведено за 30 минут до введения фибринолитиков в первые 6 ч от начала заболевания (стрептокиназа, стрептодеказа, APSAC) лазерное облучение венозной крови длиной волны 632,8 нм мощностью 10-15 мВТ, во II и III группу было включено по 12 больных инфарктом миокарда в каждой, которым также за 30 минут от начала заболевания до введения фибринолитиков проводили подвергали миокард лазерному излучению длиной волны 0,89 мкм мощностью 10-20 мВТ и 0,93 мкм мощностью 20-30 мВТ в дозе 3-5 Дж/см2 соответственно (Шабров А.В., Олесин А.И., Мажара Ю.П.. Способ предупреждения реперфузионного синдрома в остром периоде инфаркта миокарда. - Патент № 196385). Контрольную группу составили 27 больных инфарктом миокарда с использованием только фибринолитиков. Терапевтическую дозу лазерного излучения длиной волны 0,63 мкм, 0,89 мкм и 0,93 мкм проводили по ранее разработанному нами способу, описанному в главе 2.4.4. «Использование низкоинтенсивного лазерного излучения в терапии стенокардии». Всем больным проводили оценку размера очага инфаркта миокарда до и после реперфузии, а также в динамике лечения этих пациентов по общепринятым методикам с использованием электрокардиографии, эхокардиографии и определения активности кретинкиназы. Кроме того, расчитывался реальный и прогнозируемый размер очага инфаркта миокарда по методу И.В. Иосава и соавт. (1995) и М. Sivester et al. (1994).
Статистическая обработка полученных результатов проводилась на ЭВМ с использованием критерия «t» Стьюдента, х2 и стандартных пакетов программ SPSS ver.8.0.
Результаты исследования представлены в таблице N 3.5. Как видно из таблицы, наибольшее уменьшение размеров очага инфаркта миокарда, частоты развития реперфузионного синдрома и реперфузионных аритмий отмечалось при воздействии на миокард лазерного излучения длиной волны 0,93 мкм в сравнении с лазерным облучением венозной крови длиной волны 0,63 мкм, облучения миокарда длиной волны 0,89 мкм и контрольной группой.
Таблица 3.5. Сравнительная оценка размера очага инфаркта миокарда, реперфузионного синдрома при использовании лазерного излучения до введения фибринолитиков в остром периоде инфарктамиокарда (M m)
Примечание: ИМ – инфаркт миокарда, РС – реперфузионный синдром, РА - реперфузионные аритмии, * - достоверность различия показателей в сравнении с прогнозируемым инфарктом миокарда, о - контрольной группой (при р < 0,05).
Таким образом, наибольший эффект для предупреждения реперфузионного синдрома, уменьшения размеров очага инфаркта миокарда наблюдался при предварительном применении до использования тромболитиков облучения миокарда лазерным излучением длиной волны 0,93 мкм в дозе 3-5 Дж/см2, причем, этот метод может проводиться уже начиная с догоспитального этапа медицинской помощи.
Следует отметить, что в США с 1994 г. по 1995 г. только 37,2% получали реперфузионную терапию (83% - тромболизис, 15,4% - первичную ангиопластику, 1,4% - немедленное аортокоронарное шунтирование) (W.J. Rogers, 1996). Имеющийся опыт предполагает, что у больных инфарктом миокарда моложе 65 лет общая частота использования тромболитических препаратов составляет, в среднем, 40-50%, а у пациентов старше 65 лет - 20%.
Гепарин.
Гепарин является прямым антикоагулятном и был описан еще в 1916 г. После взаимодействия с антитромбином III, образуется комплекс гепарин-антитромбин III, который инактивирует тромбин и X фактор (Хагемана). Эффект гепарина модулируется многими факторами, например, активностью и содержанием циркулирующего антитромбина III, тромбоцитарного фактора IV и другими плазменными белками, инактивирующими этот препарат. Гепарин - антитромбин III комплекс неэффективен в отношении тромбсвязанного тромбина.
У больных инфарктом миокарда, при проведении тромболизиса применение гепарина зависит от использования конкретного фибринолитика. Стрептокиназа, антстреплаза, урокиназа являются тромболитическими препаратами (неспецифическими антикоагулянтами), которые производят системную поломку коагуляционной системы, включая угнетение V, VIII факторов и массивное образование продуктов деградации фибриногена. При их использовании гепарин обычно не применяется. В сравнении с такими фибрин-специфическими препаратами, как reteplase, alteplase, другие новейшие средства, находящиеся в стадии апробации, незначительно влияют на свертывающую систему. У многих больных при их использовании происходит очень небольшое ингибирование фибриногена и угнетение коагуляционных факторов. В этих случаях практически всегда применяется гепарин, вначале внутривенно, а затем - подкожно.
В последних многочисленных рандомизированных исследованиях не было получено достоверного различия по частоте реперфузии, смертности, рецидивам инфарктов, негеморрагическим инсультам при подкожном и внутривенном применении гепарина, в то время как повышение частоты системных кровотечений и геморрагических инсультов наблюдалось в группе, получавшей этот препарат внутривенно.
Доза гепарина у больных инфарктом миокарда при проведении тромболизиса остается спорной. По результатам многих рандомизированных исследований, для достижения положительного эффекта необходимо использовать первоначальную дозу гепарина в расчете на вес пациента вначале внутривенно болюсом 70 Ед./кг, затем - 15 Ед./кг в час. Резонным подходом является использование внутривенно гепарина в течение 48 ч и затем подкожно, в соответствии с показаниями для конкретного пациента, например, у пациентов с высоким риском системных тромбоэмболий, а внутривенно - с высоким риском коронарной реокклюзии. Продолжающиеся исследования показывают, что снижение дозы гепарина необходимо проводить ступенчато (наполовину в первые 6 ч, прекращая его введение в последующие 12 ч). Сотрудники американской ассоциации кардиологов рекомендуют низкие дозы подкожного гепарина - 7500 Ед. в день. Эмпирическая основа этих рекомендаций была продемонстрирована снижением глубоких венозных тромбозов с 12% до 4% в трех рандомизированных исследованиях. Соблюдение этих стандартов резонно, хотя обычная ранняя мобилизация и назначение аспирина, требует пересмотра этих рекомендаций. Поэтому их выполнение не является строго обязательным. Основываясь на том, что при инфаркте миокарда происходит разрыв атеросклеротической бляшки и заживление ее эндотелиальной поверхности после использования тромболитической терапии происходит в течение нескольких дней, продолжительность лечения гепарином в течение 3 –5 (до 7) дней в настоящее время является золотым стандартом гепаринотерапии.
Введение гепарина совместно со стрептокиназой, антистреплазой, урокиназой показано при наличии большого инфаркта миокарда в области передней стенки левого желудочка, документированного тромба в полости левого желудочка при эхокардиографическом исследовании, тромбоэмболий в анамнезе, фибрилляции предсердий, при которых повышается риск тромбоэмболических осложнений, в том числе инсультов. В исследовании SCATI больные с высоким риском тромбоэмболических осложнений (см. выше) получали стрептокиназу и 20000 Ед. гепарина внутривенно болюсом с последующим введением по 12500 Ед. два раза в день подкожно, причем аспирин не применялся. Согласно этому исследованию, госпитальная смертность больных инфарктом миокарда, которым проводилась терапия гепарином и плацебо составила 4,6% и 8,8% соответственно. Поэтому гепарин рекомендован для больных с высоким риском системных артериальных эмболий, не взирая на назначенный тромболитический препарат.
Недавно созданный аbciximab, Fab фрагмент человеческих моноклональных антител к рецептору IIb/IIIa на поверхности тромбоцитов, продемонстрировал достоверное снижение риска летальных исходов как в течение 30 дней, так и в течение 6 месяцев после проведения первичной ангиопластики. Однако польза была достигнута ценой повышения частоты кровотечений - от 13% до 24%.
Фраксипарин был разработан с отличительным эффектом на угнетение тромбина и Xа-фактора (Хагемана). Хотя нефракционированный и низкомолекулярный гепарин катализируют угнетение тромбина через антитромбин III. Эти препараты, назначенные в адекватных дозах, при более высоком соотношении образующегося комплекса анти-Xa/анти-IIa низкомолекулярного гепарина имеют потенциальные преимущества в угнетении каскада свертывания крови на более проксимальном участке, приводя к уменьшению генерации тромбина. Подкожное назначение низкомолекулярного гепарина имеет преимущества перед нефракционированным гепарином в снижении эпизодов рецидивирующей ишемии у больных с нестабильной стенокардией, при различных формах венозного тромбоза, но его сравнительная оценка при коронарном тромбозе не проведена.
Новые прямые антитромбиновые средства так же находятся на стадии клинического изучения. Прототипный прямой антитромбиновый препарат гирудин (Hirudin) был изначально выделен из слюны медицинской пиявки. Теперь, синтезированный рекомбинантной технологией, этот компонент имеет различные концептуальные преимущества: не требует относительно высокой активности антитромбина III, не нейтрализуется белками плазмы и способен угнетать связанный тромбом тромбин. Результаты 30 дневной смертности (первичный исход) у больных, получавших гирудин, составили, в среднем, 8,9% и 9,8% соответственно в сравнении с терапией гепарином (Чазов Е.И., 1992, Braunwald E., 1993, 1997, 2000, Rayn B., 1996).
Нитроглицерин.
Основным действием нитратов является вазодилатация, обусловленная релаксацией этими препаратами гладкомышечных сосудистых волокон вен, артерий и артериол. Метаболическое превращение органических нитратов в оксид азота в непосредственной близости от плазматической мембраны клеток гладкомышечных волокон сосудов является одним из молекулярных механизмов их вазодилатирующего действия. Будучи эндотелий-продуцированным релаксирующим фактором, оксид азота является важным эндогенным модулятором сосудистого тонуса. Назначение нитратов рассматривается в аспекте обеспечения экзогенного источника оксида азота, что может помочь пополнить или восстановить активность эндотелий-продуцированного релаксирующего фактора, которая обычно снижена у больных с атеросклерозом коронарных артерий.
При назначении нитратов снижение преднагрузки на правый и левый желудочек обусловлено периферической вазодилатацией, причем преимущественно мезентериального сосудистого русла, а также уменьшением постнагрузки из-за артериальной вазодилатации, снижением работы сердца и потребления миокардом кислорода. Эти гемодинамические изменения улучшаются соотношение между потребностью миокарда в кислороде и его доставкой, вследствие чего миокардиальная ишемия уменьшается. Поэтому нитраты показаны больным с систолической дисфункцией левого желудочка и клиническими признаками сердечной недостаточности. Прямой вазодилатирующий эффект нитратов на коронарное русло и предотвращение эпизодической вазоконстрикции коронарных артерий повышают глобальное и региональное кровоснабжение миокарда, улучшая соотношение субэпикардиального/эпикардиального кровотока. Кроме того, эти препараты могут дилатировать как крупные, так и мелкие коллатеральные коронарные сосуды, вызывая вазодилатацию небольших коронарных артерий дистальнее места обструкции, а также уменьшать агрегацию тромбоцитов.
В настоящее время в клинической практике используются три разновидности нитратов: содержащий нитроглицерин или депо нитроглицерина, изосорбида-динитрат, изосорбида-5-мононитрат. Нитроглицерин характеризуется коротким периодом полувыведения (в течение нескольких минут). Изосорбид-динитрат представляет собой органический нитрат, который метаболизируется печенью на два активных метаболита: изосорбида-2-мононитрат и изосорбид-5-мононитрат. Период полувыведения изосорбида-динитрата составляет от 40 до 90 мин. Изосорбид-5-мононитрат, активный метаболит изосорбида-динитрата, является синтетическим нитратом, одобренным к применению фармакокомитетом РФ в 1991 г. Изосорбид-5-мононитрат не подвергается распаду в печени и в 100% биодоступен после перорального применения. Его период полувыведения составляет от 4 до 5 часов. Следует отметить, что изосорбид-динитрат и изосорбид-5-мононитрат выпускаются в ретардированных формах. Нитроглицерин является препаратом выбора в терапии больных инфарктом миокарда и нестабильной стенокардией, причем он при внутривенном введении может успешно титроваться путем частого измерения артериального давления и частоты сердечных сокращений.
Когда внутривенно назначается нитроглицерин, необходимо начинать его введение с внутривенной болюсной инъекции 12,5-25 мкг и продолжать инфузию со скоростью 10-20 мкг/мин., повышая дозу на 5-10 мкг каждые 5-10 мин. при тщательном контроле за состоянием гемодинамики и клиническом наблюдении за пациентом. Окончание титрования контролируется клиническими симптомами или понижением артериального давления до 10% у нормотензивных больных или до 30% с гипертензией (но никогда ниже 90 мм. рт. ст.), учащением частоты сердечных сокращений на 10 ударов в 1 мин (но не более 110 в 1 мин.) или понижением конечно-диастолического давления в легочной артерии на 10-30% в сравнении с исходными значениями этих параметров. Инфузия замедляется или временнопрекращается, если систолическое артериальное давление снижается менее 90-80 мм. рт. ст. Хотя и нет абсолютного лимита дозы, превышение ее более чем 200 мкг/мин вызывает повышенный риск гипотонии (Малая Л.Т. и соавт., 1981, Чазов Е.И., 1992, Braunwald E., 1993, 1997, Rayn B., 1996). Комбинированное введение нитроглицерина с -адреноблокаторами хорошо переносится и теоретически привлекательнее потому, что может быть устранен риск нежелательной тахикардии. Следует отметить, что при развитии толерантности к нитроглицерину скорость его инфузии может быть увеличена до 200 мкг/мин. и, если эта доза неэффективна, используются другие вазодилататоры такие, как нитропруссид натрия или ингибиторы АПФ, которые могут заменить инфузии нитроглицерина. Необходимо помнить, что восстановление эффективности этого препарата наблюдается через 12 часов после прекращения его введения.
Кроме характерной головной боли, нитроглицерин может так же вызвать гипоксемию, повышая вентиляционно-перфузионные соотношения. Более серьезным побочным эффектом является системная гипотония, которая может приводить к рефлекторной тахикардии и ухудшать миокардиальную ишемию. Нитроглицерин должен быть тщательно оттитрован у больных инфарктом миокарда с локализацией очага поражения в области нижней или задней стенки левого желудочка, так как он часто сочетается с инфарктом правого желудочка. Такие пациенты особенно зависят от адекватной преднагрузки на правый желудочек, а при снижении преднагрузки на правый желудочек при использовании нитратов уменьшается сердечный выброс, развивается тяжелая гипотония. Когда нитроглицерин приводит к брадикардии или гипотонии, его необходимо отменить. Для устранения этих побочных эффектов показано быстрое введение растворов, например, физиологического раствора, глюкозы, а также атропина.
Достижение антиишемического эффекта у органических нитратов с увеличением дозы является большим ограничением при их использовании. Толерантность к нитроглицерину обусловлена комплексным мультифакторным феноменом, который может быть в какой-то мере объяснен частичным угнетением сульфгидрильных групп белок-релаксирующего фактора, необходимых для превращения органических нитратов в оксид азота, т.е. между двумя группами SH белок-релаксирующего фактора замыкаются двойные связи и они превращаются в S=S. Повышение коронарными артериями продукции супероксидазы, супероксиддисмутазы и других ферментов антиоксидантной системы, являющихся донаторами Н-, играют важную роль в предотвращении этого феномена. В настоящее время хорошо известно, что интермиттирующий режим, предполагающий свободный от этих лекарств интервал, представляет единственную практическую и эффективную стратегию, позволяющую избежать толерантности к нитратам. Когда используется изосорбид-динитрат, антиишемическая активность более вероятно может быть достигнута при приеме 2-3 раза в день. Для избежания толерантности разрыв в приеме нитратов может составлять до 14 ч, например, если не использовать эти препараты вечером и ночью. Нерегулярный режим дозирования изосорбида-динитрата в 8 утра и в 3 часа дня показал сохраняющийся антиишемический эффект этого короткодействующего препарата (Rayn B., 1996). Когда нитроглицерин используется постоянно внутривенно в течение 24-48 ч в остром периоде инфаркта миокарда, нужно заметить, что толерантность к препаратам обычно не распознается в постели. Только когда положительный эффект нитратов устраняется в течение 1-3 суток от начала заболевания, требуется увеличение дозы вводимого внутривенно нитроглицерина.
При лечении больных инфарктом миокарда необходимо помнить о потенциальном противодействии между гепарином с внутривенным применением нитроглицерина. По данным разных авторов, внутривенно используемый нитроглицерин может влиять на эффективность гепарина, в частности, уменьшая активированное тромбопластиновое и протромбиновое время, что, тем самым, понижает чувствительность тромбоцитов к воздействию гепарина. Таким образом, для достижения желаемого антикоагулянтного эффекта при комбинированном применении этих препаратов требуется повышенная доза гепарина, а также отмечается высокий риск кровотечений, особенно в тех случаях, когда инфузия нитроглицерина прекращается, а гепарина продолжается.
Внутривенное использование нитроглицерина может уменьшать зону инфаркта и улучшать региональную миокардиальную функцию, а также способствует предотвращению «ремоделирования» левого желудочка, которое чаще наблюдается при трансмуральном инфаркте миокарда. В настоящее время все рандомизированные исследования об использовании нитратов в остром периоде инфаркте миокарда показали статистически достоверное снижение смертности с сохранением примерно 4 жизней на 1000 пациентов инфарктом миокарда. Кроме того, результаты всех рандомизированных клинических исследований не показали увеличения положительного клинического эффекта рутинного использования длительной терапии нитроглицерином (более 7-10 дней) у больных неосложненным инфарктом миокарда (Rayn B., 1996). Таким образом, согласно результатам многочисленных многоцентровых исследований, всем больным неосложненным инфарктом миокарда показаны инфузии нитроглицерина в течение первых 24-48 ч от начала заболевания с дальнейшим переходом на нитраты пролонгированного действия.
Аспирин и другие тромбоцитарно-активные препараты
Тромбоциты и тромбоз коронарных артерий играют важную роль в патогенезе острого коронарного синдрома, в том числе инфаркта миокарда. Аспирин предотвращает образование тромбоксана А2, индуцирующего агрегацию тромбоцитов. При приеме этого препарата угнетается синтез циклооксигеназы на протяжении всей длительности жизни тромбоцитов (около 10 дней). На эндотелии сосудов аспирин повышает синтез простациклина, который угнетает агрегацию тромбоцитов. Однако эндотелиальные клетки могут восстанавливать циклооксигеназный синтез, т.к. стимулирующий эффект аспирина на эндотелий сосудов может быть меньше по продолжительности, чем его антиагрегантное действие на тромбоциты.
В обзоре Antiplatelet Tralists’ Collaboration, включившем в себя 145 исследований, дезагрегантная терапия (главным образом, аспирин) обладала протективнывным действием против «сосудистых катастроф» у следующих групп пациентов: 1) больные инфарктом миокарда 10% против 14% (в течение 1 месяца приема аспирина); 2) при предшествующем инфаркте миокарда 13% против 17% (в течении 2-х лет наблюдения); 3) при наличии в анамнезе транзиторной церебральной ишемии 18% против 22% (в течении 3 лет наблюдения); 4) при нестабильной стенокардии 9% против 14% (в течении 6 месяцев); 5) другими сосудистыми заболеваниями 6% против 8% (в течение 1 года). Когда все больные с высоким риском развития осложнений были рассмотрены вместе, наблюдалось, в среднем, на 30% снижение нефатальных инфарктов миокарда, на 30% - нефатальных инсультов, на 17% - снижение общей «сосудистой» смертности. У больных с пренесенным инфарктом или инсультом аспирин приблизительно предотвращал 40 случаев (инфаркта миокарда и инсультов) на 1000 пролеченных больных. Однако, когда он использовался у больных с неосложненным инфарктом миокарда, этот препарат предотвращал только 4 случая фатальных осложнений на 1000 леченных пациентов.
Побочные эффекты аспирина в основном зависят от дозы и длительности применения: он противопоказан при наличии у больного язвенной болезни, эрозивного гастрита, трещин слизистой желудка и т.д. Гастритические побочные эффекты могут быть уменьшены назначением разбавленного раствора аспирина, циметидина, антацидов или использованием таблеток аспирина, покрытых специальной оболочкой. Этот препарат следует избегать у тех пациентов, кто имеет известную гиперчувствительность и применять осторожно при наличии патологических изменений крови или тяжелых заболеваний печени. Если больной имеет в анамнезе кровоточащую пептическую язву, то могут быть применены только ректальные суппозитории аспирина, используемые с высокой степенью безопасности. Другим потенциально опасным отрицательным эффектом этого препарата является риск кровотечения после хирургического вмешательства. Аспирин является эффективным антитромботическим агентом в дозе 75 мг –1,2 г в день, однако наиболее распространенная его доза составляет 160-320 мг в сутки.
Тиклопидин является дезагрегантом с иным механизмом действия, чем аспирин. Он угнетаетагрегацию тромбоцитов, индуцированную агонистами, включая аденозин-дифосфат, блокируя взаимодействие между фибриногеном и его мембранным гликопротеиновым рецептором GPIIb/IIIa. Угнетающий эффект тиклопидина отсрочен на 24-48 ч после его приема. Поэтому он не может быть использован, когда требуется быстрый дезагрегантный эффект. По эффективности он не уступает аспирину, но обладает серьезным побочным эффектом — обратимая нейтропения, которая наблюдается при его использовании в течение 2 недель и более. Поэтому тиклопидин используется в тех случаях, когда аспирин неэффективен, не переносится или противопоказан.
-адреноблокаторы
-адреноблокаторы могут быть назначены больным инфарктом миокарда для снижения заболеваемости и смертности в течение: 1) с первых часов развития инфаркта миокарда, 2) с первых недель, месяцев и лет после перенесенного инфаркта миокарда (вторичная профилактика).
В течение первых часов от начала инфаркта миокарда -адреноблокаторы уменьшают потребление миокардом кислорода, снижая частоту сердечных сокращений, системное артериальное давление и сократимость сердечной мышцы. Следует отметить, что, удлинение диастолы, вызванное снижением частоты сокращений сердца, улучшает перфузию поврежденного миокарда, особенно в субэнокардиальных отделах. Поэтому терапия -адреноблокаторами, проводимая с первых часов от начала заболевания, снижает как размеры инфаркта миокарда, так и риск развития осложнений у больных, не получавших тромболитическую терапию, а также число рецидивов инфаркта миокарда, в том числе у пациентов получавших тромболизис.
У больных, получающих тромболитическую терапию, внутривенное назначение -адреноблокаторов снижает частоту нефатальных рецидивов инфаркта миокарда (Rayn B., 1996). Кроме того, эти препараты могут уменьшить смертность, особенно если они назначаются в течение 2 часов после наступления симптомов заболевания. В исследовании TIMI-II, в котором все больные получали Alteplase, у всех пациентов, которым проводилась внутривенная терапия метопрололом с первых часов от начала инфаркта миокарда (вначале 15 мг, а затем 50 мг дважды в день в течение 1 дня и в последующем по 100 мг два раза в день), наблюдалось достоверное снижение рецидивов инфаркта и возвратной ишемии по сравнению с теми, кто получал метопролол внутрь с первых 1-2 дней и в течение 6 дней от начала заболевания.
Поскольку -адреноблокаторы производят неблагоприятные эффекты такие, как атриовентрикулярная блокада, брадикардия, гипотония, эти осложнения быстро купируются после инфузии бета-адренергических агонистов, например, изопротеренола в дозе 1- 5 мкг/мин.
Общие противопоказания к терапии -адреноблокаторами у больных инфарктом миокарда.
Частота сердечных сокращений менее 60 ударов в 1 минуту;
Систолическое артериальное давление менее 100 мм. рт. ст.;
Умеренная или тяжелая сердечная недостаточность;
Периферические признаки гипотонии;
PQ интервал более 0,24 секунд и атриовентрикулярная блокада II-III степени;
Тяжелые обструктивные поражения легких;
Бронхиальная астма в анамнезе;
Тяжелые заболевания периферических сосудов – облитерирующий атеросклероз артерий нижних конечностей;
Инсулин-зависимый сахарный диабет.
Ингибиторы ангиотензин-конвертирующего фермента.
Многочисленные большие рандомизированные исследования показали положительное действие ингибиторов АПФ при их раннем применении в остром периоде инфаркта миокарда. Все исследования, в которых ингибиторы АПФ назначались внутрь, продемонстрировали пользу в отношении выживаемости. Только одно исследование не показало пользы от ингибиторов АПФ - CONSENSUS-II, в котором больные были рандомизированы на получающих с первого дня внутривенно эналаприл или плацебо, с последующим увеличением дозы эналаприла. Это исследование было рано прекращено Комитетом по Безопасности из-за высокой вероятности, что достоверный полезный эффект эналаприла над плацебо вряд ли будет продемонстрирован к концу исследования: 7% положительного эффекта к 29% отрицательного эффекта при внутривенном введении этих препаратов.
Выяснение роли перорального приема ингибиторов АПФ было проведено в исследовании ISIS-4. В нем 58 000 больных инфарктом миокарда были разделены на получающих каптоприл в течение 24 часов (в среднем, 8 часов) или плацебо. Пропорциональное снижение смертности, в среднем на 7%, наблюдалось в течение 5 недель среди пациентов, получавших каптоприл, причем, наибольший положительный эффект отмечался среди больных инфарктом миокарда с локализацией в области передней стенки левого желудочка. В этом исследовании среди 143 смертей в группе получавших каптоприл, у 44 пациентов летальный исход отмечался в первые сутки и у 37 - со 2 дня до 7 суток, что демонстрирует важность ранней терапии ингибиторами АПФ. В исследовании GISSI-3 использовалипероральный прием лизиноприла у 19 000 больных либо с элевацией, либо с депрессией сегмента ST, разделенных на получающих препарат и контрольную группу. Выявлено достоверное снижение смертности в течение 6 недель: в среднем, 60% жизней было спасено в течение первых 5 дней от начала лечения. Исследование SMILE привлекло 1556 больных, рандомизированных в первые 24 часа на получавших плацебо или зофеноприл (Zofenopril). В исследование были включены только больные инфарктом миокарда с локализацией в области передней стенки левого желудочка, которым не проводился тромболизис. Это исследование показало, что раннее применение ингибитров АПФ достоверно уменьшило смертность в течение первых 6 недель от начала заболевания. Китайское исследование по каптоприлу, вовлекшее более13 600 больных инфарктом миокарда, также показало, что примерно на 0,5% снизилась смертность среди пациентов, получавших каптоприл. Мета-анализ этих больших исследований, вовлекших 100 000 больных инфарктом миокарда, выявил добавочное снижение смертности на 6,5%, с абсолютной пользой — 4,6 сохраненных жизней на 1 000 леченных пациентов ингибиторами АПФ. Эти результаты предполагают, что ингибиторы АПФ играют важную роль при раннем их использовании у больных в остром периоде инфаркта миокарда, так же как и в восстановительной фазе заболевания.
Хотя детальный анализ подгрупп в ISIS-4 и GISSI-3 ожидает дальнейших публикаций, польза от ингибиторов АПФ является достоверно большей среди тех, кто имел первый инфаркт миокарда передней локализации, сердечную недостаточность, тахикардию. Данные этих исследований показали, что ингибиторы АПФ должны быть назначены в течение 24 часов, в идеальном случае сразу после тромболитической терапии и стабилизации артериального давления. Когда у больного отсутствуют осложнения в течение 4 - 6 недель от начала инфаркта миокарда, прием ингибиторов АПФ может быть прекращен. Эти препараты не должны назначаться при систолическом артериальном давлении ниже 100 мм. рт. ст., при наличии клинически значимой сердечной недостаточности, при наличии билатерального стеноза почечных артерий или аллергии к ним. Терапия ингибиторами АПФ должна быть начата с низких доз с постоянным ее повышением для достижения полной суточной дозы в течение 24-48 часов. Например, в исследовании ISIS-4, каптоприл вначале назначался в дозе 6,25мг, затем 12,5 мг через 2 часа, через 10-12 часов – 25 мг, затем по 50 мг 2 раза в день. В исследовании GISSI больные получали 5 мг лизиноприла во время рандомизации, 5 мг через 24 часа, 10 мг - через 48 часов, затем по 10 мг в течение 6 недель от начала развития заболевания. Подобный режим должен применяться при назначении других ингибиторов АПФ таких как рамиприл, зофеноприл, эналаприл, квиналаприл (Quinalapril). Внутривенного назначения ингибиторов АПФ следует избегать из-за возможной нерегулируемой гипотензивной реакции.
r Антагонисты кальциевых каналов
Антагонисты кальциевых каналов не показали снижения смертности при остром инфаркте миокарда, а у больных с различными клиническими формами ИБС они повышают смертность (Чазов Е.И., 1992, Rayn B., 1994,1996, Braunwald E., 1997, 2000). Следует отметить, что эти препараты в различных клиниках все еще часто используются у больных инфарктом миокарда (Rayn B., 1996).
Нифедипин. У больных инфарктом миокарда немедленно высвобождающийся нифедипин не снижает частоту рецидивов инфаркта миокарда или смертности при раннем его применении (менее 24 часов от начала заболевания) или при позднем назначении этого препарата. Снижение эффективности нифедипина обнаружено у всех пациентов, независимо от пола, общего риска, с зубцом Q или без него, с наличием или отсутствием сопутствующего назначения бета-блокаторов или тромболитической терапии. Немедленно высвобождающийся нифедипин может быть особенно вреден у больных с гипотонией и (или) тахикардией. У этих пациентов он может индуцировать снижение коронарного перфузионного давления, диспропорциональную дилятацию коронарных артерий, смежных с ишемизированной зоной (так называемое, обкрадывание), и (или) рефлекторную активацию симпатической нервной системы, способствующую увеличению частоты сокращений сердца и повышению потребности миокарда в кислороде. Эти данные были получены при анализе многочисленных клинических исследований, включая Nifedipine Miocardial Infarction Study (NAMIS), Norwegian Nifedipine Multicentral Trial, Trial of Early Nifedipine Treatment in Acute Miocardial Infarction (TREND), Secondary Prevention Reinfarction Israeli Nofedipine Trial (SPRINT). В этих исследованиях использовался нифедипин первой генерации (не ретардные формы препарата). Будет ли это заключение действительным для всего класса этих препаратов - пока еще не известно.
Верапамил. Хотя общие результаты исследований с верапамилом не показали пользы в отношении выживаемости, анализ подгрупп показывает, что немедленно высвобождающийся верапамил, назначенный спустя несколько дней от начала инфаркта миокарда может быть полезен для снижения рецидивов ангинозных болей, рецидивов заболевания и летальности у пациентов без признаков сердечной недостаточности. Верапамил противопоказан для больных с сердечной недостаточностью или брадиаритмиями в течение первых 24-48 часов от начала заболевания (Малая Л.Т. и соавт., 1981, Чазов Е.И., 1992, Rayn B., 1996).
Дилтиазем. Данные от MDPIT (Multicenter Diltiazem Postinfarction Trial) (инфаркт миокарда с зубцом и без зубца Q), DRS (Diltiazem Reinfarction Study) (инфаркт миокарда без зубца Q) показали, что терапия быстро-высвобождающимся дилтиаземом может быть достаточно эффективной у больных инфарктом без или с патологическим зубцом Q, с сохраненной функцией левого желудочка или с наличием диастолической дисфункции левого желудочка, но без клинически выраженной сердечной недостаточности. Он противопоказан при систолической дисфункции левого желудочка. Дилтиазем в исследовании MDPIT начинали давать через 3 -15 дней, а в DRS - спустя 24-72 часа от начала симптомов заболевания. Результаты MDPIT были смешанными из-за того, что 53% пациентов, получавших дилтиазем и 55% - из плацебо-группы, принимали и бета-блокаторы. Хотя оба исследования были выполнены в пору, когда использование аспирина не было превалирующим, как в настоящее время, они не показали достоверного положительного клинического эффекта при использовании дилтиазема у больных инфарктом миокарда. Следует отметить, что в исследовании INERCEPT, применявшем постоянно-высвобождающийся дилтиазем (ретардированные формы) у больных, получающих тромболитическую терапию при первом инфаркте миокарда, опротестована гипотеза, что назначение этого препарата снижает смертность, рецидивы инфаркта миокарда и частоту постинфарктной стенокардии.
Заключение по антагонистам кальциевых каналов
Антагонисты кальциевых каналов не имеют доказанной пользы при раннем лечении и вторичной профилактике у больных острым инфарктом миокарда, но и вероятность высокой частоты осложнений и летальности была явно завышена. У больных с первым инфарктом без зубца Q или первым передним инфарктом миокарда без дисфункции левого желудочка или застоя в легких, верапамил и дилтиазем могут снижать частоту ангинозных болей в грудной клетке. Но их положительный эффект меньше, чем у -адреноблокаторов и аспирина. В настоящее время нет данных о положительном эффекте использования дигидроперидинов второй генерации (амлодипин, фелодипин и т.д.) в улучшении выживаемости при остром инфаркте миокарда (Rayn B., 1996, Braunwald E., 1997, 2000).
