
- •Введение
- •1. Основы химической термодинамики
- •1.1. Основные понятия и определения термодинамики
- •1.2. I закон термодинамики
- •1.3. Внутренняя энергия как термодинамическая функция состояния системы
- •1.4. Применение I закона термодинамики к анализу некоторых термодинамических процессов
- •1.5. Теплоемкость
- •1.6. Термохимия
- •1.6.1. Влияние температуры на тепловые эффекты химических реакций и других процессов
- •1.7. II закон термодинамики
- •1.7.1. Математическое выражение II закона термодинамики
- •1.7.2. Энтропия и направление самопроизвольного протекания процессов в изолированных системах
- •1.7.3. Расчет энтропии для различных термодинамических систем и процессов
- •1.8. Взаимосвязь энтропии и термодинамической вероятности
- •1.9. Термодинамические потенциалы и направление самопроизвольных процессов. Условие термодинамического равновесия в системе
- •Взаимосвязь энергии гельмгольца с другими термодинамическими функциями и параметрами состояния системы
- •Взаимосвязь энергии гиббса с другими термодинамическими функциями и параметрами состояния системы
- •1.9. Третий закон термодинамики
- •2. Химическое равновесие
- •2.1. Понятие о химическом потенциале
- •2.2. Химический потенциал индивидуального вещества и компонента раствора
- •1. Идеальные системы
- •2. Реальные системы
- •2.3. Способы выбора стандартного состояния
- •2.4. Условие химического равновесиЯ
- •2.5. Константы химического равновесия. Закон действующих масс
- •2.6. Уравнение изотермы химической реакции. Химическое сродство
- •2.7. Влияние температуры на константу химического равновесия (уравнения изобары и изохоры химической реакции)
- •2.8. Влияние давления на константу химического равновесия (уравнение планка)
- •2.9. Энтропийный метод расчета константы химического равновесия
- •3. Термодинамика растворов и гетерогенные (фазовые) равновесия
- •3.1. Основные понятия и определения
- •3.2. Условие термодинамического равновесия в гомогенных растворах
- •3.2.1. Термодинамика идеальных растворов
- •3.2.2. Термодинамика реальных растворов
- •3.3. Равновесие в гетерогенных системах.
- •3.3.1. Теорема равновесия гиббса
- •3.3.2. Правило фаз гиббса
- •3.3.3. Применение правила фаз гиббса к анализу структуры диаграмм состояния гетерогенных систем
- •3.3.4. Уравнение состояния однокомпонентной двухфазной системы (уравнение кЛаузиуса – клапейрона)
- •3.3.5. Примеры гетерогенных (фазовых) равновесий а. Фазовое равновесие жидкость – пар
- •Растворимость газов в жидкостях (закон генри)
- •Б. Фазовое равновесие жидкость – жидкость диаграммы взаимной растворимости жидкостей в ТройныХ системАх
- •Основные типы диаграмм взаимной растворимости тройных систем
- •Распределение вещества между двумя соприкасающимися, но несмешивающимися растворителями (Закон распределения Нернста)
- •Экстракция
- •В. Фазовое равновесие жидкость – твердое вещество растворимость твердых веществ в жидкостях (закон шредера)
- •3.3.6. Коллигативные свойства растворов
- •Понижение давления пара над раствором по сравнению с чистым растворителем
- •Повышение температуры кипения и понижение температуры замерзания растворов
- •Определение молекулярной массы раствореного вещества
- •Г рафическое определение Tк и Tз
- •Осмотическое давление. Методы разделения жидких смесей мембранными методами
- •4. Электрохимия
- •4.1. Термодинамика растворов сильных электролитов
- •4.2. Электростатическая теория растворов сильных электролитов
- •4.3. Равновесие в растворах слабых электролитов
- •4.4. Электропроводность растворов электролитов.
- •4.5. Зависимость молярНой электропроводностИ электролитов от их концентрации в растворе
- •4.6. Электродвижущие силы и электродные потенциалы
- •4.6.1. Механизм возникновения электродных потенциаЛов. Уравнение нернста
- •4.6.2. Гальванические элементы
- •4.9.3. Основные типы электродов и расчет их потенциала
- •4.9.5. Потенциометрия
- •5. Химическая кинетика и катализ
- •5.1. Основные понятия и определения
- •5.2. Основной закон химической кинетики. Молекулярность и порядок реакции
- •Основы формальной кинетики.
- •5.3. Кинетика необратимых реакций
- •5.4. Методы определения порядка реакции
- •5.5. Влияние температуры на скорость реакции
- •5.6. Основные понятия катализа
- •5.6.1. Гомогенный катализ
- •5.6.2. Гетерогенный катализ
1.7.1. Математическое выражение II закона термодинамики
а.) Математическое выражение II закона термодинамики для обратимых процессов можно получить двумя способами:
с
 пособ
рассмотрения цикла Карно;
пособ
рассмотрения цикла Карно;применение принципа Каратеодори (не рассматриваем).
При рассмотрении
цикла Карно (рис. 5), установлена теорема
Карно–Клаузиуса: коэффициент полезного
действия (![]() )
тепловой машины не зависит от природы
рабочего тела (идеальный газ, пар, воздух
и т.п.), а определяется только интервалом
температур, в котором совершается
работа. Это еще одна формулировка II
закона термодинамики.
)
тепловой машины не зависит от природы
рабочего тела (идеальный газ, пар, воздух
и т.п.), а определяется только интервалом
температур, в котором совершается
работа. Это еще одна формулировка II
закона термодинамики.
![]()
 ;
;
![]() ;
;
![]() или
или
![]() .
.
Из
последнего уравнения следует, что
отношение
![]() не зависит от пути протекания процесса,
а определяется только начальным и
конечным состоянием системы, т.е. является
функцией состояния, обозначим
не зависит от пути протекания процесса,
а определяется только начальным и
конечным состоянием системы, т.е. является
функцией состояния, обозначим
![]() – энтропия. Термин энтропия ввел
Клаузиус.
– энтропия. Термин энтропия ввел
Клаузиус.
Энтропия – это отношение теплоты изотермического процесса к температуре процесса (приведенная теплота).
В обратимом процессе изменения энтропии не происходит.
![]() .
.
Для бесконечно малого цикла Карно запишем:
![]() или
или
![]() .
.
Таким образом, используя цикл Карно, получили математическое выражение II закона термодинамики для обратимых равновесных процессов в идеальном газе.
![]() или
или
![]() .
(44)
.
(44)
Важнейшим следствием из II закона термодинамики является вывод о существовании энтропии как термодинамической функции состояния.
Можно доказать, что уравнение II закона термодинамики (44) применимо к любым обратимым процессам в любых термодинамических системах.
б.) Получим математическое выражение II закона термодинамики для необратимого процесса.
Для этого запишем уравнение I закона термодинамики для произвольного термодинамического процесса, протекающего между одними и теми же исходным и конечным состояниями системы, необратимо и обратимо (или наоборот).
![]() .
(45)
.
(45)
![]() .
(46)
.
(46)
Вычтем почленно из уравнения (45) уравнение (46), получим:
![]() .
(47)
.
(47)
Согласно уравнению (43)
![]() .
.
Следовательно, из (47) получаем:
![]() .
.
Подставим значение
![]() из (44), получим
из (44), получим
![]() или
или
![]() .
(48)
.
(48)
(48) – уравнение II закона термодинамики для необратимых процессов.
Часто уравнения (44) и (48) объединяют в одно уравнение и записывают:
![]() или
или
![]() (49)
(49)
Из анализа уравнения (43) вытекает также, что работа обратимого процесса является максимальной работой процесса:
![]() .
.
где
![]() – работа данного процесса, протекающего
обратимо.
– работа данного процесса, протекающего
обратимо.
1.7.2. Энтропия и направление самопроизвольного протекания процессов в изолированных системах
Рассмотрим
какую-либо изолированную систему (![]() ).
Тогда уравнение II закона
термодинамики (49) запишется:
).
Тогда уравнение II закона
термодинамики (49) запишется:
![]() .
(50)
.
(50)
(знак неравенства относится к необратимым самопроизвольно протекающим процессам, знак равенства характеризует термодинамическое равновесие)
Запишем условие самопроизвольного протекания процесса.
![]() ;
;
![]() .
.
Видим, таким
условием является возрастание энтропии
системы
![]() .
Рост энтропии прекратится, когда энтропия
системы станет максимальна.
.
Рост энтропии прекратится, когда энтропия
системы станет максимальна.
![]() .
.
По соотношению (50) можно определить для изолированной системы:
пойдет реакция или нет;
максимальный выход (исходя из условия термодинамического равновесия);
скорость протекания реакции.
Постулат Клаузиуса о тепловой смерти вселенной: Клаузиус пришел к выводу, что все процессы, протекающие в природе, сопровождаются возрастанием энтропии. Поэтому энтропия вселенной (мира) непрерывно возрастает и как только достигнет своего максимального значения, установится состояние термодинамического равновесия, т.е. наступит тепловая смерть вселенной.
Однако, придя к такому выводу, Клаузиус допустил ошибку, так как сформулированное соотношение справедливо для изолированных систем, в то время как вселенная безгранична. Поэтому постулат неверен.
Свойства энтропии:
энтропия является функцией состояния системы, следовательно, аддитивная величина, т.е. энтропия системы равна сумме энтропий ее составных частей;
изменение энтропии при обратимом процессе не зависит от пути перехода и определяется только значением энтропии начального и конечного состояния. Т.е. для энтропии
![]() ;
;
Энтропия экстенсивная величина (зависящая от массы);
Энтропия размерная величина:
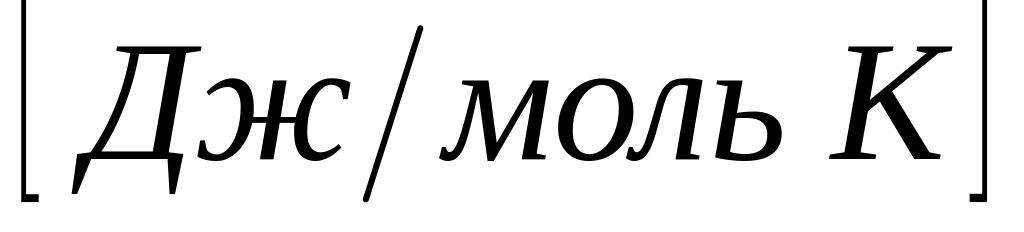 ;
;
Физический смысл: энтропия характеризует количество рассеянной энергии, отнесенной к единице температуры.
Энтропия – это критерий направления самопроизвольного протекания процессов в изолированных системах.
ЛЕКЦИЯ 4
