
- •Введение
- •1. Основы химической термодинамики
- •1.1. Основные понятия и определения термодинамики
- •1.2. I закон термодинамики
- •1.3. Внутренняя энергия как термодинамическая функция состояния системы
- •1.4. Применение I закона термодинамики к анализу некоторых термодинамических процессов
- •1.5. Теплоемкость
- •1.6. Термохимия
- •1.6.1. Влияние температуры на тепловые эффекты химических реакций и других процессов
- •1.7. II закон термодинамики
- •1.7.1. Математическое выражение II закона термодинамики
- •1.7.2. Энтропия и направление самопроизвольного протекания процессов в изолированных системах
- •1.7.3. Расчет энтропии для различных термодинамических систем и процессов
- •1.8. Взаимосвязь энтропии и термодинамической вероятности
- •1.9. Термодинамические потенциалы и направление самопроизвольных процессов. Условие термодинамического равновесия в системе
- •Взаимосвязь энергии гельмгольца с другими термодинамическими функциями и параметрами состояния системы
- •Взаимосвязь энергии гиббса с другими термодинамическими функциями и параметрами состояния системы
- •1.9. Третий закон термодинамики
- •2. Химическое равновесие
- •2.1. Понятие о химическом потенциале
- •2.2. Химический потенциал индивидуального вещества и компонента раствора
- •1. Идеальные системы
- •2. Реальные системы
- •2.3. Способы выбора стандартного состояния
- •2.4. Условие химического равновесиЯ
- •2.5. Константы химического равновесия. Закон действующих масс
- •2.6. Уравнение изотермы химической реакции. Химическое сродство
- •2.7. Влияние температуры на константу химического равновесия (уравнения изобары и изохоры химической реакции)
- •2.8. Влияние давления на константу химического равновесия (уравнение планка)
- •2.9. Энтропийный метод расчета константы химического равновесия
- •3. Термодинамика растворов и гетерогенные (фазовые) равновесия
- •3.1. Основные понятия и определения
- •3.2. Условие термодинамического равновесия в гомогенных растворах
- •3.2.1. Термодинамика идеальных растворов
- •3.2.2. Термодинамика реальных растворов
- •3.3. Равновесие в гетерогенных системах.
- •3.3.1. Теорема равновесия гиббса
- •3.3.2. Правило фаз гиббса
- •3.3.3. Применение правила фаз гиббса к анализу структуры диаграмм состояния гетерогенных систем
- •3.3.4. Уравнение состояния однокомпонентной двухфазной системы (уравнение кЛаузиуса – клапейрона)
- •3.3.5. Примеры гетерогенных (фазовых) равновесий а. Фазовое равновесие жидкость – пар
- •Растворимость газов в жидкостях (закон генри)
- •Б. Фазовое равновесие жидкость – жидкость диаграммы взаимной растворимости жидкостей в ТройныХ системАх
- •Основные типы диаграмм взаимной растворимости тройных систем
- •Распределение вещества между двумя соприкасающимися, но несмешивающимися растворителями (Закон распределения Нернста)
- •Экстракция
- •В. Фазовое равновесие жидкость – твердое вещество растворимость твердых веществ в жидкостях (закон шредера)
- •3.3.6. Коллигативные свойства растворов
- •Понижение давления пара над раствором по сравнению с чистым растворителем
- •Повышение температуры кипения и понижение температуры замерзания растворов
- •Определение молекулярной массы раствореного вещества
- •Г рафическое определение Tк и Tз
- •Осмотическое давление. Методы разделения жидких смесей мембранными методами
- •4. Электрохимия
- •4.1. Термодинамика растворов сильных электролитов
- •4.2. Электростатическая теория растворов сильных электролитов
- •4.3. Равновесие в растворах слабых электролитов
- •4.4. Электропроводность растворов электролитов.
- •4.5. Зависимость молярНой электропроводностИ электролитов от их концентрации в растворе
- •4.6. Электродвижущие силы и электродные потенциалы
- •4.6.1. Механизм возникновения электродных потенциаЛов. Уравнение нернста
- •4.6.2. Гальванические элементы
- •4.9.3. Основные типы электродов и расчет их потенциала
- •4.9.5. Потенциометрия
- •5. Химическая кинетика и катализ
- •5.1. Основные понятия и определения
- •5.2. Основной закон химической кинетики. Молекулярность и порядок реакции
- •Основы формальной кинетики.
- •5.3. Кинетика необратимых реакций
- •5.4. Методы определения порядка реакции
- •5.5. Влияние температуры на скорость реакции
- •5.6. Основные понятия катализа
- •5.6.1. Гомогенный катализ
- •5.6.2. Гетерогенный катализ
В. Фазовое равновесие жидкость – твердое вещество растворимость твердых веществ в жидкостях (закон шредера)
Изменение давления практически не влияет на равновесие в конденсированных системах, поэтому примем, что . Влияние температуры на растворимость малорастворимых в жидкости твердых веществ при равновесии кристаллов твердого вещества и раствора этого вещества в жидком растворителе выражает уравнение Шредера:
![]() .
(162)
.
(162)
где
![]() – мольная доля малорастворимого вещества
в растворе (растворимость);
– мольная доля малорастворимого вещества
в растворе (растворимость);
![]() – температура
плавления.
– температура
плавления.
Из анализа уравнения Шредера следует:
1. с повышением температуры растворимость твердых веществ возрастает;
2. легкоплавкие вещества растворяются лучше тугоплавких.
Уравнение
Шредера позволяет рассчитать растворимость
только малорастворимых веществ, поскольку
в этом случае мольную теплоту растворения
![]() можно заменить теплотой плавления
можно заменить теплотой плавления
![]() .
.
Если вещество
хорошо растворимо, то молекулы
растворенного вещества сольватированы,
а теплота растворения складывается из
теплоты плавления и мольной теплоты
сольватации
![]() :
:
![]() ,
(163)
,
(163)
Теплота плавления
![]() (т.к. при
плавлении теплота переходит от окружающей
среды к системе),
а теплота сольватации
(т.к. при
плавлении теплота переходит от окружающей
среды к системе),
а теплота сольватации
![]() (все молекулы
в растворе находятся в движении и
обладают определенной кинетической
энергией. При сольватации молекулы
растворителя входят в сольватную
оболочку растворенного вещества и
движутся вместе с ними, а энергия этих
молекул выделяется во внешнюю среду).
Поэтому, для хорошо растворимых веществ
влияние температуры на растворимость
будет определять соотношение слагаемых
в (165):
(все молекулы
в растворе находятся в движении и
обладают определенной кинетической
энергией. При сольватации молекулы
растворителя входят в сольватную
оболочку растворенного вещества и
движутся вместе с ними, а энергия этих
молекул выделяется во внешнюю среду).
Поэтому, для хорошо растворимых веществ
влияние температуры на растворимость
будет определять соотношение слагаемых
в (165):
если
![]() ,
то с повышением температуры растворимость
веществ будет увеличиваться (например,
сахароза);
,
то с повышением температуры растворимость
веществ будет увеличиваться (например,
сахароза);
если
![]() ,
то с повышением температуры растворимость
веществ будет снижаться (например,
,
то с повышением температуры растворимость
веществ будет снижаться (например,
![]() ).
).
Шредер рассматривал
случай, когда
![]() ,
допуская, что при растворении
малорастворимого вещества его молекулы
не сольватированы.
,
допуская, что при растворении
малорастворимого вещества его молекулы
не сольватированы.
3.3.6. Коллигативные свойства растворов
Коллигативными называют физико-химические свойства разбавленных растворов, не зависящие от природы растворенного вещества и определяющиеся только его концентрацией и природой растворителя.
Понижение давления пара над раствором по сравнению с чистым растворителем
Для растворов нелетучих веществ закон Рауля принимает вид:
 .
.
Формулировка закона Рауля: относительное понижение давления пара растворителя над раствором по сравнению с давлением пара чистого растворителя при той же температуре равно мольной доле растворенного нелетучего вещества.
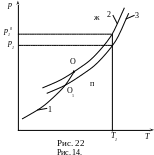 На
рис. 22: 1 – кривая зависимости давления
насыщенного пара над чистым твердым
растворителем (кривая возгонки);
На
рис. 22: 1 – кривая зависимости давления
насыщенного пара над чистым твердым
растворителем (кривая возгонки);
2 – кривая зависимости давления насыщенного пара над чистым жидким растворителем (кривая испарения);
3 – кривая зависимости давления насыщенного пара над раствором нелетучего вещества с мольной долей ;
,
![]() – тройная точка растворителя и раствора;
– тройная точка растворителя и раствора;
![]() ,
,
![]() – давление насыщенного пара над чистым
растворителем и раствором при
– давление насыщенного пара над чистым
растворителем и раствором при
![]() ;
;
Из рис. 22 видно,
что
![]() .
.
